基于糖尿病视网膜病变的诊断模型对糖尿病肾病有较好诊断效能
李 莹,王 倩,陈小鸟,席 悦,杨 建,刘晓敏,王远大,张 利,蔡广研,陈香美,董哲毅
1中国人民解放军总医院第三医学中心眼科医学部,北京 100039;2中国人民解放军总医院第一医学中心肾脏病医学部//解放军肾脏病研究所//肾脏疾病全国重点实验室//国家慢性肾病临床医学研究中心//肾脏疾病研究北京市重点实验室,北京100853
糖尿病是危害人类健康的全球性公共卫生问题,其中90%为2型糖尿病(T2DM)[1]。我国的T2DM患病率达12.4%[2]。糖尿病肾病是糖尿病最严重的微血管并发症之一,长期以来位居欧美日等发达国家终末期肾病的首位原因,也是我国血液透析患者的第2位病因[3,4]。
肾穿刺活检病理诊断是肾脏疾病诊断的金标准,糖尿病合并的肾脏病理损害包括糖尿病肾病(DN)、非糖尿病肾病(NDRD)以及两者合并出现。DN和NDRD的治疗和预后差异很大,明确诊断是改善预后的关键[5]。但由于患者群体庞大,难以对T2DM合并肾脏损害的患者广泛实施肾活检[5,6]。眼底视网膜微血管是人体唯一能够在活体进行无创及直接可视化检查的组织,通过眼底检查明确的糖尿病视网膜病变(DR)是DN诊断的重要依据[7,8]。为了以无创方法更好的鉴别T2DM患者的DN和NDRD,前期我们基于DR等常用临床参数建立了两种鉴别诊断模型发表于Nephrol Dial Transplant杂志和J Diabetes杂志[9,10],分别称为NDT模型和JDB模型。国内外尚无研究对模型进行大样本验证和比较。
因此,本研究探索解放军总医院第一学中心肾病病医学部22年间2型糖尿病肾活检患者的临床病理特点变迁,对国际已发表NDT和JDB两种鉴别诊断模型[9,10]进行诊断效能评价并比较优劣,分析误判病例的特点,以期获得更好的临床应用。
1 资料和方法
1.1 研究对象
研究1993年1月~2014年12月在解放总医院第一学中心肾病病医学部行肾活检的2型糖尿病患者565例。纳入标准[9,10]:年龄≥18岁、性别不限;临床确诊为2型糖尿病;尿蛋白定量≥500 mg/24 h;或尿白蛋白排泄率≥300 mg/24 h;血肌酐<442µmol/L;肾脏病理诊断资料完整。排除标准[9,10]:病史资料记录不全;无明确的眼底检查结果;合并自身免疫系统疾病、肿瘤;合并急性肾损伤;病理诊断为DN合并NDRD。
1.2 研究对象分组
考虑经济卫生状况的发展,及我中心肾活检开展的时间,以及组间样本量的平衡,将22年间的数据按时间先后分为早期:1993年~2003年,DN组(n=60),NDRD组(n=50例);中期:2004年~2012年4月,DN组(n=93),NDRD组(n=107);晚期:2012年5月~2014年12月,DN组(n=106),NDRD组(n=149)。每个时期分别以肾脏病理诊断为依据分为DN组及NDRD组。所有患者签署知情同意书。本研究得到解放军总医院伦理委员会的批准(S2014-012-01)。
1.3 研究对象信息采集
一般信息:性别、年龄、BMI;临床特征信息:糖尿病病史,是否合并高血压、糖尿病视网膜病变,收缩压;实验室检查指标:血红蛋白、血清白蛋白、糖化血红蛋白(HbA1c)、血肌酐、估算肾小球滤过率(eGFR)、血尿酸、甘油三酯、总胆固醇、血尿有无、24 h 尿蛋白定量;NDRD组病理类型。
1.4 研究设计(诊断试验)
1.4.1 DN和NDRD诊断金标准 肾穿刺活检病理。
1.4.2 DR 诊断标准 将轻、中、重度非增殖期DR(NPDR)及增殖期DR(PDR)记录为DR。诊断基于散瞳裂隙灯下前置镜眼底检查、眼底彩色照相及眼底血管荧光造影检查。由1位眼科高年资主治医师及1位眼科副主任医师共同依据检查结果进行诊断,当对病变的性质有疑问时,由眼底病专业主任医师裁定。诊断依据国际分级标准[11]:无明显DR;轻度NPDR,仅见微动脉瘤;中度NPDR,有微动脉瘤,但程度轻于重度NPDR;重度NPDR,无PDR表现,但有下列任一表现:任一象限有多于20处的视网膜内出血;超过2个象限内静脉串珠样改变;1 个或以上象限有显著的视网膜内微血管异常;PDR,有明显的新生血管形成、视网膜前出血或玻璃体出血。
1.4.3 评价模型(1)依据我中心1993年~2003年数据建立的DN和NDRD鉴别诊断模型为NDT模型;如下所示[9]:
Dm:糖尿病病史(月);Bp:收缩压(mmHg);Gh:糖化血红蛋白(%);Hu:合并血尿(1是,0否);Dr:合并糖尿病视网膜病变(1是,0否)。
(2)依据我中心2004 年~2012 年4 月数据建立的DN和NDRD鉴别诊断模型为JDB模型,如下所示[10]:
Gh:糖化血红蛋白(≥7%赋值为1,<7%赋值为0);Hb:血红蛋白(g/L);Hu:合并血尿(尿RBC>10/HP赋值为1,≤10/HP赋值为0),余同NDT模型。
以上两模型,PDN为诊断DN的概率,PDN≥0.5诊断为DN,PDN<0.5诊断为NDRD。
1.5 统计学分析
采用SPSS 软件(Version 17.0 版本)进行统计分析。用Kolmogorov-Smirnov检验对连续变量进行正态性检验;对于正态分布连续变量的统计量用均数±标准差表示,两组间比较采用t检验;3组间总体分布的比较采用单因素方差分析,若总体分布具有统计学差异,进一步采用Scheffe法进行两两比较。对于偏态分布计量资料的统计量用中位数(四分位间距)表示,组间比较采用Wilcoxon秩和检验;分类变量的统计量用构成比(%)表示,对于两组间构成比的比较采用χ2检验;对于3组间构成比的总体分布比较采用R×C无序列联表多个样本构成的χ2检验,若总体分布具有统计学差异,进一步进行两两χ2检验,此时P<0.05表示差异具有统计学意义。采用MedCalc Version 软件(11.2.1 版本)绘制受试者ROC曲线,并比较ROC曲线下面积(AUC)。研究中所有检验均为双侧性检验,如果P<0.05表示差异具有统计学意义(除外两两χ2检验),如果P<0.01则表示差异具有显著统计学意义。
2 结果
2.1 DN和NDRD患者不同时期临床特征的比较分析
早、中、晚3个时期DN组高血压及DR的发生率,HbA1c、肌酐及尿素氮、24 h尿蛋白定量均高于NDRD组,血红蛋白、甘油三酯均低于NDRD组(P<0.01),高尿酸的发生率、血尿酸、胆固醇在两组间差异均无统计学意义(表1)。
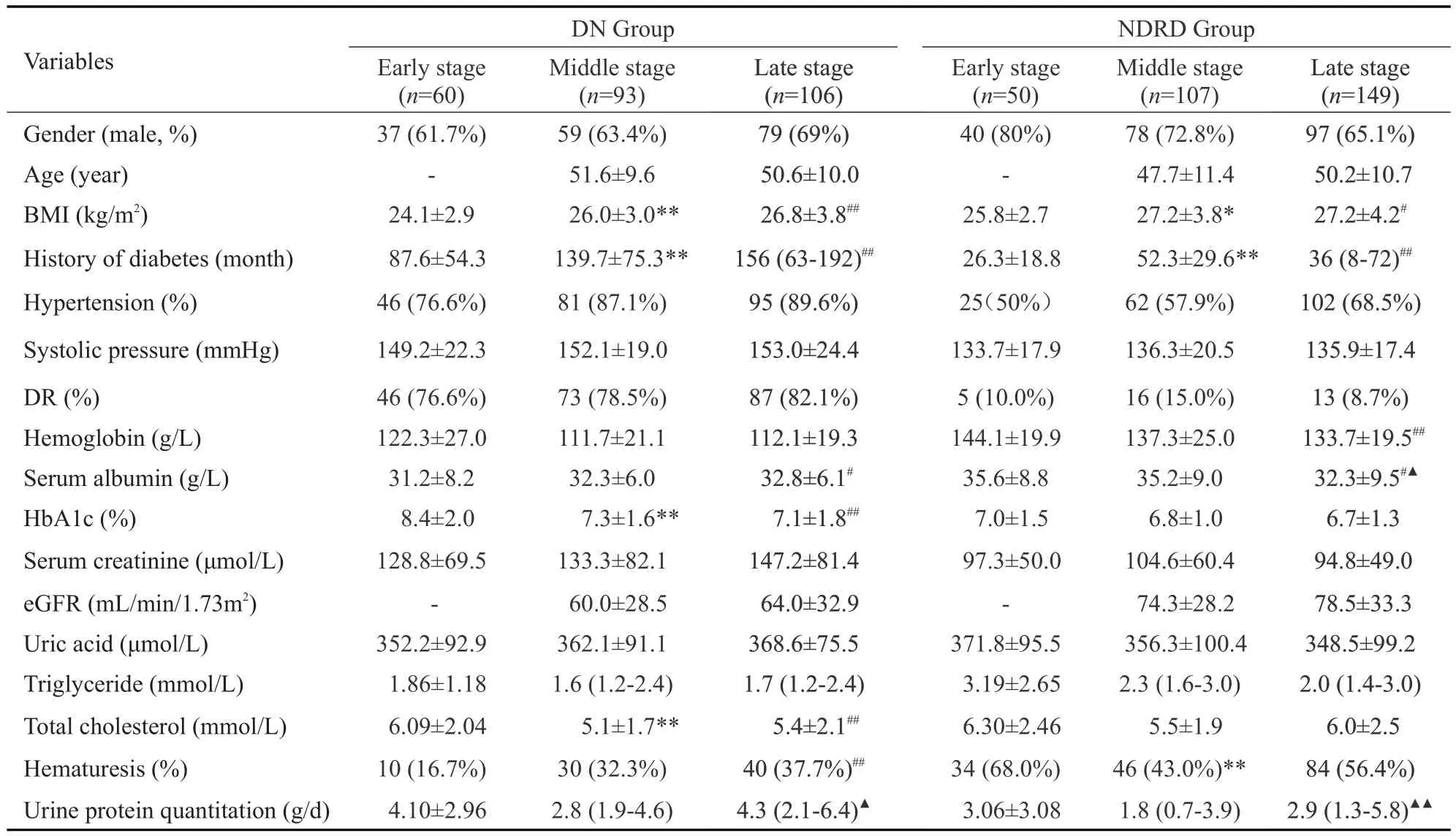
表1 早中晚期DN组与NDRD组患者临床特征的比较Tab.1 Comparison of clinical characteristics of DN and NDRD cases collected in the early,middle,and late stages
2.2 不同时期NDRD病理类型分布的比较
早、中、晚3个时期,NDRD的比例分别为45.5%、53.5%和58.4%,最主要的两种病理类型均为IgA肾病和膜性肾病。在NDRD的病理类型构成中,早期和中期IgA肾病占第1位,分别占34%和32.7%,晚期IgA肾病的比例虽然升至36.9%,但在NDRD构成比排名中下降至第2位,膜性肾病升至首位,占39%(图1)。
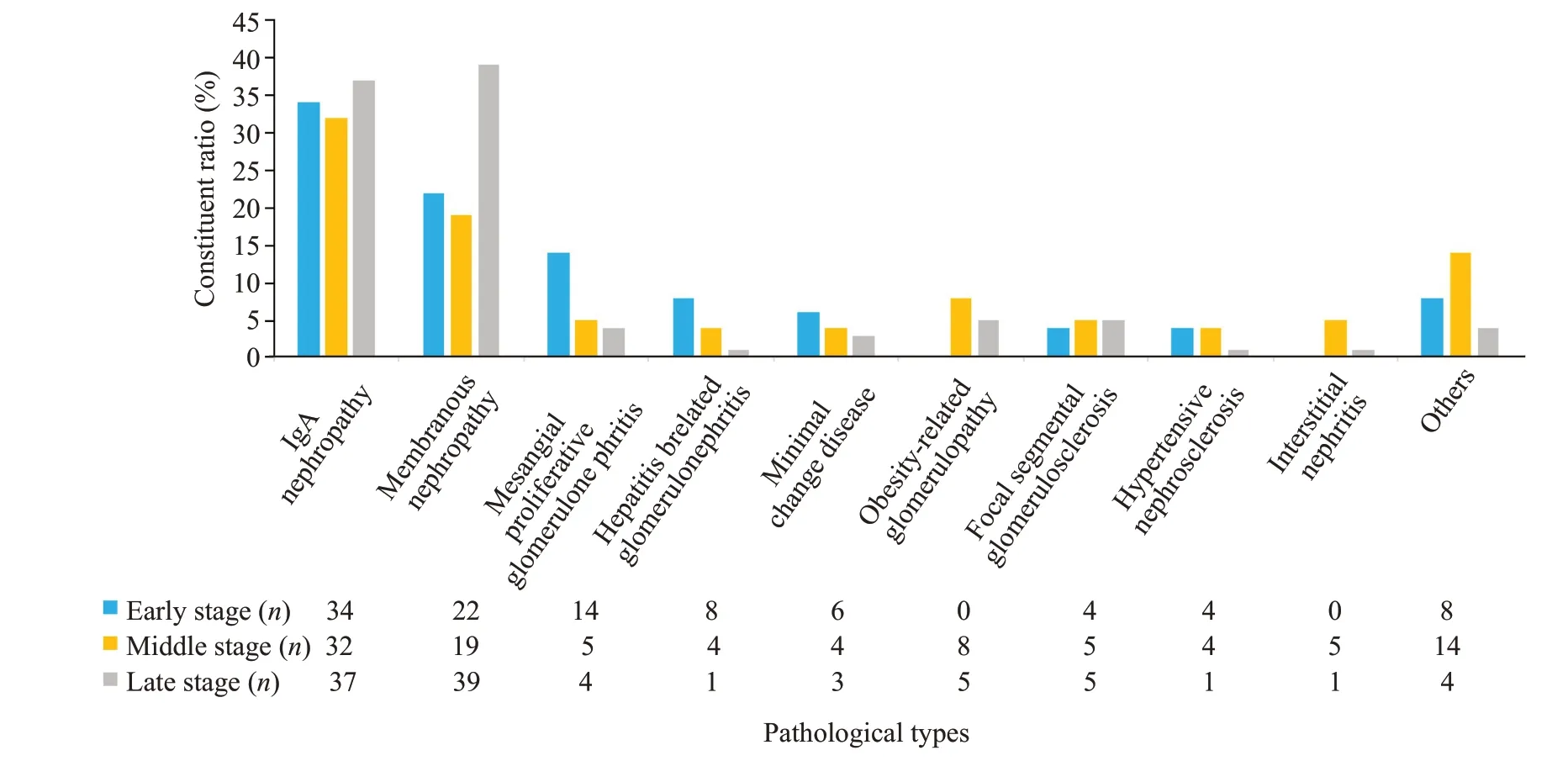
图1 早、中、晚期NDRD组病理类型分布Fig.1 Distribution of pathological types of NDRD cases collected in early,middle and late stages.
2.3 对JDB模型和NDT模型的评价和比较
两模型中,JDB模型诊断的真实性较好,Youden指数为0.8,准确度为89.9%,能较好的对DN和NDRD患者进行鉴别;虽然NDT模型诊断的符合率差于JDB模型,准确度为80.78%,但其特异度高达98.66%,可高效的鉴别出NDRD患者(表2)。
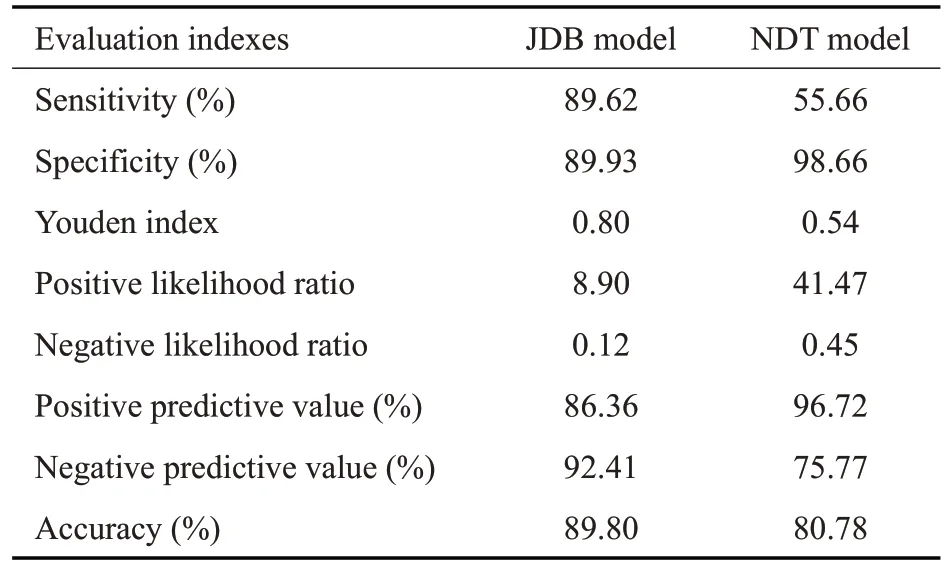
表2 JDB模型和NDT模型诊断试验评价指标Tab.2 Diagnostic test evaluation indexes of JDB model and NDT model
用AUC评价两模型诊断效能的优劣,发现JDB模型AUC为0.946(95%CI 0.911~0.971),NDT模型AUC为0.925(95%CI0.886~0.954),但两者AUC的差异无统计学意义(P=0.198)。
2.4 对JDB模型和NDT模型误判病例的评价和比较
JDB模型误判病例数为26例,其中将NDRD误判为DN 15例,将DN误判为NDRD 11例。病理诊断为NDRD 的149 例患者中,被JDB 模型误判为DN 者15例,与被正确判断的134例NDRD患者比较发现,误判的患者T2DM病史较长,血尿的发生率低,DR的发生率高(P<0.05)。而收缩压、糖化血红蛋白、血红蛋白在两组患者中无差异。病理诊断为DN的106例患者中,被JDB模型误判为NDRD者11例,与被正确判断的95例DN比较发现,误判的患者T2DM病史较短,血尿的发生率高,DR的发生率低,且血红蛋白较高(P<0.05)。而收缩压、HbA1c在两组患者中无差异。
NDT模型误判病例数为49例,其中将NDRD误判为DN 2 例,将DN 误判为NDRD 47 例。病理诊断为DN的106例患者中,被NDT模型误判为NDRD者47例,与被正确判断的59 例DN 比较发现,误判的患者T2DM病史较短,血尿的发生率高(P<0.05)。而收缩压、HbA1c、DR在两组患者中无差异。病理诊断为NDRD的149例患者中,被NDT模型误判为DN者仅2例,无法与被正确判断的147例NDRD进行统计学比较。
3 讨论
利用数学方法建立概率诊断模型,为疾病提供可量化的无创诊断策略,是实施临床诊断、提高诊断准确率和可重复性的有力手段。Logistic回归作为传统模型在很多研究中效能高,在预测慢性病风险方面与机器学习模型具有相同的性能[12],诊断模型的变量权重明确、直观、可解释性好,模型可以直接使用,对于临床医生学习成本低。诊断模型已在动脉粥样硬化等心血管疾病[13]、慢性肾病[12]、急性肾损伤[14]等多类疾病的诊断和预测中得到应用。
1型糖尿病肾病(T1DN)临床特征典型,若DM病史>10年,合并DR,病理证实DN诊断符合率达95%以上,不必须行肾活检[15]。2型糖尿病肾病(T2DN)的拟诊证据多数源自T1DN,并因患者基数庞大,肾活检率不足25%[6]。而T2DN患者临床表现复杂,DN和NDRD的鉴别困难[16],准确率低。本团队的系列研究首次基于肾活检“金标准”建立的logistic模型鉴别DN和NDRD,能够合理分配各临床参数的权重,使临床经验和临床证据的结合可量化、科学性和实用价值更强[9,10]。
在Logistic回归数学模型的多种临床参数中,DR是DN诊断的最主要依据之一。中国人群中DN和DR相关性的研究发现,经肾活检确诊为T2DN的患者中,48.8%伴有DR[17]。患有DR 的患者DN 的风险增加31%[18]。DR与DN具有共同的危险因素,并与DN的的发病机制相似,涉及氧化应激[19]、糖基化终末产物的大量堆积[20]、遗传因素[21]等。DR的严重程度是2型糖尿病患者进展为CKD的危险因素[22],视网膜血管口径变化可以预测DN的风险[23],DR血管异常是肾功能受损的预测因子,而微量白蛋白尿是DR进展的准确生物标志物[24],同时DN是DR发生和进展的独立危险因素[25]。在本研究不同时期所建立的Logistic回归数学模型中DR都具有较高的权重。虽然DR对DN有重要的辅助诊断价值,但诊断标准的主观性强,将来需联合更多的客观指标进行综合判断。
HbA1c是评价糖尿病血糖控制的有效指标,也是DN发生风险预测的重要参数[26,27]。虽然各个时期DN组HbA1c水平均高于NDRD组,但随时间变迁两组的HbA1c水平均出现了下降。2022年ADA指南[28,29]建议如果患者无明显的低血糖或其他治疗副作用,将HbA1c控制在6.5%以下更合理。我国40岁以上人群研究数据显示,HbA1c≥5.5%与尿白蛋白/肌酐比值呈正相关且独立相关[30]。这都促使糖尿病患者血糖控制更加严格。除此之外,我们还发现DN组HbA1c水平随时间变迁下降更显著。在肾病患者中容易受肾性贫血、红细胞周期缩短等干扰因素的影响而造成结果假性降低[31]。由于DN组肾功能更差、贫血更严重,DN患者的HbA1c可能低于实际水平。
合并血尿是拟诊NDRD的重要依据之一,中晚期患者血尿的总体发生比例较早期增加,这与肾活检指征的改变有关。随着就诊患者量的激增以及对临床证据和指南[32-34]掌握的不断完善,临床医生越来越倾向于仅对拟诊NDRD的患者行肾活检病理检查[5]。其中,3个时期NDRD 患者比例的逐渐增加(分别为45.5%、53.5%、58.4%)也印证了肾活检指征的变化。
早期的NDT模型[9]回代验证灵敏度为90%,特异度为92%,AUC达0.9677。中期数据对模型进行验证,发现诊断效能有所下降,考虑与模型中临床参数随时间发生变迁有关,因此对NDT模型进行了“与时俱进”的优化,新建立JDB鉴别诊断模型[10]。前瞻性验证证实新模型诊断的灵敏度为84.2%,特异度为94.4%,AUC 达0.971。晚期数据验证JDB模型的Youden指数为0.8,准确度为89.9%,说明它能够较好的区分DN和NDRD患者,总体鉴别能力较好。NDT 模型特异度高达98.66%,说明它能够较好的鉴别出NDRD患者,但由于灵敏度仅为55.66%,因此对DN患者的识别能力较差。JDB模型的AUC比NDT模型高0.0212,但总体诊断效能的差异无统计学意义(P=0.1982)。
通过对误判病例与正确判断病例的各模型参数进行比较,明确被误判的患者特点,在已经模型判断分组的患者中,挑出具备这些特点的患者,进行综合分析和临床鉴别诊断,是减少误判率,更好利用模型的方法。误判分析结果显示,在两模型的各临床参数中,是否合并DR、病史长短、有无血尿是影响模型判断准确度的重要因素。
IgA肾病和膜性肾病一直以来都是我中心NDRD的主要病理构成[35],但早期和中期都以IgA肾病为主(分别为34%和32%),晚期IgA肾病的构成比与前期基本持平(37%),但膜性肾病的比例显著增加,由前两个时期的22%和19%上升为39%,首次成为NDRD的最主要病理类型。我们中心前期大样本的研究中膜性肾病患者占NDRD患者的33.55%[36],在伊朗和土耳其两项单中心研究中膜性肾病患者也是NDRD的首位病理类型构成,所占比例分别为34%[37]、62.5%[38]。
总之,通过基于DR的DN诊断模型效能的分析,我们认为NDT诊断NDRD的符合率较高,是肾活检指征的有益补充。而当肾活检开展受限的情况下,可使用JDB模型进行诊断推断。期待通过多中心大样本的数据积累和眼底照片的特征分析,对DN和NDRD模型进行优化和效能提升,为疾病的无创鉴别诊断提供更确信可靠的前沿方法。