枳实大黄汤对急性缺血性脑卒中患者Ghrelin、Nesfatin-1及炎症因子的影响*
曹凤娇 吕 双 颜雨晴 张 越 张敬华△
(1.江苏省江阴市中医院,江苏 江阴 214400;2.江苏省第二中医院,江苏 南京 210019;3.南京中医药大学附属南京中医院,江苏 南京 210001)
根据《中国卒中防治报告2019》的调查,脑卒中在我国的发病率高达39.9%,现已成为我国成人致残及致死的首要因素[1],减少脑梗死的发病率、致残率及死亡率,改善急性缺血性脑卒中的预后,是目前临床研究热点。临床发现,脑梗死急性期的诊疗是影响患者预后的重要因素,排便困难已成为脑梗死急性期患者相当常见的不良反应[2],根据数据统计,中风事件急性期及康复期的便秘发生率分别占45%及48%[3]。中医学总结出“卒中以通大便为要务”的治疗方法,通腑法治疗脑梗死急性期已成为中风病临床研究热点之一。本研究探讨复方加减枳实大黄汤对脑肠肽胃饥饿素(Ghrelin)、人新饱食分子蛋白1(Nesfatin-1)及血浆炎性因子白细胞介素-4(IL-4)、转化生长因子-β(TGFβ)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的影响,为脑卒中的中医治疗提供新的治疗思路。
1 资料与方法
1.1 病例选择 西医诊断符合西医急性缺血性脑卒中的诊断标准[4];中医诊断标准参照《中风病诊断与疗效评定标准(试行)》[5],符合中风病急性期痰热腑实证诊断标准。纳入标准:入院时经头颅CT 和(或)MRI确诊;首次发病,发病时间在3 d 内者;年龄>18 岁;发病后未经静脉溶栓或动脉取栓。排除标准:伴随脑梗死外其他神经系统疾病者;非脑梗死急性期者;伴随其他系统重大疾病者;妊娠期或哺乳期患者;对中药成分过敏及过敏体质患者;已参加其他药物临床试验者。
1.2 临床资料 选择2021 年1 月至2022 年6 月收治的脑梗死急性期住院患者60 例,按随机数字表法分为两组。治疗组30 例,男性20 例,女性10 例;平均年龄(67.41±11.53)岁;合并原发性高血压19 例,糖尿病13例,冠心病6 例,房颤2 例,吸烟史15 例,饮酒史9 例。对照组30 例,男性17 例,女性13 例;平均年龄(69.07±10.44)岁;合并原发性高血压22 例,糖尿病14 例,冠心病6例,房颤1例,吸烟史11例,饮酒史4例。两组临床资料比较,差异无统计学意义(P>0.05)。
1.3 治疗方法 两组均参照《中国急性缺血性脑卒中诊治指南2018》[4]行神经内科常规治疗,包括抗血小板聚集、调脂稳斑,调控血压、血脂、血糖,防治感染、营养支持、维持水/电解质平衡等。治疗组在常规治疗基础上配以加减枳实大黄汤:熟大黄10 g,枳实10 g,厚朴10 g,黄芩10 g,木香3 g,甘草3 g。上方浓煎100 mL,每日1次,口服,连续服用14 d。
1.4 观察指标 1)观察两组治疗前后美国国立卫生研究院卒中量表(NIHSS)评分,评分越高神经功能越差。2)采用日常生活活动(ADL)量表(Barthel 指数记分)评估中风预后,侧重于身体功能与肢体活动,满分为100 分,分数越低提示日常行为与自理能力较差。3)治疗前后分别抽取两组患者静脉血5 mL,4 ℃离心,取血清,检测血清脑肠肽Ghrelin、Nesfatin-1、炎性因子(IL-4、TGF-β、IL-6、TNF-α)表达水平。
1.5 疗效标准 中医证候积分改善率=(治疗前积分-治疗后积分)÷治疗前积分×100%。改善率<30%为无效;改善率≥30%,<70%为有效;改善率≥70%,<95%为显效;改善率≥95%为临床痊愈。
1.6 统计学处理 应用SPSS25.0 统计软件。正态分布的计量资料以(±s)表示,检验不同组之间的差异采用t检验,同组治疗前后采用配对t检验。计数资料以“n、%”表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 两组治疗前后NIHSS、BI指数评分比较 见表1。两组患者治疗后,NIHSS 评分均下降,BI 评分均上升(P<0.05)。两组比较,治疗组改善更加显著(P<0.05)。
表1 两组治疗前后NIHSS、BI指数比较(分,±s)

表1 两组治疗前后NIHSS、BI指数比较(分,±s)
注:与本组治疗前比较,*P <0.05;与对照组治疗后比较,△P <0.05。下同。
BI 40.83±16.67 64.67±15.14*△42.17±11.87 56.83±13.16*组 别治疗组(n=30)对照组(n=30)时间治疗前治疗后治疗前治疗后NIHSS 8.30±3.21 4.17±1.91*△8.23±3.75 5.90±3.41*
2.2 两组治疗前后中医证候评分比较 见表2。治疗后,治疗组咳嗽咯痰、腹痛腹胀、大便秘结、舌红、苔黄腻症状较治疗前显著改善(P<0.05);对照组的咳嗽咯痰、腹痛腹胀症状较治疗前显著改善(P<0.05)。
表2 两组治疗前后中医证候评分比较(分,±s)
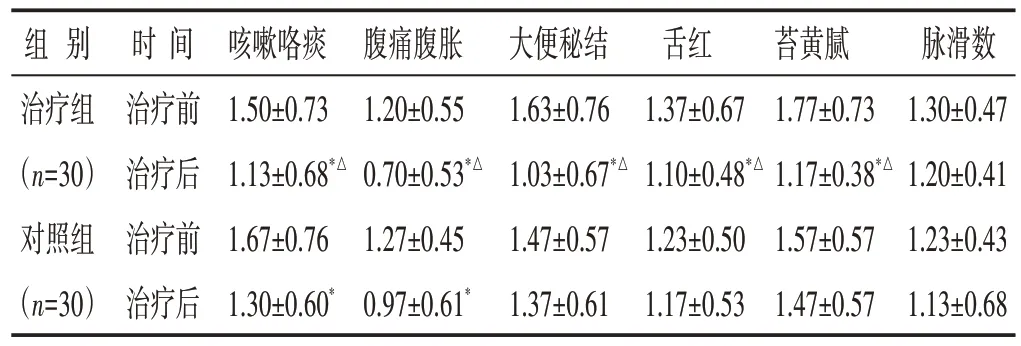
表2 两组治疗前后中医证候评分比较(分,±s)
组别治疗组(n=30)对照组(n=30)时间治疗前治疗后治疗前治疗后咳嗽咯痰1.50±0.73 1.13±0.68*△1.67±0.76 1.30±0.60*腹痛腹胀1.20±0.55 0.70±0.53*△1.27±0.45 0.97±0.61*大便秘结1.63±0.76 1.03±0.67*△1.47±0.57 1.37±0.61舌红1.37±0.67 1.10±0.48*△1.23±0.50 1.17±0.53苔黄腻1.77±0.73 1.17±0.38*△1.57±0.57 1.47±0.57脉滑数1.30±0.47 1.20±0.41 1.23±0.43 1.13±0.68
2.3 两组治疗前后脑肠肽水平比较 见表3。治疗后,两组患者的Ghrelin、Nesfatin-1 表达水平均上调(P<0.05);治疗组的上升趋势优于对照组(P<0.05)。
表3 两组治疗前后脑肠肽水平比较(ng/mL,±s)

表3 两组治疗前后脑肠肽水平比较(ng/mL,±s)
组 别治疗组(n=30)对照组(n=30)时间治疗前治疗后治疗前治疗后Ghrelin 85.17±15.70 112.87±15.26*△89.06±15.85 98.88±22.41*Nesfatin-1 551.55±96.69 678.50±101.42*△559.85±101.54 609.30±98.33*
2.4 两组治疗前后炎症因子水平比较 见表4。治疗后,两组患者TGF-β、IL-4 均上升(P<0.05),治疗组TGF-β 高于对照组(P<0.05);两组患者促炎因子IL-6、TNF-α 均降低(P<0.05),治疗组低于对照组(P<0.05)。
表4 两组治疗前后炎症因子水平比较(ng/mL,±s)

表4 两组治疗前后炎症因子水平比较(ng/mL,±s)
组 别治疗组(n=57)对照组(n=57)时间治疗前治疗后治疗前治疗后IL-4 28.08±5.46 35.94±6.85*26.97±4.93 32.14±7.96*TGF-β 0.39±0.14 0.64±0.12*△0.41±0.15 0.53±0.18*IL-6 88.81±13.39 69.68±9.72*△86.12±10.85 77.87±9.65*TNF-α 46.14±7.50 34.09±6.18*△44.77±8.05 38.89±8.18*
2.5 两组中医临床疗效比较 见表5。两组治疗后,治疗组的有效率高于对照组(P<0.05)。
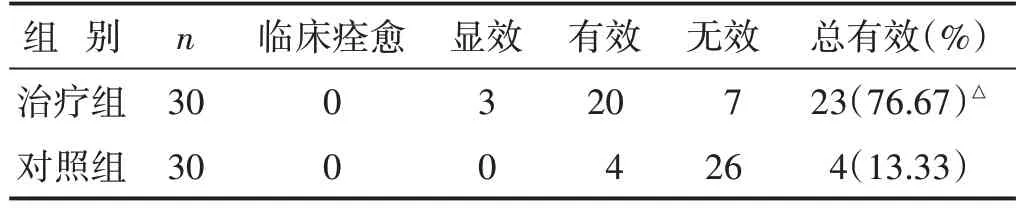
表5 两组中医临床疗效比较(n)
3 讨 论
卒中的高致病率、高致残率、高死亡率对患者身体健康及家庭社会经济都造成了巨大的影响。近年来,脑肠轴的研究及发展为治疗脑卒中提供了新的研究方向,脑肠轴作为脑与肠间之间的双向应答通路,可对脑与肠道进行协同调节。缺血性中风后,患者可出现吞咽困难、胃肠道出血、胃肠道排空延迟和结肠直肠功能障碍等胃肠道症状[6],针对胃肠道功能障碍的治疗,亦可改善患者神经系统功能缺损症状。基于此,本次研究提出通过观察胃肠激素的变化,调节肠道功能,治疗脑梗死急性期的设想。
Ghrelin、Nesfatin-1 作为脑肠肽,具有调控肠道及神经功能的作用。Ghrelin 主要由胃泌酸腺中的特定细胞及小肠产生[7],在胃肠道中具有促食、调节胃肠运动、改善胃肠功能障碍等作用[8],在中枢神经系统具有改善神经功能表现,减少脑梗死和脑肿胀,并减少细胞凋亡,同时还具有防御血脑屏障破坏的能力[9]。Nesfatin-1主要在大脑以及外周内分泌器官中结合产生[10],Nesfatin-1 能够抑制进食,并减弱胃窦和十二指肠运动,减少胃排空[11]。在中枢神经系统中具有抑制炎性反应、调节氧化应激与细胞凋亡的作用[10]。
研究显示,Ghrelin 与Nesfatin-1 对脑梗死等神经系统发挥保护作用的机制,可能与调节炎症因子的表达相关。炎症因子主要由卒中后活化的小胶质/巨噬细胞产生,主要分为M1、M2两种,促炎的M1主要于急性期产生,如TNF-α、IL-1β、IL-6 等;M2 主要包括IL-4、IL-10、IL-13、IGF-1 和TGF-β 等抗炎因子,M2 的表达主要用于损伤后的修复[12]。
IL-6 与TNF-α 均为卒中后关键的促炎因子。在脑梗死发生后,细胞凋亡和炎症反应激活并释放IL-6,激活内皮细胞,招募白细胞至血管壁,刺激血管平滑肌增生,导致动脉粥样硬化,而抑制胶质细胞分泌IL-6 可以在缺血性脑卒中起到神经保护作用[13]。TNF-α由巨噬细胞生成,可以上调黏附因子及血管活性物质表达,加重组织炎性浸润及肿胀[14]。而IL-4与TGF-β为卒中过程中的抗炎因子。IL-4 受体增加的信号传导可能减轻中风后的炎症环境,起到抗炎的作用,并为神经功能恢复奠定基础[15]。TGF-β 在脑缺血后上调,通过抑制T 细胞Th1 和Th2 反应并促进调节性T 细胞(Treg细胞)的发育而具有神经保护作用[16]。
Ghrelin 主要表现为降低TNF-α 诱导的炎症因子的表达,增强一氧化氮的活性,减少炎症反应及氧化应激[17]。Nesfatin-1 的抗炎作用主要通过抑制中性粒细胞浸润、减少Iba-1 阳性细胞数量和抑制星形胶质细胞活化、NF-κB 炎症通路、炎症介质(如TNF-α、IL-1β和IL-6)等的浓度来减少炎性反应产生[10,18]。
本次研究运用明代龚廷贤《万病回春》记载的枳实大黄汤,在原方基础上进行加减,去有毒之槟榔,加清热燥湿,泻火解毒之黄芩。本方中大黄味苦,性寒,降而不升,泻而不补,擅下胃肠结热之有形积滞;枳实味苦,性微寒,破气开痞,可泄胃肠结气之无形气痞;厚朴味苦、辛,性温,行气除满;3 药合用,共使气行结开,浊降清升之效。加木香,辅枳实行气导滞,化痰除痞。加黄芩助大黄清热泻火,解毒开窍,又黄芩善解热生之湿;炙甘草调和诸药。全方共奏通腑泄浊、调气导滞之效。前期研究已经证实加减枳实大黄汤可改善急性缺血性脑卒中(痰热腑实证)神经缺损症状,可能与降低血浆中Hcy 水平、抗血小板聚集、扩张血管作用有关[19]。
既往研究表明,大黄对脑组织缺氧有保护作用,并可通过血流动力学的改变减轻脑水肿程度;枳实具有保护神经并兴奋胃肠平滑肌,促进胃肠道蠕动的作用[20];厚朴提取物厚朴酚可有效抑制脑内神经胶质细胞的激活,减少炎性因子IL-1β、IL-6 等的表达[21],并且可以抑制脑缺血缺氧后自由基的产生,抑制凋亡因子caspase-3的激活[22]。同样,研究发现黄芩提取物黄芩苷同样具有降低卒中后IL-1β、IL-6、TNF-α 等炎症因子的作用[23];木香在体内及体外实验中都体现了解痉、促进胃排空的作用[24]。本研究通过临床研究证明,加减枳实大黄汤可以减少炎性因子的生成,提高抗炎因子的表达,调整Ghrelin 及Nesfatin-1 水平,促进胃肠功能障碍及神经功能缺损症状的恢复,改善临床患者痰热腑实证症状,尤其是大便秘结,临床可安全使用。
综上所述,该研究探讨了复方加减枳实大黄汤对脑梗死急性期患者胃肠功能及卒中后炎症状态的调控,对卒中具有神经保护作用。在临床中针对脑梗死急性期患者可以应用此疗法,具有通腑泄浊之功。中医药复方存在多靶点特点,此次研究仅探讨了卒中后使用加减枳实大黄汤对脑肠肽及炎症反应的调控,针对复方改善卒中后神经功能症状的具体机制,后续将通过动物实验以及细胞实验进行更深入的探讨与研究。

