仙茅总黄酮诱导人骨肉瘤MG-63 细胞凋亡的机制研究*
李 婷 汪小玉 税丕先 石厚银 张 旗 沈骅睿△
(1.西南医科大学,四川 泸州 646000;2.四川西部医药技术转移中心,四川 成都 610041;3.西南医科大学附属中医医院,四川 泸州 646000;4.四川省合江县中医医院,四川 合江 646200)
骨肉瘤(OS)是一类原发性恶性肿瘤,好发于儿童和青少年[1]。近5 年OS 患者的生存率虽有一定提高,但转移性和复发性问题依然未得到解决。治疗OS 的经典化疗药物顺铂等也只能缩小肿瘤体积,会产生一系列不良反应[2]。因此,化疗药物的多重耐药以及尚无规范化新型治疗方式等问题,也反映了OS当前治疗策略的不足与无突破性进展的缺陷。
中医学认为OS属于正虚邪实、邪盛正衰的一类恶性骨病[3],依据中医“肾藏精,主骨生髓”等理论[4],应从肾论治。仙茅是石蒜科一味具有补肾助阳、益精血、强筋骨和行血消肿作用的传统中药[5],主要含有酚及酚苷、木质素、三萜皂苷、黄酮类、挥发油及微量元素等化学成分[6-10]。已有研究表明,仙茅对人胃癌细胞、人肝癌细胞、小鼠肉瘤均有较好的抑制作用[11];《本草求真》将仙茅与附子、补骨脂等辛温补益药物划分为一类,而已有研究证明补骨脂素能够诱导骨肉瘤MG-63细胞凋亡[12]。OS 的发病机制与多种信号通路和基因都有联系,其中MAPK 信号通路也称丝裂原活化蛋白激酶,属于丝苏氨酸蛋白激酶,能够被细胞外刺激激活[13]。众多文献资料表明,OS发生和发展所必需的靶点、途径和过程都有该信号通路的参与和调控[14],其家族有4条途径,分别包括ERK1/2、JNK、p38 MAPK 和ERK5。JNK 参与细胞应激、分化及凋亡等过程,p38 MAPK 参与细胞因子的产生、转录、调节以及凋亡等过程[15]。因此JNK 和p38 MAPK 两个途径与细胞凋亡过程密切相关。该信号通路被异常激活后会导致OS 的发生。但目前针对仙茅黄酮的研究还较少,我们前期预实验发现仙茅总黄酮具有抑制骨肉瘤细胞增殖、诱导其凋亡的作用趋势,但并未深入研究其作用机理。因此,本研究拟以人骨肉瘤MG-63 细胞为模型,探讨仙茅总黄酮通过MAPK 信号通路及凋亡相关因子诱导其凋亡的作用,以期为开发有效治疗OS的药物提供新的方向和实验依据。
1 材料与方法
1.1 试剂与药物
仙茅饮片购自成都荷花池中药材市场,经鉴定为石蒜科植物仙茅的根茎。CCK-8 试剂盒购自武汉BOSTER 公司;Hoechst 33258 染色液购自北京索莱宝公司;AnnexinV-FITC 试剂盒购自碧云天生物技术研究所;Bcl-2、Bax、Caspase-3、JNK、p38 MAPK、GAPDH抗体购自美国CST 公司;羊抗兔IgG(H+L)HRP、ECL超敏发光液购自Affinity 公司;彩色预染蛋白marker 购自赛默飞公司;DMEM 培养基、胎牛血清、青链双抗购自以色列BI公司;水为超纯水。
1.2 仪器
Synergy 2 型全波长酶标仪,购自美国Bio Tek 公司;TS2R-LS 型倒置荧光显微镜,购自日本Nikon公司;FACSCantoⅡ型流式细胞仪,购自美国BD 公司;LightCycler® 480 Ⅱ型荧光定量PCR 仪,购自瑞士Roche 公司;Gel Doc XR 型凝胶成像系统、JT300C 型垂直电泳仪,购自美国Bio-Rad 公司;Eppenderf 5424R型高速冷冻离心机,购自德国Eppenderf 公司;BPN-150CRH 型CO2培养箱,购自上海一恒科学仪器有限公司。
1.3 细胞
人骨肉瘤MG-63 细胞株(MP-0046),购自河南多沃生物科技有限公司。
1.4 研究方法
1.4.1 仙茅总黄酮药物提取纯化 按本课题组前期研究所得方法[16]制备仙茅总黄酮。取仙茅药材粉末(过4 号筛),以80%乙醇、质量体积比1∶25(mg/mL)、85 ℃加热回流提取2.5 h,提取液过滤,浓缩干燥后以AB-8型树脂进行纯化,上样浓度3 mg/mL,pH 5.0,1 mL/min上样4 BV,7 BV 的50%乙醇1 mL/min 进行洗脱,冷冻干燥后即得仙茅总黄酮,以芦丁为对照品通过NaNO2-Al(NO3)3-NaOH显色法检测并计算得出仙茅总黄酮得率为13.95 mg/g,纯度为9.28%;纯化后纯度提高至40.72%,以提高实验的准确性。
1.4.2 药物配制及细胞培养 使用前将仙茅总黄酮粉末用空白DMEM 高糖培养基溶解至总黄酮浓度为500 mg/L 的母液,过0.22 μm 滤膜除菌,备用。MG-63细胞培养于含10% 胎牛血清和1% 青-链双抗的DMEM 高糖培养基中,于37 ℃、5% CO2培养箱中常规培养。
1.4.3 CCK-8 法检测细胞增殖[17]设置不加细胞的空白组、不加药物的对照组和给药组(总黄酮质量浓度为25、50、100、200、300、400、500 mg/L),每组4 个复孔。取对数生长期的MG-63细胞,调整细胞密度为8×104/mL,每孔100 μL 均匀接种于96 孔板中,培养至完全贴壁后给药,分别培养24、48、72 h,每孔加入CCK-8试剂10 μL,37 ℃孵育30 min,置酶标仪上于450 nm处检测各孔光密度(OD)值,计算细胞存活率,用SPSS 17.0软件计算半数抑制浓度(IC50)。上述实验重复3次。
1.4.4 Hoechst 33258染色法观察细胞核凋亡形态[18]设置对照组及仙茅总黄酮低、中、高浓度组(50、100、200 mg/L),每组设3 个复孔。将对数生长期的MG-63细胞按1×104个/孔的密度接种于24 孔板,培养贴壁后分组给药。弃去旧培养基,加药培养48 h 后加入PBS洗涤细胞,加入0.5 mL 无水甲醇于4 ℃固定3 h,洗涤细胞后每孔加入0.2 mL Hoechst 33258 染色液,室温避光染色10 min,吸除Hoechst洗涤2次,加入PBS 0.5 mL,于荧光显微镜下观察各组细胞凋亡形态并拍照。
1.4.5 AnnexinV-FITC 双染法检测细胞凋亡[19]将对数生长期的MG-63 细胞以2×105个/孔的浓度接种于6孔板中,过夜完全贴壁后按“1.4.4”项下方法分组给药,48 h 后分别收集每组细胞,按照AnnexinV-FITC 细胞凋亡检测试剂盒说明书操作,采用流式细胞仪检测细胞凋亡率。上述实验重复3次。
1.4.6 Western blotting 法检测细胞MAPK 信号通路及凋亡相关蛋白表达水平[20]MG-63 细胞按“1.4.4”项下方法接种细胞、分组并给药。48 h 后提取各组总蛋白,按BCA 法测定每组蛋白浓度,将蛋白样品与上样缓冲液按4∶1 的比例混合,95 ℃变性5 min。取各组蛋白样品30 μg,依次经SDS-PAGE 电泳、转膜、封闭后,分别加入一抗(1∶1 000)4 ℃孵育过夜。TBST 清洗3次,加入二抗(1∶5 000)室温下孵育1 h,TBST 清洗3次,显影。采用Image J 软件处理图片,以GAPDH 为内参蛋白,以目标蛋白与GAPDH的灰度值比值表示目标蛋白的表达水平。每个蛋白表达做3次重复。
1.4.7 RT-PCR 法检测细胞MAPK 信号通路及凋亡相关蛋白mRNA 表达水平[21]MG-63 细胞按“1.4.4”项下方法接种细胞、分组并给药。48 h后按Trizol试剂盒方法提取各组样品总RNA,检测RNA 纯度。按逆转录试剂盒操作方法进行cDNA 合成反应。于95 ℃3 min,95 ℃10 s,60℃10 s,72℃20 s,40个循环进行RT-PCR反应,其所用引物序列见表1。每组基因重复做3 次,得到扩增曲线和CT 值,对各样本的CT 值进行分析,以2-ΔΔCT表示各组基因表达量。计算公式如下:

表1 基因与引物序列
ΔCT = CT目的基因-CTGAPDH;-ΔΔCT = ΔCT目的基因-ΔCTGAPDH;2-ΔΔCT由-ΔΔCT值进行2的幂运算得到。
本实验通过RT-PCR 方法,检测不同浓度仙茅总黄酮作用后JNK2、p38MAPK、Bax、Bcl-2 及Caspase-3的mRNA表达水平。
1.5 统计学处理
2 结 果
2.1 各组细胞增殖情况比较
见表2。由此可知,仙茅总黄酮能对MG-63 细胞产生抑制作用,并呈现出时间和浓度依赖趋势。作用24、48、72 h 后细胞的IC50分别为(273.32±2.44)、(108.35±2.04)、(78.41±1.89)mg/L。虽然药物作用72 h时细胞的IC50值最低,但与作用48 h时的IC50值差距不大,因此以48 h作为药物作用时间,以50、100、200 mg/L作为仙茅总黄酮给药的低、中、高浓度。
表2 各组细胞增殖情况比较(±s)
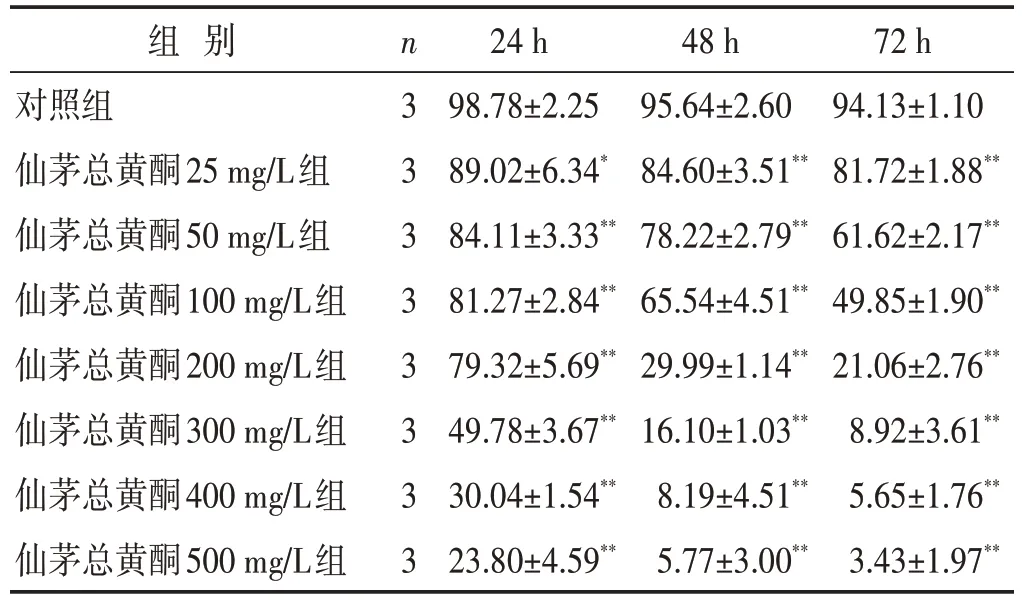
表2 各组细胞增殖情况比较(±s)
注:与对照组比较,*P <0.05,**P <0.01,***P <0.001。下同。
组 别对照组仙茅总黄酮25 mg/L组仙茅总黄酮50 mg/L组仙茅总黄酮100 mg/L组仙茅总黄酮200 mg/L组仙茅总黄酮300 mg/L组仙茅总黄酮400 mg/L组仙茅总黄酮500 mg/L组n3 3 3 3 3 3 3 3 24 h 98.78±2.25 89.02±6.34*84.11±3.33**81.27±2.84**79.32±5.69**49.78±3.67**30.04±1.54**23.80±4.59**48 h 95.64±2.60 84.60±3.51**78.22±2.79**65.54±4.51**29.99±1.14**16.10±1.03**8.19±4.51**5.77±3.00**72 h 94.13±1.10 81.72±1.88**61.62±2.17**49.85±1.90**21.06±2.76**8.92±3.61**5.65±1.76**3.43±1.97**
2.2 各组细胞核凋亡形态比较
见图1。由图可知,对照组中细胞表现为完整的细胞形态,细胞核大小均一,表现为均匀的蓝色淡染;仙茅总黄酮作用后细胞随着药物剂量的升高逐渐固缩、破裂,细胞核表现出高亮的蓝色浓染,染色质逐渐固缩贴近细胞核,因凋亡而碎裂的细胞核也逐渐增多,并出现凋亡小体。因此,仙茅总黄酮作用后细胞表现出了典型的凋亡细胞细胞核荧光特征,且浓度越高,细胞凋亡现象越明显。表明仙茅总黄酮作用于MG-63细胞,可诱导其凋亡。
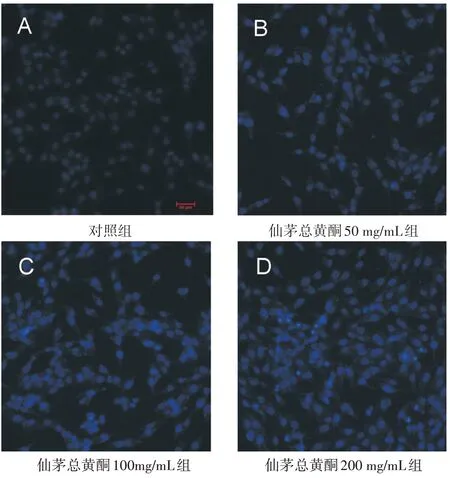
图1 各组细胞凋亡染色(Hoechst 33258染色,200倍)
2.3 各组细胞凋亡比较
见图2。仙茅总黄酮各组细胞加入药物作用48 h后,流式细胞仪检测结果显示,对照组及仙茅总黄酮50、100、200 mg/mL 组的细胞凋亡率分别为(5.47±1.38)%、(16.61±1.19)%、(35.82±2.76)%、(47.98±2.51)%,呈现出浓度依赖趋势,仙茅总黄酮各组与对照组比,差异均有统计学意义(P<0.01),表明不同浓度的仙茅总黄酮均能促进MG-63细胞凋亡。
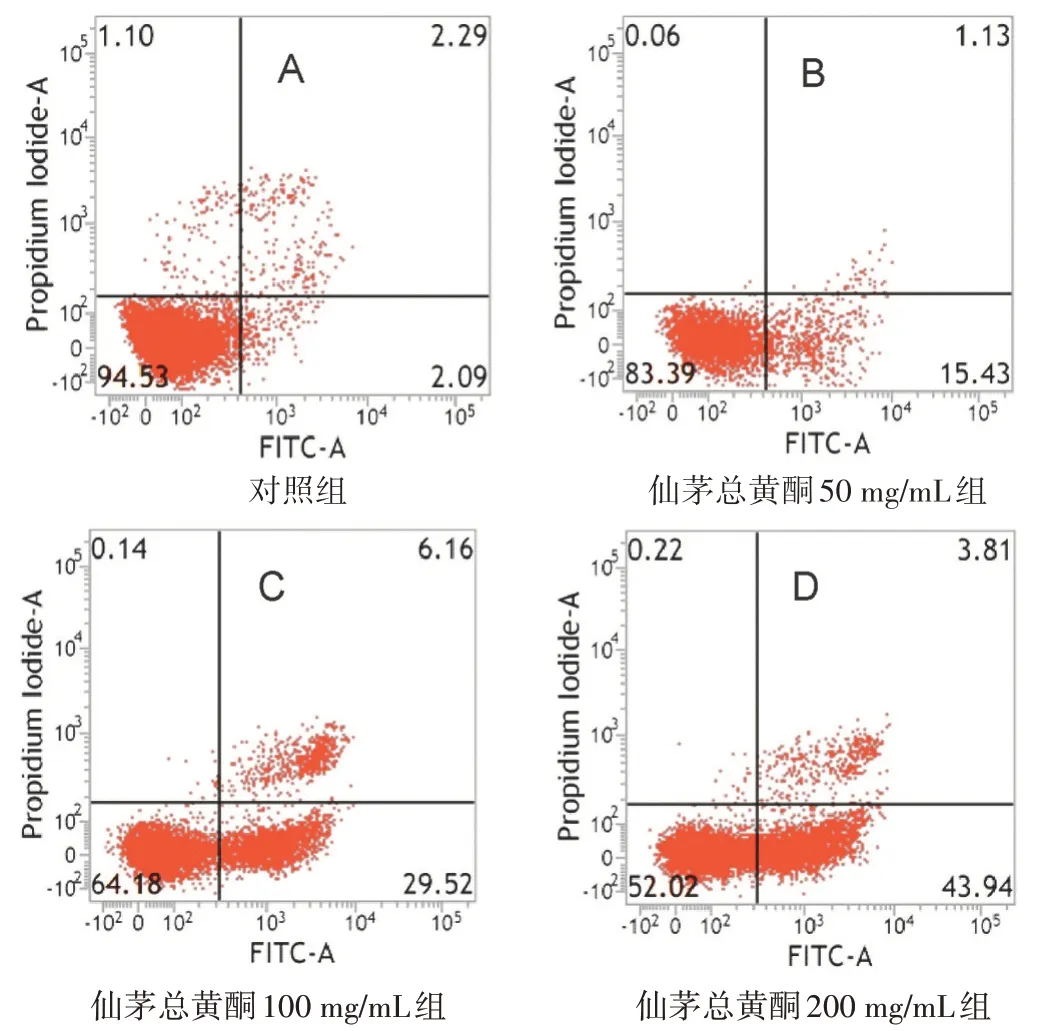
图2 各组流式细胞图
2.4 各组细胞MAPK 信号通路及凋亡相关蛋白表达水平比较
见图3,表3。与对照组相比,仙茅总黄酮作用48 h后,JNK、p38 MAPK 的表达水平在中、高浓度组细胞中显著降低,Caspase-3的表达水平显著升高;Bax的表达水平在药物低、中、高浓度组中均显著升高,Bcl-2的表达水平均显著降低。经统计学分析,以上差异均有统计学意义(P<0.05、P<0.01或P<0.001)。

图3 各组细胞中JNK、p38MAPK及凋亡相关蛋白电泳条带
表3 各组细胞中蛋白相对表达量比较(±s)
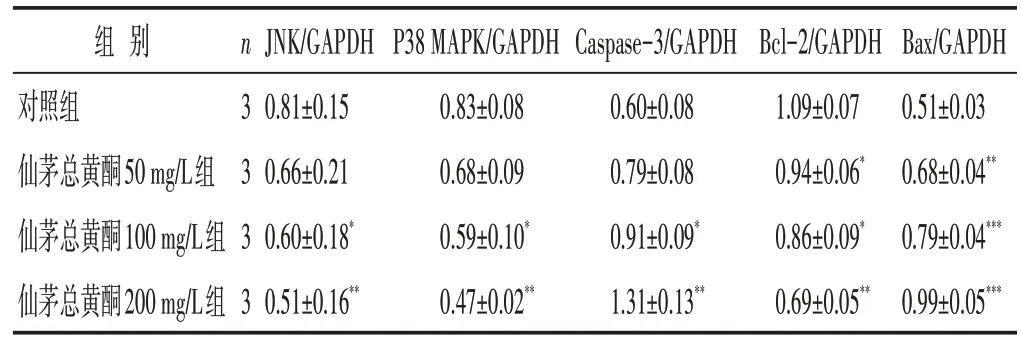
表3 各组细胞中蛋白相对表达量比较(±s)
组别对照组仙茅总黄酮50 mg/L组仙茅总黄酮100 mg/L组仙茅总黄酮200 mg/L组n3 3 3 3 JNK/GAPDH 0.81±0.15 0.66±0.21 0.60±0.18*0.51±0.16**P38 MAPK/GAPDH 0.83±0.08 0.68±0.09 0.59±0.10*0.47±0.02**Caspase-3/GAPDH 0.60±0.08 0.79±0.08 0.91±0.09*1.31±0.13**Bcl-2/GAPDH 1.09±0.07 0.94±0.06*0.86±0.09*0.69±0.05**Bax/GAPDH 0.51±0.03 0.68±0.04**0.79±0.04***0.99±0.05***
2.5 各组细胞MAPK 信号通路及凋亡相关蛋白mRNA表达水平[22]
见表4。不同浓度仙茅总黄酮作用48 h 后,各基因的mRNA表达水平变化趋势与对应蛋白表达水平趋势相同,且与对照组相比,差异均有统计学意义(P<0.05)。
表4 各组基因mRNA表达量比较(±s)
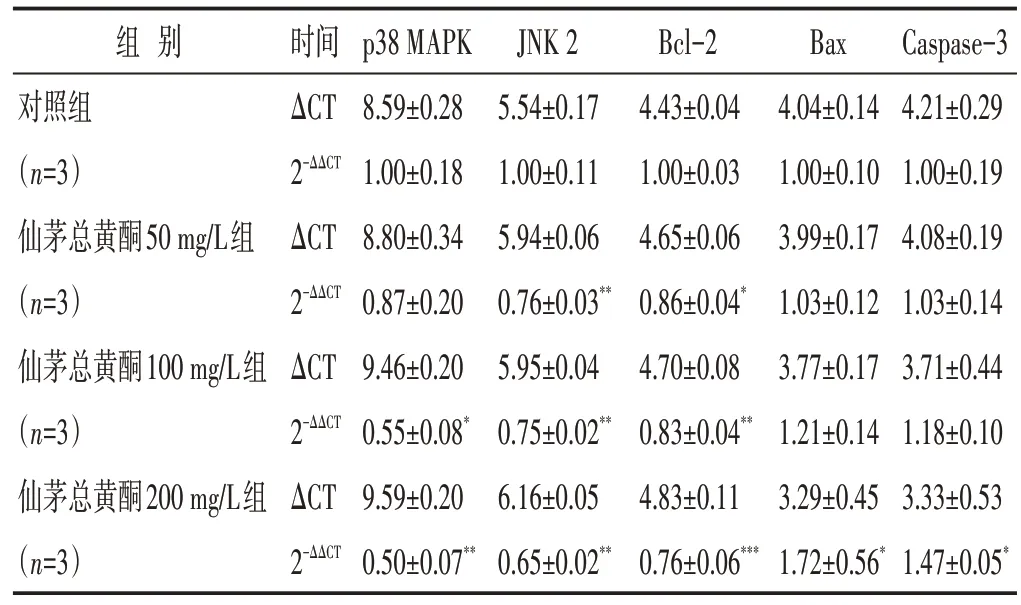
表4 各组基因mRNA表达量比较(±s)
组别对照组(n=3)仙茅总黄酮50 mg/L组(n=3)仙茅总黄酮100 mg/L组(n=3)仙茅总黄酮200 mg/L组(n=3)时间ΔCT 2-ΔΔCT ΔCT 2-ΔΔCT ΔCT 2-ΔΔCT ΔCT 2-ΔΔCT p38 MAPK 8.59±0.28 1.00±0.18 8.80±0.34 0.87±0.20 9.46±0.20 0.55±0.08*9.59±0.20 0.50±0.07**JNK 2 5.54±0.17 1.00±0.11 5.94±0.06 0.76±0.03**5.95±0.04 0.75±0.02**6.16±0.05 0.65±0.02**Bcl-2 4.43±0.04 1.00±0.03 4.65±0.06 0.86±0.04*4.70±0.08 0.83±0.04**4.83±0.11 0.76±0.06***Bax 4.04±0.14 1.00±0.10 3.99±0.17 1.03±0.12 3.77±0.17 1.21±0.14 3.29±0.45 1.72±0.56*Caspase-3 4.21±0.29 1.00±0.19 4.08±0.19 1.03±0.14 3.71±0.44 1.18±0.10 3.33±0.53 1.47±0.05*
3 讨 论
OS 虽整体发病率低于其他器官组织的恶性肿瘤,但转移和复发问题非常严重,恶性程度在病理上被列为高级别。近年来,标准OS 治疗方案逐渐形成:新辅助化疗-手术-辅助化疗[22]。但仍然存在一些问题,导致OS的治疗无显著进展,进入治疗的平台期。文献资料表明,OS 发生和发展所必需的靶点、途径和过程都有MAPK 信号通路的参与和调控[23],MAPK 信号通路中JNK 和p38 MAPK 两个途径与细胞凋亡过程密切相关。Bax 和Bcl-2 蛋白在细胞凋亡过程中分别发挥着促凋亡和抗凋亡作用。Caspase 是细胞凋亡的核心成员,Caspase-3 激活后可诱导线粒体凋亡通路的激活,诱导半胱天冬酶的切割底物多聚聚合酶PARP 的裂解,从而引起细胞凋亡[24]。
本实验在阳性培养基的基础上添加不同浓度的仙茅总黄酮对骨肉瘤MG-63 细胞进行培养。CCK-8、Hoechst 33258 染色、AnnexinV-FITC 双染实验表明不同浓度的仙茅总黄酮能对MG-63 细胞的增殖产生抑制作用,并促进MG-63 细胞凋亡,其促凋亡作用与仙茅总黄酮呈浓度依赖。进一步利用了RT-PCR 和Western blotting 检测验证了上述结果,并表明不同浓度的仙茅总黄酮能够下调MAPK 信号通路中JNK、p38MAPK 和抗凋亡因子Bcl-2 基因和蛋白的表达水平、能够上调促凋亡因子Bax、Caspase-3基因和蛋白的表达水平。
综上所述,仙茅总黄酮能抑制骨肉瘤MG-63 细胞的增殖并促进其凋亡,究其机制可能与抑制MAPK 信号通路的活性、Bcl-2蛋白的表达,促进Bax、Caspase-3蛋白的表达有关。以上研究表明仙茅作为常用的补肾助阳中药,在OS的治疗方面具有巨大的药用价值等待发掘。后期,本课题组也将结合体内实验,建立裸鼠MG-63 细胞移植瘤模型,给予仙茅总黄酮进行干预,通过体内移植瘤各项指标的检测,进一步探究仙茅总黄酮对OS 的治疗作用,并进一步证明其机理,为未来OS的治疗提供新的更完整的理论依据。

