磁分离结合qPCR快速检测酱卤肉中的沙门氏菌
潘晖,许银*,王小红,丁一峰,王世双,龚芳,钟声扬
(1.荆州市食品药品检验所,湖北荆州 434000)(2.华中农业大学食品与科技学院,湖北武汉 430070)
食源性疾病是一项重大公共卫生挑战,粗略估算我国一年发生2.1亿人次以急性胃肠炎为典型症状的食源性疾病,2018年监测到食源性疾病事件6 537起,涉及患者41 750人,死亡135人。因微生物引起的食源性疾病者达到12 226人,其中沙门氏菌感染导致的疾病位列微生物食源性疾病第二位[1]。美国每年有900万人罹患食源性疾病,56 000人住院,1 300人死亡[2],根据美国CDC数据,2009至2018年期间监测到8,131起疫情,131 525起食源性疾病,其中5 986(74%)人有确诊或疑似病因,在确诊或疑似病因中沙门氏菌位列第2(诺如病毒2 798,47%;沙门氏菌1 191,20%;细菌毒素617,10%和STEC O157150,3%)[3]。当前多数研究把沙门氏菌列为除大肠杆菌O157:H7以外重点关注的病原体[4]。
沙门氏菌作为世界第二大食源性致病菌,是一种常见的食源性革兰氏阴性致病菌[5,6],在生鲜类产品中检出率较高,特别是鸡肉和猪肉中[7,8],是食品安全检测领域中的重点监测对象之一,消费者食用了被沙门氏菌感染的食物后,4~48 h发病,因此开发灵敏、特异性的沙门氏菌快检方法,对沙门氏菌引起的食源性食品安全事故进行早识别早预警一直是食品安全监督领域重点关注的问题。
目前国内食品中沙门氏菌快速检测方法主要分为免疫学方法、分子生物学方法和生物传感器法。在一定程度上缩短了沙门氏菌的检测时间,提高了检测效率,但也面临一些挑战,例如上述方法均不能有效区分死细菌和活细菌。免疫学方法存在抗体生产成本高、批次不稳定、易出现假阳性等问题,免疫磁分离技术(Immunomagnetic Separation,IMS)可在磁性微球上键合功能分子(抗体),与抗原发生特异性结合,在外加磁场的作用下实现病原菌的分离与富集,一定程度上可取代增菌培养,但IMS也存在一定局限性,抗体对免疫磁分离效果影响极大,且易产生抗药性,筛选长效的特异性靶抗体[9,10]是研究的关键要素。细菌噬菌体(简称为噬菌体)[11]可有效克服上述检测方法的不足。噬菌体是世界上数量最庞大的非细胞生命,是分布极广的特异性感染细菌的病毒。噬菌体作为寄生于细菌的病毒,对宿主细胞具有特异性[12,13]。噬菌体侵染寄主细胞的吸附识别是噬菌体编码的受体结合蛋白与细菌表面受体发生特异性结合的过程,受体的性质随噬菌体而异,对其他种、型不发挥作用[14-17]。
本研究构建了基于噬菌体的磁分离探针,并结合实时荧光定量聚合酶链式反应(Real-time Fluorescent Quantitative Polymerase Chain Reaction,qPCR)快速准确检测沙门氏菌的方法,可有效区分死细菌和活细菌,通过引入噬菌体磁性颗粒(Phage T102 Magnetic Beads,pMB)复合物,利用超顺磁颗粒的特性,借助外加磁场提高了在食品检测中,高蛋白、高盐、高糖的复杂样品基质中沙门氏菌的分离富集效率;验证了以鼠伤寒沙门氏菌ATCC 14028特异性噬菌体T102为新型分子识别物[18,19],利用噬菌体磁分离偶联物对样品中的沙门氏菌进行分离富集,结合qPCR方法进行快速检测,灵敏度高于部分文献报道[20];同时选取300批市售的酱卤肉样品进行验证,其结果与GB 4789.4-2016进行了比对。该研究结果可为完善沙门氏菌的快检方法提供参考依据,并且扩展了噬菌体在食品安全中的应用。
1 材料与方法
1.1 实验材料原料
1.1.1 菌株和样品
鼠伤寒沙门氏菌(Salmonella typhimurium)ATCC14028,广东环凯微生物科技有限公司;沙门氏菌噬菌体T102,食品安全监管抽检样品。
1.1.2 仪器和试剂
TS-100B恒温摇床、双人超净工作台、BKQ-B50II立式灭菌器,山东博科消毒设备有限公司;SPX-150型生化培养箱,惠科电子有限公司;BD PhoenixTM全自动细菌鉴定系统;DTD-3R超声波清洗机,湖北鼎泰恒胜科技设备有限公司;HH数显三用恒温水箱,江苏金坛市金城国胜实验仪器厂;PuriMagTM磁分离器,普睿迈格生物科技有限公司;MiniQ-10PC迷你离心机、MiniQ-4C离心机,上海巴玖实业有限公司;MiniOpticon双色荧光定量PCR仪,伯乐生物科技有限公司;CF16RN高速冷冻离心机,日本HITACHI公司。
LB肉汤、LB琼脂,广东环凯微生物科技有限公司;PuriMagTMG-COOH羧基磁珠,普睿迈格生物科技有限公司;EDC(1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐)、NHS(N-羟基硫化琥珀酰亚胺钠盐),上海麦克林生化科技有限公司;MES(2-吗啉乙磺酸)缓冲液、PBS缓冲液、BSA,北京索莱宝科技有限公司;沙门氏菌荧光定量PCR试剂盒,南京诺唯赞生物科技股份有限公司。
1.2 实验方法
1.2.1 食品中沙门氏菌的富集与分离
1.2.1.1 宿主菌株复苏与培养
将冻存的鼠伤寒沙门氏菌(ATCC14028)在LB液体培养基平板上划线37 ℃培养活化12 h,然后在LB固体平板上进行划线培养1~2 d。挑取单个典型菌落接种于LB液体培养基,37 ℃(180 r/min)培养6 h,用稀释平板计数法确定细菌数,菌液4 ℃保存,备用。
1.2.1.2 噬菌体活化
将T102噬菌体(0.1 mL)和活化后的沙门氏菌液(0.1 mL)在LB液体培养基中,37 ℃震荡(160 r/min)活化12 h,离心(9 000 r/min)15 min,0.22 µm滤膜过滤,收集滤液,梯度稀释噬菌体菌液4 ℃保存备用。
1.2.1.3 pMB(噬菌体纳米磁珠)的制备
取100 µL超声重悬后的羧基磁珠液(10 mg/mL,200 nm)于2 mL EP管中,用MES(50 mmoL/L)洗涤两次并重悬,磁力架回收磁珠,加入80 µL EDC(50 mg/mL)、80 µL NHS(50 mg/mL)、240 L MES(50 mmoL/L),在37 ℃(180 r/min)活化30 min,磁分离3 min,用等体积的PBS(10 mg/mL)冲洗磁珠2次后重悬,加入1 mL噬菌体,4 ℃孵化12 h。吸推移液枪头偶联噬菌体纳米磁珠,加入500 µL BSA(5.0%),37 ℃(180 r/min)封闭30 min,舍封闭液,准确加入1 mL PBS缓冲液,重悬得到1 mg/mL的偶联磁珠液,保存于4 ℃,备用。
1.2.1.4 pMB富集分离沙门氏菌
称取25 g样品于225 mL BPW中均质,取100 µL样液,加入25 µL噬菌体-磁珠偶联液,37 ℃(180 r/min)反应20 min富集待测样品中的沙门氏菌,通过磁力架回收纳米磁珠。取偶联混合稀释液及宿主沙门氏菌稀释液(102CFU/mL级)进行涂布,计算捕获率C。
式中:
C——噬菌体捕获率,%;
S——沙门氏菌菌数,个;
P——偶联混合液菌数,个。
1.2.2 qPCR测定沙门氏菌
采用热裂解法(沸水浴10 min)提取噬菌体纳米磁珠富集的沙门氏菌DNA。根据GenBank中公布的沙门氏菌的invA基因序列,选定上游引物:5-gtgaaattatcgccacgttcgggcaa-3,下游引物:5-tcatcgcaccg tcaaaggaacc-3[21-23]。qPCR反应参数见表1、表2。
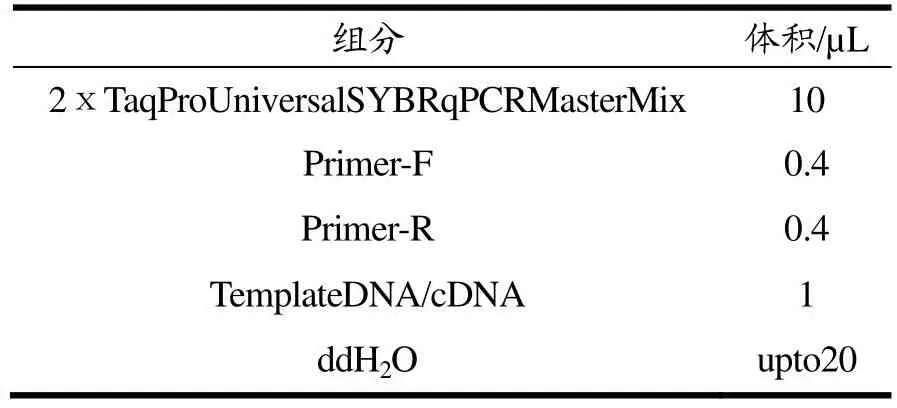
表1 qPCR扩增体系Table 1 qPCR amplification system
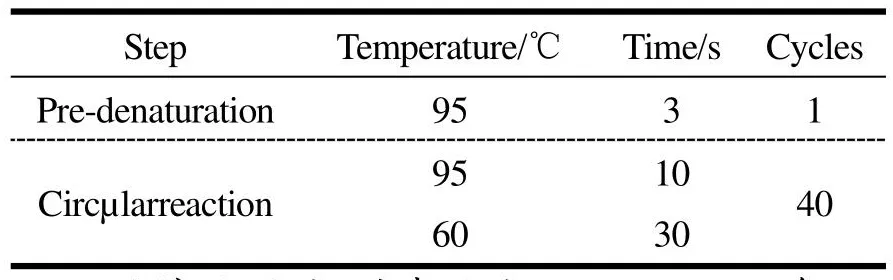
表2 qPCR反应参数Table 2 qPCR parameters
1.2.3 噬菌体纳米磁珠结合qPCR用于食品沙门氏菌的定量分析
称取25 g均质后阴性样品,200 ℃灭菌30 min,加入1 mL 109沙门氏菌液参照1.2.2进行实验。每个浓度平行测定2次。计算本方法的检出限、精密度及线性范围。
1.2.4 300 批次对比实验
选取食品安全抽检样品300批,与GB 4789.4-2016《食品安全国家标准食品微生物学检验沙门氏菌检验》进行结果验证。
1.3 数据分析方法
采用WPS和SPSS 19.0统计软件进行数据处理与分析,利用Origin软件进行作图。P<0.05为显著差异。
2 结果与分析
2.1 沙门氏菌富集与分离效率评价
2.1.1 噬菌体效价测定
实验室自制(4 ℃保存6个月)的T102噬菌体测定效价为2.7×109PFU/mL,可满足实验需要。如图1所示。

图1 (a)10-7沙门氏菌和(b)10-5噬菌体Fig.1 (a) 10-7Salmonella and (b) 10-5 Bacteriophage
2.1.2 沙门氏菌捕获率
在100 µL梯度稀释的沙门氏菌液中,加入25 µL偶联磁珠液(10-5)进行富集条件试验,用平板涂布实验计算捕获率以确定浓度范围。如图2所示,结果表明:当沙门氏菌的浓度小于106CFU/mL(10-3),捕获率大于80.0%,可满足检测需求。当沙门氏菌浓度为102CFU/mL(10-7)时,捕获率达到100%。

图2 不同浓度沙门氏菌磁分离实验的捕获率Fig.2 Capturerate of Salmonella in magnetic separation experiments with different concent rations
2.2 噬菌体磁分离结合qPCR检测沙门氏菌
以鼠伤寒沙门氏菌ATCC14028为宿主菌,噬菌体T102为特异性分子识别物,探究了Rahn K针对沙门氏菌invA基因设计引物的可靠性,选取腐败希瓦氏菌、大肠杆菌、柠檬酸杆菌等常见细菌作为沙门氏菌的干扰物进行特异性试验,结果表明本方法有良好的特异性。其中沙门氏菌Ct值为16.98(n=2,16.83、17.13),其他细菌Ct值在25~30之间,有显著差异,如图3A所示;沙门氏菌熔解曲线峰值86.68,其他细菌熔解曲线峰值均大于88,差值大于1如图3B所示。实验中设置阳性对照、阴性对照和空白对照。其中阳性对照以沙门氏菌为DNA模板,阴性对照以ddH2O为DNA模板,空白对照不加模板DNA,用于检验是否存在PCR污染或形成引物二聚体等。

图3 (A)不同细菌的循环曲线图和(B)不同细菌的熔解曲线峰值图Fig.3 (A) Circulation curvediagram of different bacteria and (B)Peak melting curvediagram of different bacteria
对本实验的灵敏度进行评估,以沙门氏菌最小可检出浓度定义检出检出限,沙门氏菌浓度为102CFU/mL时,Ct值为37.59,本方法检测限为100 CFU/mL即0.1 CFU/PCR反应。如图4b所示。同其他方法比较见表3,本实验特异性为91.2%,结果见表4。

图4 (a)不同浓度沙门氏菌熔解分离实验与Ct值的线性关系图;(b)不同浓度沙门氏菌磁分离实验的循环曲线图;(c)不同浓度曲线峰值图Fig.4 (a) The linear relationship between magnetic separation test and Ct values of Salmonella at different concentrations (b)Cyclic curves of magnetic separation experiments for Salmonella at different concentrations; (c) Peak diagram of melting curve for magnetic separation experiments of Salmonella with different concentrations

表3 4种方法检测时间与检出限的对比Table 3 Comparison of detection time and detection limit of four methods

表4 快检方法的特异性率Table 4 The specificity rate of the rapid detection method
提取梯度稀释的沙门氏菌DNA,取1 µL进行荧光定量PCR检测,实验结果表明,沙门氏菌在102~109CFU/mL浓度范围内呈现良好的线性,如图4c所示线性方程为y=44.14-3.29X,(X=lg[沙门氏菌(CFU/mL)],R2=0.999)。对106CFU/mL级别浓度进行测定(n=4),相对标准偏差为2.1%,结果见表5。

表5 沙门氏菌的精密度测定Table 5 Precision determination of Salmonella
注:方法1为GB 4789.4-2016;方法2为TaqMan实时荧光PCR对沙门氏菌能力验证样品的快速检测与鉴定;方法3为多重实时荧光定量PCR同时检测冷冻蔬菜中4种食源性致病菌[24]。
2.3 结果验证
随机选取食品安全监督抽检样品(含酱卤肉制品、鸡蛋、饮料等)300批(见表6)样品进行检测,按照GB 4789.4-2016《食品安全国家标准食品微生物学检验沙门氏菌检验》对沙门氏菌进行预增菌、增菌,得到7株疑似沙门氏菌菌株,经全自动细菌鉴定仪进行生化鉴别,发现均不是沙门氏菌,鉴定结果见表7。检测结果超过96 h。

表6 300批样品明细Table 6 Details of 300 batches of samples

表7 7株细菌的来源及鉴定结果Table 7 Sources and identification results of 7 strains of bacteria
随后对抽检样品按本快检方法进行加标实验(如图5),本方法从环境样本中分离纯化得到沙门氏菌噬菌体,使之与纳米磁珠偶联,基于沙门氏菌复杂的抗原结构[菌体(O)、鞭毛(H)和表面(Vi)],通过外磁场作用,沙门氏菌抗原与包被在超顺磁纳米磁珠表面的沙门氏菌噬菌体抗体进行特异性结合。在外磁场的作用下,使食品中沙门氏菌活体跟随噬菌体免疫磁珠滞留在磁场中,不含沙门氏菌的非磁性样品溶液被舍弃,从而实现食品中沙门氏菌的富集与分离。准确检测到添加至样品中的标准沙门氏菌菌液,同时探究了针对沙门氏菌invA基因设计引物的可靠性。

图5 (A)模拟实验循环曲线图和(B)模拟实样品+标+偶联磁珠熔解曲线峰值图Fig.5 (A) Cyclecurve of simulated experiment and (B) Peak diagram of melting curve of simulated experiment
需要指出的此次批量检测的样品对象不含生鲜畜禽肉,主要为餐饮环节中现场制售的酱卤肉制品以及少量鸡蛋和饮料,没有检测到沙门氏菌。研究团队查阅了国家市场监督管理局官网公布的2019~2021年公布的食品安全抽检数据,在公布的84 345批次抽检中仅有1批次检出沙门氏菌,证实了本实验300批次样品沙门氏菌零检出结果的可靠性。沙门氏菌零检出率可能与抗生素过度使用及近年来严格的食品安全监管有关。值得注意的是在300批样品中,在猪脚、饮料等样品中筛出7例菌株,建议监管及卫健部门予以关注。
3 结论
自然界广泛存在的噬菌体为病原菌微生物的特异性检测提供了天然的宝库,噬菌体在活菌体内专一快速繁殖,能有效区分活菌与死菌。从环境样本中分离纯化得到的沙门氏菌噬菌体抗体,与待测样品中的沙门氏菌活体菌抗原进行专属性结合,以满足检测需求。但由于食品组分相对复杂,高盐、高糖和高蛋白基质不利于目标病原菌沙门氏菌的富集,因此在检测中为提高灵敏度一般需要进行增菌,增加了检测时间。
纳米磁珠与噬菌体的结合较好到解决了这一难题,当磁性纳米颗粒小于其极限尺寸(如Fe3O4<30 nm)后成为单畴颗粒,单畴颗粒集合体内总磁化强度为零,在有外加磁场存在时,表现出较强且有序的磁性,这一特性使得磁性纳米颗粒能够在外磁场的作用下方便定向分离并聚集,当外磁场消失后磁性纳米颗粒又能在均匀地分散到待测样品中,在纳米磁珠表面键合沙门氏菌噬菌体抗体,在外加磁场的作用下能定向实现抗体抗原的特异性结合实现待测样品中沙门氏菌的分离与富集,从而减少预增菌及增菌环节。
该项目提供的噬菌体磁分离结合qPCR快速检测沙门氏菌方法可以作为传统国标检测方法的一个有力的补充,在实际食品微生物检验工作中,用qPCR结合噬菌体磁分离方法对样品进行初筛,得到阳性样品后再用传统方法进行验证,可以大大减轻工作量,提高工作效率,缩短检测时间。

