孜然主要成分枯茗醛对吲哚美辛致胃溃疡大鼠的保护作用
邓红雨,周慧英,康瑞萍,艾菲热·阿布都艾尼,黄罗冬*,索菲娅*
(1.广西大学生命科学与技术学院,广西南宁 530004)(2.新疆大学生命科学与技术学院,新疆乌鲁木齐 830046)
胃溃疡(Gastric Ulcer)是常见的消化类疾病,会引起一系列并发症如幽门梗阻、溃疡穿孔、胃黏膜防御屏障损坏等,临床表现主要为餐后上腹部位疼痛,胃酸、胃蛋白酶分泌过多,发作反复,治疗周期长,难以根治[1,2]。胃溃疡的病因主要包括压力、过度吸烟、酒精摄入、胃酸和胃蛋白酶的分泌过多、幽门螺杆菌感染和非甾体抗炎药(Non-steroidal Anti-inflammatory Drugs,NSAIDs)的使用[3,4]。吲哚美辛(Indomethacin)等NSAIDs在疾病治疗过程中,常用作为镇痛和抗炎药物。但NSAIDs的持续使用,会引起如消化性溃疡、出血和穿孔等消化道并发症[5]。其主要是通过诱导促炎介质,促进中性粒细胞粘附,损害粘膜完整性,从而导致胃溃疡的发生[5-7]。目前临床上关于胃溃疡的治疗药物主要分为抑制胃酸类药物、胃黏膜保护类药物、抗幽门螺杆菌类药物,但这些药物的治疗作用有限且伴随恶心、腹痛、腹泻、头痛、睡眠不足等症状。因此,需要高效低毒的新药候选物来预防和治疗胃溃疡,防止疾病复发。
孜然(Cuminum cyminumL.)属于伞形科(Apiaceae)孜然芹属(Cuminum)植物,其气味甘甜、辛温无毒,常用作食物香料,但作为中草药也被广泛使用。中医学认为,孜然具有暖胃健脾、消食化积、祛风止痛、醒脑通脉等功效,可治疗胃寒疼痛、消化不良、腹痛腹泻、癫痫和黄疸等病症[8]。实验室前期研究发现,孜然具有显著的消炎和治疗胃溃疡的作用,孜然果实精油[9]、醇提物[10]、总黄酮[11]等成分均表现出良好的急性胃溃疡保护作用。已有研究发现孜然的主要香气来源和活性物质枯茗醛(Cuminaldehyde,CUM)具有抗炎、抗氧化、抗肿瘤、抗病毒和抑菌等作用[12-15],但目前关于孜然有效成分枯茗醛对胃溃疡的作用研究欠缺。因此本研究以吲哚美辛诱导的大鼠急性胃溃疡为模型,探究枯茗醛对胃溃疡的保护作用与作用机制。
1 材料与方法
1.1 动物
本实验所用的36只SD大鼠购买于昆明医科大学SPF级实验动物中心,小鼠许可证号:SCXK(滇)K2020-004体质量180~220 g,饲养温度(22±2)℃,相对湿度65%±10%,自然光照条件,饲料及水源充足。所有动物实验操作按新疆大学实验动物伦理委员会批准下进行,动物伦理编号XDSKY2020030401。
1.2 药物与仪器
前期从孜然果实中提取纯化获得枯茗醛,纯度达到87%。用蒸馏水配置0.5%羧甲基纤维素钠(Sodium Carboxymethyl Cellulose,CMC-Na)溶液(质量分数)。分别称取80、160和320 mg枯茗醛于40 mL 0.5%CMC-Na的溶液,制成质量浓度为2、4和6 mg/mL的枯茗醛溶液。用0.5% CMC-Na配置10 mg/mL吲哚美辛溶液。用蒸馏水配置3 mg/mL奥美拉唑溶液。
TRACE DSQ气相色谱-质谱联用仪,美国Finnigan质谱公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;Multifuge X1R高速冷冻离心机、Multiskan Sky全波长酶标仪,美国Thermo公司;JT-12F生物组织脱水机、TKY-BMB石蜡包埋机,上海寰熙医疗器械有限公司;RM2126冷冻切片机,徕卡显微系统上海贸易有限公司。
1.3 动物分组及模型制备
实验条件下,大鼠自由饮食7 d以适应环境。随机把大鼠分为6组,每组6只,分别为空白组(CK,0.5% CMC-Na),吲哚美辛模型组(Model,0.5%CMC-Na),奥美拉唑阳性对照组(Positive,30 mg/kg),枯茗醛低剂量组(CUM2)、中剂量组(CUM4)和高剂量组(CUM6)(浓度分别为20 mg/kg、40 mg/kg和60 mg/kg)。连续给药7 d,每日1次。末次给药前24 h,对大鼠采取禁食、不禁水和避免食粪性的措施。末次给药1 h后,CK大鼠以1 mL/100 g剂量灌胃生理盐水,其余组大鼠以相同剂量灌胃质量浓度为10 mg/mL的吲哚美辛溶液,制备胃溃疡模型。造模5 h后,用乙醚麻醉大鼠并解剖。用真空采血管从腹主动脉采集血液,静置1 h后4 500 r/min离心10 min,取上清存于-80 ℃。
1.4 大鼠胃组织观察及指数测定
获取大鼠胃组织,参考索菲娅等[4]的方法评定胃溃疡指数及溃疡抑制率。观察大鼠胃溃疡情况,测量溃疡长度并计分,以分数平均值为溃疡指数。按以下公式计算胃溃疡抑制率:
式中:
UI——胃溃疡抑制率,%;
Um——模型组大鼠胃溃疡指数;
Ut——给药组大鼠胃溃疡指数。
剪取病变的胃组织区域,用4%甲醛(质量分数)固定,经脱水、包埋、切割等常规步骤获得4 μm切片。用苏木精-伊红染色(Hematoxylin-Eosin Staining,HE染色),于光学显微镜下观察病理学变化。
1.5 大鼠胃组织及血清指标测定
用生理盐水将大鼠胃组织制成质量分数为10%的匀浆液,2 500 r/min离心10 min取上清。
胃组织抗氧化性能:据试剂盒检测氧化应激因子过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide Dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH)、丙二醛(Malondialdehyde,MDA)的活性或含量(南京建成生物工程研究所)。
血清炎症因子:据试剂盒检测大鼠肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、白细胞介素-1β(Interleukin-1β,IL-1β)、白细胞介素-10(Interleukin-10,IL-10)的表达量(Elabscience公司),及髓过氧化物酶(Myeloperoxidase,MPO)活性(南京建成生物工程研究所)。
胃黏膜保护因子:据试剂盒检测血清前列腺素E2(Prostaglandin E2,PGE2)的表达量(Elabscience公司)和胃组织一氧化氮(Nitric Oxide,NO)的活性(南京建成生物工程研究所)。
1.6 数据处理
2 结果与讨论
2.1 大鼠胃组织形态学与黏膜病理形态学观察
胃黏膜状况可较直观的反映大鼠胃组织健康状态。吲哚美辛等非甾体类抗炎药(NSAIDs)会引起氧化应激和炎症,导致胃肠道黏膜损伤,其诱导的动物模型可用于评价药物对肠胃的保护作用[16,17]。对于枯茗醛抗胃溃疡的研究较少,在浓度剂量选择上参考了枯茗醛对高脂饮食诱导的肥胖大鼠的6 mg/kg剂量[18],改善高脂饮食诱导的非酒精性脂肪肝的14 mg/kg剂量[19]。在预实验中以10 mg/kg剂量进行了抗胃溃疡的研究,但对胃溃疡治疗效果不明显,因此设置了20、40和60 mg/kg剂量。各组大鼠胃组织形态学观察如图1所示。空白组CK大鼠黏膜依旧完整无损,粘液屏障完好,无溃疡点、糜烂等现象(图1a);Model大鼠胃黏膜表层损伤,存在多处暗红色出血条带及点状溃疡(图1b);Positive大鼠胃黏膜无明显损伤,整体黏膜呈淡粉色,与CK组相近(图1c);枯茗醛给药组大鼠胃黏膜损伤程度呈剂量依赖,逐步无长条状溃疡条带出现(图1d~f),高剂量的CUM6效果较明显,大鼠粘膜整体无水肿、糜烂等状况,仅少且短的溃疡出血点(图1f)。

图1 各组大鼠胃组织的形态学观察Fig.1 Morphological observation of gastric tissuein each group rats
各组大鼠胃组织HE染色结果如图2。CK大鼠胃黏膜结构完整无损伤,胃小凹及腺体排列紧密整齐无充血现象,上表皮细胞未见脱落(图2a);Model大鼠胃黏膜结构损伤明显,腺体排列紊乱分散,出血点清晰可见,上皮细胞少量脱落,黏膜下表层炎细胞浸润(图2b);3个浓度的枯茗醛给药组大鼠胃黏膜腺体排列趋于整齐,下表层炎症细胞浸润减轻,损伤情况得到改善(图2d~f),其中高剂量枯茗醛组(CUM6)大鼠胃黏膜损伤的病理形态与CK、Positive较为相似,上皮细胞未见脱落,无充血点(图2f)。这个结果与胃组织形态学观察结果趋于一致,均未看到明显损伤。

图2 各组大鼠胃黏膜HE染色病理学观察(100×)Fig.2 Pathological observation of gastric mucosa by HE staining in each group rats (100×)
在有关药用植物对大鼠胃溃疡病理学形态的研究结果中,具有类似的作用效果。如从漆树科的乳香黄连木(Pistacia lentiscus)果实中提取的精油可显著减少大鼠胃溃疡和出血性区域[20];山榄科的铁线子(Manilkara hexandra)树皮的甲醇提取物可以显著减轻动物胃溃疡程度[21];芸香科的假黄皮(Clausena excavata)根的提取物齿叶黄皮素显著减少了乙醇诱导的胃溃疡面积(P<0.05)[22]。本研究中,胃组织形态学与黏膜病理形态学结果均显示,高剂量枯茗醛组(CUM6)抗溃疡效果最佳,与药物奥美拉唑的溃疡抑制效果类似,表明枯茗醛也具有作为抗胃溃疡药物的潜力。
2.2 大鼠胃溃疡指数及胃蛋白酶活性比较
胃溃疡的病理机制复杂,胃酸与胃蛋白酶的相互作用、氧化应激与炎症反应被认为是胃黏膜损伤的主要原因[23,24]。胃酸分泌过多会引起屏障功能减弱,导致胃黏膜组织的自我消化,诱导溃疡发生[24,25],胃蛋白酶活性过高也是诱导胃溃疡的因素之一[26]。各组大鼠溃疡指数、溃疡抑制率和胃液情况如表1。与CK相比,Model组大鼠溃疡指数显著上升达57.00(P<0.01)。相较于Model组、Positive组的溃疡指数显著下降(P<0.01),仅为2.67,其对应的溃疡抑制率高达95.32%;枯茗醛预给药的CUM4、CUM6大鼠溃疡指数显著下降(P<0.01),且存在呈剂量依赖的可能。CUM2、CUM4、CUM6的溃疡抑制率也随剂量增加而逐步提高,分别为15.35%、46.78%、58.48%。表明枯茗醛对大鼠胃黏膜的保护作与给药剂量相关,可有效降低吲哚美辛对大鼠胃黏膜的伤害。卢帅等[10]的研究发现,孜然乙醇提取物也可以有效降低溃疡指数,提高溃疡抑制率(P<0.05),同时还可降低胃蛋白酶活性(P<0.01)。
表1 各组大鼠溃疡指数、抑制率和胃蛋白酶活性比较Table 1 Comparison of ulcer index, inhibition rate and pepsin activity in each group rats (n=6,±s)
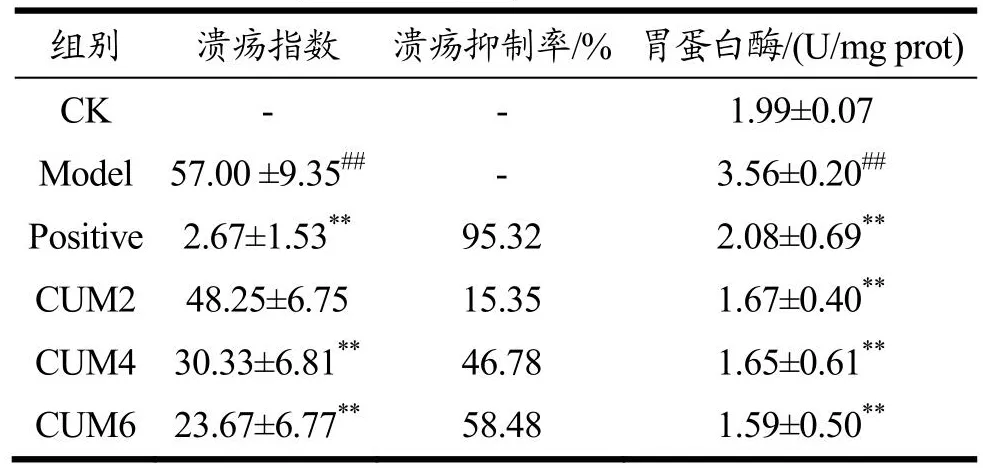
表1 各组大鼠溃疡指数、抑制率和胃蛋白酶活性比较Table 1 Comparison of ulcer index, inhibition rate and pepsin activity in each group rats (n=6,±s)
注:CK为空白组;Model为模型组;Positive为阳性对照组;CUM2为20 mg/kg枯茗醛组;CUM4为40 mg/kg枯茗醛组;CUM6为60 mg/kg枯茗醛组。#P<0.05、##P<0.01为与空白组(CK)相比;*P<0.05、**P<0.01为与模型组(Model)相比。
组别溃疡指数 溃疡抑制率/% 胃蛋白酶/(U/mg prot)CK - - 1.99±0.07 Model57.00 ±9.35##- 3.56±0.20##Positive2.67±1.53**95.32 2.08±0.69**CUM248.25±6.7515.35 1.67±0.40**CUM430.33±6.81**46.78 1.65±0.61**CUM623.67±6.77**58.48 1.59±0.50**
另外,胃蛋白酶活性测定结果显示,与CK组相比,Model组大鼠胃蛋白酶活性显著上升达3.56 U/mg prot(P<0.01)。Positive组大鼠的胃蛋白酶活性为2.08 U/mg prot,枯茗醛处理组的活性处于1.59~1.67 U/mg prot水平。表明相对于Model组,奥美拉唑、枯茗醛均能有效抑制大鼠胃蛋白酶活性(P<0.01),通过降低胃蛋白酶活性起到一定的胃黏膜保护作用。
2.3 枯茗醛对大鼠胃组织抗氧化性能的影响
NSAIDs会直接损伤消化道黏膜屏障,破坏其线粒体的结构,使中性粒细胞大量衍生氧自由基而被积累浸润[27]。机体的抗氧化系统可以清除自由基,该系统主要包括SOD、CAT、GSH等物质。SOD能够使O2-歧化生成氧和H2O2;CAT酶可将H2O2分解,起到保护细胞免受活性氧毒性的作用;GSH可保护胃黏膜免受自由基诱导的组织损伤,是衡量机体抗氧化能力的重要因子;MDA是脂质过氧化的终产物[3,22,28]。这些物质的水平可间接反映机体抗氧化能力。枯茗醛对吲哚美辛模型大鼠胃组织抗氧化性能的影响如图3。与CK组相比,Model组大鼠胃组织中的SOD、CAT、GSH水平分别降低了31.97%、46.54%、25.58%,MDA含量增加了131.58%(0.44 nmol/mg prot),存在显著差异(P<0.05或P<0.01)。与Model组相比,Positive组大鼠的SOD、CAT、GSH水平升高但无明显差异;但枯茗醛灌胃的各组大鼠CAT活性均显著增加(P<0.01),在CUM6达到最大值3.68 U/mg prot;CUM4、CUM6大鼠的SOD活性显著增加(P<0.05);此外,CUM6大鼠胃组织的GSH活性提高了28.81%(16.90 μmol/g prot),MDA含量显著降低31.82%(0.30 nmol/mg prot),均存在显著差异。

图3 各组大鼠胃组织抗氧化性能比较Fig.3 Comparison of antioxidant properties of gastric tissue in each group rats (n=6,±s)
研究表明,枯茗醛可以显著提高高脂饮食小鼠肝脏的GSH、SOD和CAT活性水平,并显著降低MDA含量(P<0.01)[19];优化的枯茗醛制剂对四氯化碳处理大鼠血浆抗氧化指标具有相似作用效果(P<0.05)[29]。除孜然成分枯茗醛外,龚频等[30]的研究发现,黄芪的重要功效成分黄芪甲苷可以降低由镉联合高脂高糖致糖尿病小鼠胰腺组织的MDA含量,增加SOD、GSH活性(P<0.05或P<0.01)。本研究中,与Model组相比,枯茗醛和阳性对照奥美拉唑治疗后的胃溃疡大鼠SOD、CAT活性和GSH含量均有所提高,枯茗醛效果较显著。表明枯茗醛和奥美拉唑可提高抗氧化系统清除自由基的性能,存在一定的修复和恢复抗氧化活性的作用。吲哚美辛灌胃造成大鼠胃组织严重损伤,过氧化程度高,使得MDA含量显著增加。但与Model组相比,枯茗醛(CUM2、CIM6)显著降低了胃组织中MDA含量(P<0.05)。表明枯茗醛可影响胃部组织的抗氧化活性,起到修复和改善细胞免受活性氧毒性的作用,保护胃黏膜免受自由基诱导的组织损伤。对于Positive组,也表现出了MDA含量低于模型组,但作用效果不明显,表明枯茗醛对吲哚美辛致胃溃疡的治疗作用比奥美拉唑良好。
2.4 枯茗醛对大鼠血清炎症因子的影响
除影响胃溃疡大鼠胃组织抗氧化酶活性外,枯茗醛还影响大鼠血清炎症因子。胃粘膜损伤常伴随炎症的出现。大鼠血清中炎症因子TNF-α、IL-1β和IL-10含量及MPO活性的测定结果如图4。Model组中的TNF-α含量、IL-1β含量和MPO活性分别为89.66 pg/mL、227.43 pg/mL和3.71 U/L,与CK组相比差异显著(P<0.05或P<0.01),其中TNF-α含量增加了125.56%;此外IL-10的含量较CK组降低了60.78%(18.71 pg/mL,P<0.01)。与Model组相比,CUM4、CUM6和奥美拉唑均能显著降低大鼠血清中TNF-α和IL-1β含量(P<0.05或P<0.01);CUM6和奥美拉唑组还显著增加了IL-10含量(P<0.05或P<0.01),其中CUM6组IL-10含量最高,达到47.60 pg/mL(增加了154.41%);同时,CUM6和奥美拉唑组还显著降低了MPO活性(P<0.05),CUM6的MPO活性降低至2.50 U/L(降低了32.61%)。TNF-α、IL-1β等是判断炎症程度的促炎因子,TNF-α促炎因子是NSAIDs诱导胃溃疡的关键指标,其含量可作为胃肠道系统有害的标志[5];IL-10是一种多功能负调节因子,可以抑制和拮抗促炎因子的产生和作用;MPO活性可以用来评估中性粒细胞对胃粘膜组织的浸润[31]。研究表明,枯茗醛可以显著降低四氯化碳处理的大鼠血清和肝组织中的促炎介质TNF-α和IL-6水平(P<0.01)[29];25~100 mg/kg剂量的枯茗醛可以显著减轻神经性疼痛模型大鼠的异常痛和痛觉过敏(Allodynia and Hyperalgesia),降低血清TNF-α和IL-1β水平[32]。本研究中,枯茗醛对吲哚美辛胃溃疡模型大鼠也具有较好的抗炎活性,可以减缓吲哚美辛所引起的炎症反应。因此,枯茗醛对机体的保护作用与其良好的抗炎活性相关。

图4 各组大鼠血清炎症因子水平比较Fig.4 Comparison of serum inflammatory factors in each group rats (n=6,±s)
2.5 枯茗醛对大鼠血清PGE2和胃组织NO含量的影响
NO和PGE2是机体胃黏膜的防御因子。PGE2对胃溃疡的保护作用与刺激胃黏液和碳酸氢盐分泌、在维持胃粘膜防御的完整性方面发挥重要作用[3]。NO与维持胃黏膜血流量和抑制炎症有关,具有抑制中性粒细胞的黏附、清除氧自由基等作用[33]。大鼠血清PGE2和胃组织NO含量测定结果如图5。与CK相比,Model组大鼠血清PGE2(P<0.01)和胃组织NO(P<0.05)水平显著降低。与Model组相比,枯茗醛可以显著提高大鼠血清中PGE2含量(P<0.01)。此外,CUM4、CUM6大鼠胃组织NO含量与Positive组类似,都接近于CK组,但只有CUM6的NO水平较Model组存在差异性(P<0.05),其余枯茗醛剂量虽可增加NO含量,但无差异。表明枯茗醛对吲哚美辛致胃溃疡的胃黏膜保护作用与PGE2和NO有关,在一定程度上增强了胃黏膜的防御作用。
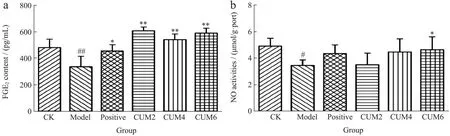
图5 各组大鼠血清PGE2、胃组织NO活性比较Fig.5 Comparison of serum PGE2 and gastric NO activity in each group rats (n=6, ±s)
3 结论
本研究以孜然活性物质枯茗醛灌胃大鼠,再用非甾体类抗炎药(NSAIDs)吲哚美辛构建大鼠胃溃疡模型,探讨了枯茗醛对大鼠胃溃疡的保护作用及机制。结果发现,枯茗醛可以通过降低大鼠胃蛋白酶活性、增加抗氧化能力和抗炎活性,从而抵御吲哚美辛对大鼠胃组织的伤害,其中60 mg/kg剂量的枯茗醛效果最佳。表明孜然活性物质枯茗醛具有作为胃溃疡治疗的潜力,可为胃溃疡药物的开发研究及枯茗醛的实际应用奠定基础。

