紫菜联合美多芭的抗帕金森作用及其对肠道菌群的影响
蒋佳丽,周赛楠,董晓莉,张伟,王玉明,唐庆娟*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003)(2.香港理工大学香港理工大学应用生物与化学科技学系,香港 999077)(3.青岛市立医院,山东青岛 266011)
帕金森病(Parkinson’S Disease,PD)是世界范围内,仅次于阿尔茨海默症的第二大神经退行性疾病。研究表明,帕金森病多发于老年人,已成为年龄相关的主要健康问题,发病率与年龄呈正相关[1]。PD病理学的特征是α-突触核蛋白(Alpha-synuclein,α-syn)聚集形成路易体,沉积在中脑,黑质致密部中的多巴胺能神经元选择性丧失[2,3]。德国神经解剖学家Braak在死后帕金森病患者的肠神经系统中发现了错误折叠而成的α-突触核蛋白寡聚体,并发现帕金森病患者是先发生便秘等胃肠道疾病,而后才出现帕金森病的运动障碍[4]。因此,他提出假设-帕金森病可能起源于肠道。此后,大量临床研究表明:肠道菌群组成的改变可能与PD的发病机制和临床表型有关[5]。
1960年代引入的PD治疗药物左旋多巴(L-DOPA)为帕金森病的治疗带来了突破[6]。随着科学的发展,罗氏公司研发了一种复方左旋多巴制剂-美多芭(多巴丝肼片);与单纯左旋多巴相比,美多芭疗效显著提高,且副作用明显减少[7,8]。但是在临床研究中发现,该药起效缓慢[9];随着用药时间延长,患者会出现剂量依赖、不自主异常动作[10]。因此,寻找联合用药材料,改善其毒副反应、提升治疗效果,对该病的治疗具有重要意义。
紫菜是我国的一种经济类红藻,富含蛋白质、维生素、多糖等多种营养物质,其中紫菜多糖的含量占紫菜干重的20%~40%,是紫菜中含量最高的营养成分[11]。药理学研究表明,紫菜多糖具有抗肿瘤活性、抗心脑血管疾病、免疫调节活性等多种生理活性[12-14]。Wang等[15]提出,紫菜多糖可对6-羟基多巴胺(6-OHDA)诱导的细胞毒性产生神经保护作用;赵婷婷[16]的研究发现,经低浓度紫菜多糖处理的SH-SY5Y细胞模型,其神经保护作用明显优于模型组;同时,经低浓度紫菜多糖干预的阿尔茨海默症模型小鼠,其学习记忆能力大有提升。除紫菜多糖的相关研究外,李小平等[17]还发现,从坛紫菜中提取出的叶黄素对神经胶质瘤细胞的增殖具有抑制作用。
Han等[18]研究表明,由于食品成分之间的潜在相互作用,天然食品产生的生物学效应可能优于天然食品中各个成分的作用之和。因此,相较于前文所提到的紫菜多糖、紫菜提取出的叶黄素,紫菜或许能够起到更加优越的神经保护作用。基于上述研究,本实验旨在探究紫菜联合美多芭的抗帕金森作用及其对肠道菌群的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物
C57BL/6J小鼠,SPF级,雄性,6周龄,购于北京维通利华实验动物技术有限公司。饲料购于江苏南通特洛菲饲料科技有限公司。
1.1.2 原料与试剂
坛紫菜购于福建远扬藻业股份有限公司。MPTP购于上海麦克林生化科技有限公司;美多芭(多巴丝肼片)购于上海罗氏制药有限公司;人白介素-1β(IL-1β)试剂盒购于苏州卡尔文生物科技有限公司;α-syn抗体购自江苏亲科生物研究中心有限公司;酪氨酸羟化酶(TH)抗体、甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自武汉赛维尔生物科技有限公司。
1.1.3 主要仪器
NIKON/Ni-E电动荧光显微镜,日本尼康公司;脱色摇床,Servicebio;SPARK 10M酶标仪,瑞士TECAN;低温型研磨仪,Servicebio;NovaSeq-6000测序平台,美国Illumina公司。
1.2 方法
1.2.1 动物饲养及模型建立
将48只小鼠随机均分为4组,分别为正常对照组(N)、帕金森模型组(M)、美多芭治疗组(L)、紫菜联合美多芭治疗组(P);饲喂2周标准棒状饲料及添加紫菜的饲料,分组及饲料配方如表1所示。与此同时,N组与M组每天灌胃生理盐水,其他两组每天灌胃20 mg/kg(按体质量计)美多芭。通过一天内腹腔注射四次20 mg/kg(按体质量计)MPTP,间隔两小时注射一次,建立急性PD模型[19];N组腹腔注射生理盐水,其余组均腹腔注射MPTP。观察小鼠的精神状态、进食及排泄情况、行为活动等,记录小鼠体温变化、是否出现死亡等情况。最后一次腹腔注射的12 h后,对小鼠进行行为学实验;48 h后通过摘眼球取血,脱颈椎处死小鼠。收集相关的脏器及小鼠肠道内容物并保存于-80 ℃以便后续检测。PD急性模型建立成功的标志:小鼠未出现死亡,表现出类似于PD行动迟缓、运动不协调、便秘等症状。
1.2.2 行为学检测
1.2.2.1 小鼠爬杆实验
参考文献[20]中所用方法,进行爬杆试验。通过让小鼠在一根垂直铁杆上由上往下爬,观察小鼠自身运动的协调性。将一根长约0.5 m,直径为1 cm的铁棒固定在铁架台上,并用洁净的无特殊异味的白色纱布均匀缠绕于铁棒上,固定好铁架台将其放入干净的塑料容器中。在注射MPTP之前对小鼠进行爬杆实验训练。训练内容:将小鼠从笼中取出,将其头朝下竖直放置在距离铁棒底部1/3位置处,让小鼠自由从上往下爬至铁架台底部;然后将小鼠放置在铁棒距离底部2/3位置处,将小鼠竖直放置,让其自由从上往下爬至铁架台底部;再次将小鼠放置在铁棒最高处,让其自由从上往下爬至铁架台底部。重复以上操作三次,训练至小鼠能够自由从铁棒最顶部爬至铁架台底部为止。
在注射MPTP后对小鼠进行爬杆实验,每只小鼠重复至少三次以上,记录小鼠每次从铁棒顶端到铁架台底部的时间,并观测小鼠步伐情况,若小鼠在爬行过程中出现有往反方向爬行的趋势,则应将小鼠移开铁棒放置笼内休息,之后重新进行爬杆实验。统计小鼠爬杆数据并进行分析。
1.2.2.2 小鼠悬挂实验
握力的检测同样也是评价小鼠运动协调能力的一种常见的检测手段[20]。将一根细绳系于两支竖直放置的铁棒之间,固定好细绳。在进行正式实验前对小鼠进行适应性训练,步骤如下:将小鼠自由放置在细绳中部,使其前爪能够稳定抓住细绳后松开,让其自由悬挂在细绳上,以1 min为悬挂实验的上限时间,重复此操作三次以上。
小鼠注射MPTP后,进行悬挂实验,将其自由放置在细绳中央,让小鼠前爪紧握住细绳后松开,记录在细绳上悬挂的时间,至少重复三次以上,统计数据并分析。
1.2.3 炎症因子IL-1β水平检测
采用ELISA试剂盒检测各组小鼠血清中IL-1β的水平,在450 nm波长处测定各孔的OD值。
1.2.4 免疫组化分析
每组随机选择3只小鼠,快速取其全脑并置于4%(m/V)多聚甲醛固定液中;取出固定后的脑组织,经石蜡包埋处理后,进行连续切割,得到厚度约为20 μm的切片;对制得的切片进行脱蜡水化和抗原修复处理,而后滴加TH抗体,4 ℃孵育过夜;第2天用PBS缓冲液进行冲洗,待切片表面的液体晾干后,滴加HRP标记的二抗,于室温孵育50~60 min;PBS缓冲液冲洗后,滴加DAB溶液显色,复染细胞核,脱水封片。利用电动荧光显微镜进行观察,采用IPP6.0图像分析软件统计TH阳性细胞面积。
1.2.5 Western Blot检测黑质中TH、α-syn水平
向4 ℃ PBS缓冲液漂洗后的中脑组织中,加入RIPA蛋白裂解液(含PMSF、磷酸酶抑制剂),利用组织破碎仪(60 Hz,60 s,4次)快速匀浆至充分裂解;将裂解液离心(12 000 r/min,4 ℃,10 min),取上清。采用BCA法测定蛋白浓度。
制备聚丙烯酰胺凝胶体系,依次上样,进行电泳。电泳结束后,取出胶体,进行半干法转膜;将PVDF膜置于5%(V/V)脱脂牛奶中封闭2 h;TBST洗涤后,加入一抗(1:1 000),4 ℃孵育过夜;TBST洗涤后,加入二抗(1:1 000),室温孵育2 h;TBST洗涤。采用ECL化学发光法显影,使用Image J分析蛋白条带灰度值。
1.2.6 肠道菌群16S rRNA测序分析
以小鼠结肠内容物为样本,提取微生物DNA。本项目采用Illumina-NovaSeq-6000平台对群落DNA片段进行双端(Paired-end)测序。
1.3 数据分析
实验数据以(Mean±SEM)表示,数据显著性分析采用GraphPad(8.3.0)软件进行单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 小鼠饲养状态
饲养初期,小鼠因每天进行灌胃,曾出现短期不适应,状态稍显不佳,几天之后状态恢复正常。在摄入受试物的同时,灌胃阳性药物,两周后给予小鼠腹腔注射MPTP,小鼠出现行动迟缓、目光呆滞,毛发缺少光泽,体温下降,M组中这些症状表现尤为明显。
2.2 行为学影响
2.2.1 小鼠爬杆实验
小鼠爬杆实验结果如图1a所示,由图1可知,注射MPTP进行造模后,M组PD小鼠的爬杆时间显著多于N组正常小鼠(P<0.01),运动能力显著减弱。在整个爬杆过程中,除了正常组以外,其余各组中均有部分小鼠出现停滞不前的状况。经美多芭干预的L组、P组PD小鼠,其运动能力强于M组,爬杆速度高于未经治疗的M组小鼠;此外,P组小鼠运动能力更强(P<0.05)。

图1 小鼠行为学实验结果Fig.1 Experimental results of mouse behavior
2.2.2 小鼠悬挂实验
如图1b所示,相较于N组正常小鼠,M组PD小鼠的悬挂时间显著减少(P<0.05),平衡能力减弱。相较于M组PD小鼠,L组、P组小鼠悬挂实验时间均有所增加,表明经美多芭干预后的PD小鼠,其平衡能力有所增强;尤其是P组,其悬挂时间最长,平衡能力显著强于M组(P<0.05)。
2.3 免疫组化分析
TH可催化酪氨酸生成左旋多巴,是合成神经递质多巴胺的关键步骤,因此TH的表达能较为直观地反映帕金森病的发展进程[21]。如图2a所示,N组小鼠黑质部位中的TH阳性细胞排布紧密,数量最多,呈染色较深的粗条带状;M组帕金森小鼠黑质部位中的TH阳性细胞的数量较对照组显著减少(P<0.05),且排布稀疏,染色较浅;给予阳性药物美多芭进行治疗后,有增加TH阳性细胞数量的趋势,但并无显著性;与M组PD小鼠相比,P组显著增加了PD小鼠中脑黑质部位TH阳性细胞的数量(P<0.05),细胞排布较为紧密,细胞染色程度也高。结果表明:紫菜联合美多芭的治疗方法对神经元的保护作用,优于单独使用阳性药物美多芭。

图2 小鼠脑组织免疫组化结果Fig.2 Immunohistochemical results of mouse brain tissue

图3 小鼠黑质部位Western Blot结果Fig.3 Western Blot of the substantianigra of mice
2.4 Western Blot测定黑质中α-syn、TH水平
Western Blot结果表明,M组PD小鼠黑质中α-syn含量显著高于N组正常小鼠(P<0.05),TH含量低于N组正常小鼠,符合帕金森病人的病理性特征。L组、P组的α-syn含量低于M组,TH含量高于M组,且P组的变化更为显著(P<0.05)。综上可知,紫菜联合美多芭治疗的效果优于单独使用阳性药物美多芭。
2.5 IL-1β水平的检测
小鼠血清中IL-1β水平如图4所示。M组的IL-1β含量显著增加,与N组相比有统计学差异(P<0.000 1),表明帕金森病会导致小鼠炎症水平升高;给予阳性药物美多芭进行治疗,或给予紫菜进行联合治疗,均能降低PD小鼠血清中IL-1β含量;此外,紫菜联合美多芭治疗的效果明显优于单独使用阳性药物美多芭(P<0.000 1)。

图4 小鼠血清炎症因子IL-1β含量Fig.4 Serum levels of inflammatory cytokines IL-1β in mice
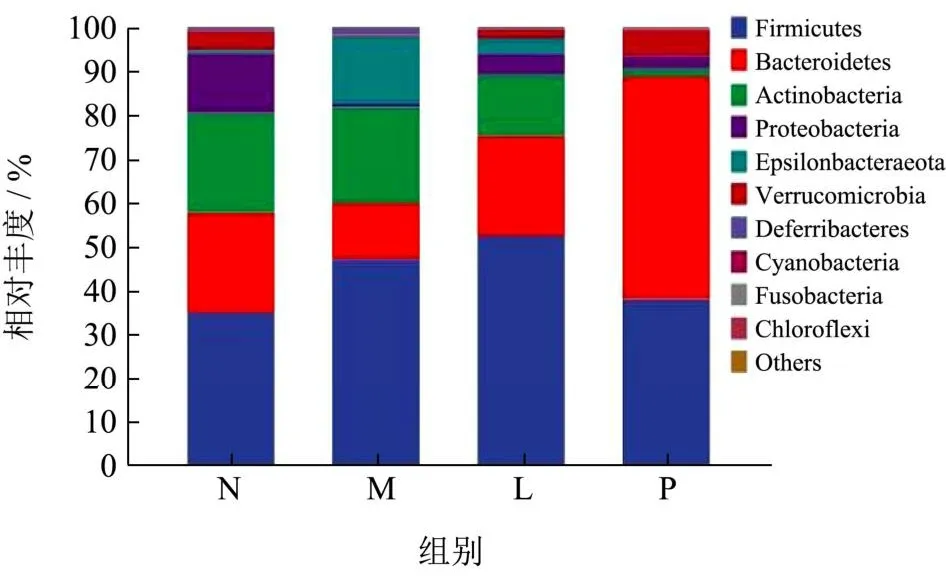
图5 小鼠肠道菌群门水平的物种组成分析Fig.5 Analysis of phylum level species composition of intestinal microbiota in mice

图6 小鼠肠道菌群属水平的物种组成分析Fig.6 Analysis of genus level species composition of intestinal microbiota in mice
2.6 肠道菌群分析
2.6.1 在门水平上的菌群丰度及差异
基于门水平对菌群组成进行分析可知,各组中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和放线菌门(Actinobacteria)为主要优势菌门,其相对丰度之和达80%以上。与M组相比,P组小鼠肠道中的Firmicutes由44.96%减少到38.08%,Bacteroidota由17.01%增加到50.88%,Firmicutes/Bacteroidota的比值由2.64降低至0.75,降低了71.59%;该结果表明,紫菜联合美多芭的治疗对Firmicutes/Bacteroidota有正向调节作用,有助于维持肠道稳态;并可以通过增加Bacteroidota,来改善PD小鼠的炎症水平[22]。Actinobacteria由20.26%减少到1.41%,其趋势符合PD患者的菌群变化,与Li等[23]的研究一致。
2.6.2 在属水平上的菌群丰度及差异
在属水平上,与N组正常小鼠比较,M组PD小鼠中的乳杆菌属Lactobacillus、与抗炎水平相关的Muribaculaceae、杜氏杆菌属Dubosiella的相对丰度分别降低了5.12%、10.06%、6.75%;Coriobacteriaceae_UGG-002、布劳特氏菌Blautia、幽门螺杆菌属Helicobacter等肠道炎症相关菌属的相对丰度有所升高[24,25],表明M组小鼠的菌群结构易引起肠道炎症。
经美多芭干预后,PD小鼠肠道内的Muribaculaceae、杜氏杆菌属Dubosiella、Allobaculum的相对丰度分别升高了6.83%、1.56%、0.89%;Helicobacter的相对丰度降低7.91%。经紫菜联合美多芭治疗后,小鼠肠道内Muribaculaceae、杜氏杆菌属Dubosiella、拟杆菌属Bacteroides、Allobaculum、阿克曼氏菌属Akkermansia的相对丰度分别升高10.71%、10.51%、15.83%、2.10%,Coriobacteriaceae_UGG-002、Blautia、Helicobacter的相对丰度分别降低3.59%、3.29%、10.22%。与单独服用美多芭相比,紫菜联合治疗的菌群调节作用更佳,有益菌属相对丰度增加的多,炎症相关有害菌属相对丰度减少的多。
2.6.3 菌群多样性分析
各组小鼠的Alpha多样性指数如图7a所示。相比于N组正常小鼠,M组PD小鼠的Observed species指数、Shannon指数、Simpson指数均有显著变化(P<0.05),表明PD小鼠肠道菌群的丰富度及多样性均低于正常小鼠;P组小鼠的各项指数均显著高于M组PD小鼠(P<0.01),表明经紫菜联合治疗的小鼠,其肠道菌群结构发生了一定程度的改变,菌群的丰富度及多样性均高于PD小鼠。此外,P组小鼠的菌群丰富度显著高于L组(P<0.05),表明相较于单独服用美多芭,紫菜联合治疗调整PD小鼠肠道菌群结构的效果更佳。


图7 菌群多样性分析Fig.7 Analysis of bacterial diversity

图8 LEfSe菌群差异分析Fig.8 LEfSe microbiota difference analysis
韦恩图可用于统计不同组别共有和独有的OTU数量,由图7b可知:N组独有OTU数量为3 088个,M组为1 631个,其OTU数远低于N组;L组、P组OTU数分别为2 634、10 712,均显著高于M组;值得注意的是,P组OTU数量为四组中最高,即P组菌群多样性最高。
在OTU水平,对小鼠肠道菌群进行PCoA分析,各组菌群多样性均有明显的聚类现象,结果如图7c所示。N组与M组样本能明显分开;L组、P组的样本与M组样本距离较远,表明PD小鼠肠道菌群结构发生了较大程度的变化,与M组有显著差异。此外,与L组相比,P组与M组的距离更远,说明在紫菜联合美多芭的治疗下,PD小鼠肠道菌群结构存在明显差异。
2.6.4 LEfSe菌群差异分析结果
不同组中丰度差异显著的物种如图所示。结果显示,各组小鼠结肠菌群差异显著。N组小鼠,以放线菌门Actinobacteria、交替单胞菌目Alteromonadales、Muribaculaceae菌属等菌群的相对丰度较高;M组PD小鼠,以双歧杆菌属Bifidobacterium的相对丰度较高,与Erin等[26]的临床研究结果一致。L组小鼠中,脱硫弧菌科Desulfovibrionaceae显著富集;在P组小鼠中,拟杆菌门Bacteroidetes、瘤胃菌属Ruminnococcaceae等有益菌显著富集。
3 讨论
本研究采用C57BL/6J小鼠构建PD急性模型,经过MPTP处理后,小鼠明显状态不佳,行动迟缓、目光呆滞,毛发缺少光泽,运动能力及平衡能力下降。经处死后取材、分析得知,M组PD小鼠血清中的炎症因子IL-1β含量升高,黑质中多巴胺能神经元减少,催化自身合成左旋多巴胺的TH含量减少;α-syn含量增加、α-syn异常折叠的几率显著增加,表明MPTP造模成功。P组小鼠的运动及平衡能力显著优于M组PD小鼠,炎症水平显著低于M组,黑质中多巴胺能神经元数量显著多于M组,TH蛋白表达量均明显高于M组,α-syn蛋白表达量显著低于M组。此外,P组的上述指标也均优于L组。综上所述,紫菜联合美多芭治疗能够显著改善PD小鼠的脑功能,表明紫菜联合美多芭的疗效显著,且优于单独服用美多芭。
由16S rRNA测序结果可知,M组PD小鼠结肠内菌群OTU数量显著减少,结构紊乱,其丰富度与多样性均低于N组正常小鼠;而紫菜联合美多芭治疗可以起到明显的调节作用,菌群丰富度与多样性都有显著增强。M组中拟杆菌门Bacteroidetes相对丰度低,与Marcus[27]的临床研究结果一致;Blautia、Helicobacter等肠道炎症相关菌属的相对丰度高,表明M组小鼠的菌群结构易引起肠道炎症。P组中,与抗炎水平相关的Muribaculaceae、Dubosiella、Bacteroides、Allobaculum、Akkermansia的相对丰度升高,提示经紫菜联合美多芭治疗可降低PD小鼠炎症水平,与实验中测得的血清中IL-1β水平一致;此外,能够稳定肠道屏障的Ruminnococcaceae也在P组中显著富集,提示紫菜联合美多芭治疗可减轻MPTP对小鼠肠屏障的损伤。
多项研究表明,肠道菌群失衡引起的肠道炎症,最终会导致PD的形成。相关研究[28-30]提出,肠道内的炎症因子会增加肠道通透性、损伤血脑屏障,加速α-syn双向运输进入大脑的速度,继而导致脑部α-syn错误折叠的开始。Ruth等[31]提出,某些特定的促炎因子不仅会导致胃肠道疾病的发生,还会进一步引起脑部炎症和多巴胺能神经元的死亡,并最终导致帕金森病。
综上所述,紫菜联合美多芭治疗能够显著调节PD小鼠肠道菌群的结构,其神经保护作用可能是通过减少产生促炎因子的病原菌的相对丰度、增加抗炎菌属的相对丰度,以降低PD小鼠体内的炎症水平,避免脑部α-syn的异常折叠及多巴胺能神经元的丧失。
4 结论
通过本研究发现帕金森病使得正常小鼠的肠道菌群发生显著变化:肠道菌群多样性及丰富度降低,Lactobacillus、Muribaculaceae、Dubosiella的相对丰度分别降低了5.12%、10.06%、6.75%。紫菜联合美多芭干预PD小鼠后,Muribaculaceae、Dubosiella、Bacteroides、Allobaculum、Akkermansia的相对丰度分别升高10.71%、10.51%、15.83%、2.10%;黑质中神经元的数量、TH的表达量分别增加了46.95%、52.91%,α-syn的表达量减少了34.56%。
综上所述,本文探讨了紫菜联合美多芭的抗帕金森作用及其对肠道菌群的影响。结果表明,在MPTP诱导的PD小鼠模型中,紫菜联合美多芭可调节肠道菌群结构,且其抗帕金森作用优于单独使用美多芭。本文为紫菜的精深加工、功能性食品的开发提供了一定的理论基础;同时,为PD的临床治疗提供了新思路。

