冷鲜鸡在微冻贮藏过程中的菌群结构变化
唐梦君,周倩,张小燕,唐修君,陆俊贤,樊艳凤,杨星星,陈薇,高玉时
(江苏省家禽科学研究所,江苏扬州 225125)
鸡肉富含蛋白质以及人体必需的多种氨基酸,利用率高,肉质细嫩,滋味鲜美,且鸡肉消费没有宗教或文化限制,深受消费者的喜爱。由于鸡肉营养物质丰富且水分含量高,在其生产、加工、贮藏等过程中易受微生物的污染。微生物的生长繁殖是影响肉质腐败的直接因素,为延长货架期,降低贮藏温度以减缓微生物生长以及酶的活性是其有效措施[1,2],目前鸡肉低温保鲜主要有冷冻(-18 ℃以下)、冷藏(0~4 ℃)、冰温保鲜(0~-2 ℃)和微冻保鲜(-2~-4 ℃)[3-6]。微冻保鲜介于传统的冻结和冰温之间的温度,微冻技术能够保持样品的新鲜度和延长货架期,在保鲜领域具有较好地的发展前景[7]。
研究发现肉类在低温贮藏条件下,一些适合生存的腐败微生物如:假单胞菌属(Pseudomonasspp.)、希瓦氏菌属(Shewanella)、不动杆菌属(Acinetobacter)、热杀索丝菌(Brochothrix thermosphacta)等[8-11]可以利用鸡肉中丰富的营养物质进行生长繁殖,加速腐败进程,影响产品的货架期。冷鲜鸡微生物群落多样性因不同贮藏温度而有所差异[12]。吴海虹等[13]比较分析了冷鲜鸡在三种贮藏温度(4 ℃、0 ℃和-1.5 ℃)条件下微生物菌群多样性的差异。桂国弘等[14]报道了冷鲜鸡在4 ℃贮藏保存过程中的微生物菌群多样性,而有关冷鲜鸡在微冻条件下微生物菌落结构变化的研究还鲜有报道。
随着测序技术的快速发展,16S rRNA高通量测序技术已广泛应用于肉制品、水产品等食品领域细菌群落多样性分析[15,16],该技术无需对菌株进行培养,直接从样本中提取细菌总DNA进行分析,能客观反映样本的微生物群落组成,同时对多个样本进行检测,具有高效,结果可靠等优点。本研究采用16S rRNA高通量测序技术分析冷鲜鸡在微冻贮藏过程中菌群变化规律,以期为冷鲜鸡微冻保鲜研究提供参考依据。
1 材料与方法
1.1 仪器与设备
生物安全柜,日本ESCO公司;高速冷冻离心机,日本HITACHI;电泳仪,北京六一仪器厂;Bagmixer均质器,法国INTERSCIENCE;BC/BD-519HEX海尔冰箱,青岛海尔特种电冰柜有限公司。
1.2 主要试剂
细菌基因组DNA提取试剂盒,北京天根生化科技有限公司;DNA Marker,宝生物工程(大连)有限公司;无菌采样袋,青岛海博生物技术有限公司;琼脂糖,美国Sunshine公司;TransStartFastPfu DNA聚合酶,北京全式金生物技术有限公司。
1.3 方法
1.3.1 样品处理
从常州某肉鸡屠宰场采购黄羽肉鸡鸡肉样品,样品经三级水预冷,预冷后样品装于无菌采样袋中,分别置于-3 ℃冰箱微冻保存,取样时间分别为0、1、2、4、7、14、21和28 d,取鸡胸肉做检测样品,每个时间点各取2只鸡。
1.3.2 DNA提取和PCR扩增
无菌条件下取25 g鸡胸肉,用灭菌剪刀剪碎置于均质袋中,加入225 mL灭菌PBS,均质器拍打60 S,将肉样及液体转入灭菌50 mL离心管中,5 000 r/min离心10 min,转移上清至另一50 mL离心管中,12 000g离心5 min,去上清;重复上述步骤,直到样品离心完毕。用2 mL TE清洗沉淀两次(每次12 000g离心5 min),弃上清,菌体沉淀用于DNA提取。按照细菌基因组DNA提取试剂盒的方法操作,提取细菌总DNA,用Nano Drop 2000测定DNA浓度和纯度。选用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对16S rRNA基因V3-V4可变区进行PCR扩增,反应条件如下:95 ℃预变性5 min,30个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),72 ℃延伸10 min,4 ℃保存。反应体系为:5×TransStart FastPfu缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上下游引物(5 μmol/L)各0.8 μL,TransStartFastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL。将每个样本3个重复的PCR产物混合。
1.3.3 Illumina测序及数据处理
测序由上海美吉生物医药科技有限公司采用Illumina公司的MiSeq PE300平台完成,数据处理利用美吉生物生信云平台(https://cloud.majorbio.com)对样本进行OTU以及Alpha多样性(包括Shannon、Chao1和Coverage)分析;对物种进行Venn分析和群落组成分析,群落组成分析主要从门和属水平对样品的细菌组成进行分析。
1.3.4 数据统计分析
所有数据取2次平行样品的平均值,采用Excel软件进行数据处理和分析,同一时间点微冻组和冷藏组的Shannon指数和Chao1指数采用SPSS 26.0统计软件进行T检验差异分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与讨论
2.1 贮藏过程中细菌群落OTU和Alpha多样性分析
通过对0 d和在微冻条件下贮藏1、2、4、7、14、21和28 d以及4 ℃贮藏1、2、4和7 d共24个鸡肉样品进行16S rRNA测序,数据质控后,共得到有效序列1 363 037条。样本的优化序列长度主要分布在401~440 bp,集中在421~440 bp,平均序列长度421 bp。图1a和1b为鸡肉在微冻和冷藏贮藏过程中细菌的OTU韦恩分析结果。图1a显示:微冻条件下贮藏0~28 d 8组样本共注释出8 507个OTU,核心的OTU为95个,冷藏条件下贮藏0~7 d 5组样本共注释出3 253个OTU,核心的OTU为79个,说明在贮藏过程中有一些微生物一直存在,对腐败的变化有重大影响[17]。在微冻条件下,样品OTU的变化趋势是先降低后升高再降低的过程,新鲜鸡肉样品OTU为1 279个,微冻贮藏4 d后达到一个峰值,OTU为2 653个,说明产生了新的微生物,其菌落丰富度和多样性增加。此后,OTU值又逐渐降低,在贮藏后的21 d和28 d的OTU值为分别为426和487个,由此可以看出,在不同的贮藏时间,细菌多样性存在差异,在贮藏前期鸡肉处于鲜肉与次鲜肉之间,鸡肉营养成分高,细菌迅速生长繁殖,在后期,细菌多样性降低。说明低温对大部分微生物的生长产生了抑制作用,只有耐低温的细菌能生存下来。
微冻和冷藏两组样品的Alpha多样性分析结果见表1。样品测序覆盖率可反映测序样品中微生物的真实情况,数值越高,测序结果越准确。所有样品的测序覆盖率超过0.99,说明大多数微生物都被检测到,可进行后续分析[18]。Shannon指数反映群落多样性,Chao1指数反映群落丰富度[19]。冷鲜鸡在微冻和冷藏条件下,在贮藏期间呈现Shannon指数下降,说明冷鲜鸡在贮藏期间微生物多样性逐渐降低;在微冻贮藏组,Chao指数先上升,在贮藏后4 d达到高峰,然后又逐渐下降,而在冷藏贮藏组,Chao1指数呈现下降的趋势,说明在贮藏过程中微生物群落的丰富度趋向单一。以上结果说明,低温对大部分微生物的生长产生了抑制作用。在贮藏的第1、2、4和7天,微冻组和冷藏组相比,微冻组的Shannon和Chao1指数均高于冷藏组,表明在微冻条件下微生物群落多样性和丰富度比冷藏组高,分析其原因可能是在冷藏条件下,腐败微生物大量繁殖,产生的代谢物影响了其他菌种的生长,从而使得物种多样性和丰富度比微冻条件下降低更快。

表1 冷鲜鸡在不同温度贮藏过程中微生物Alpha多样性指数Table 1 Alpha diversity indexes of the chilled chicken during storage under different temperature
2.2 细菌群落结构分析
2.2.1 基于门分类水平上的分析
基于OTU注释结果,样本在门水平的群落组成采用柱形图来展示其菌落分布及差异性,微冻和冷藏条件下门水平的分类结果如图2和3所示。由图2可知,在门分类水平上,以相对丰度0.01%为阈值,将相对丰度<0.01%的菌门归为其他。冷鲜鸡在微冻和冷藏贮藏过程中优势菌门为:变形菌门、厚壁菌门、拟杆菌门、放线菌门和绿弯菌门,在整个贮藏过程中都存在,但在不同的贮藏阶段其所占的相对丰度有差异。在新鲜鸡肉样品中变形菌门(32.55%)、拟杆菌门(24.01%)、厚壁菌门(17.64%)和放线菌门(12.09%)是优势菌相,与茹志莹等[20]冰鲜鸡的最初优势菌相组成相似。变形菌门在整个贮藏周期内其丰度相对较大,初期占比为32.55%,随着贮藏时间的延长,其占比逐渐增加,在微冻条件下,贮藏第28 d,占比为87.81%,4 ℃冷藏7 d后,占比为98.33%,成为贮藏末期的优势菌门,厚壁菌门、拟杆菌门、放线菌门和绿弯菌门,则随着贮藏时间的延长,其占比逐渐降低。

图2 冷鲜鸡在微冻贮藏过程中微生物相对丰度Fig.2 Relative abundance of bacteria in chilled chicken during freezing storage

图3 冷鲜鸡在冷藏过程中微生物相对丰度Fig.3 Relative abundance of bacteria in chilled chickens during storage at 4 ℃
2.2.2 基于属分类水平上的分析
在属水平上,以相对丰度≥0.05%为阈值,将相对丰度<0.05%的菌属归为其他,在微冻和冷藏贮藏条件下,丰度≥0.05%的细菌属分别有13和9个,其具体种类见图4和图5。在新鲜样品中主要的污染菌属为:金黄杆菌属(9.62%)、不动杆菌属(7.6%)、棒状杆菌属(2.34%)、乳酸杆菌属(2.47%)和假单胞菌属(1.15%)。在新鲜样品中检测到金黄杆菌属、不动杆菌属和假单胞杆菌属,其主要原因可能是在屠宰加工过程中减菌效果不明显导致其成为贮藏过程中的潜在污染菌[21]。王倩等[22]研究发现鸡胴体经过预冷水后金黄杆菌属、假单胞菌属、不动杆菌属污染明显。

图4 冷鲜鸡在微冻贮藏过程中微生物相对丰度Fig.4 Relative abundance of bacteria in chilled chicken during partially frozen storage

图5 冷鲜鸡在冷藏贮藏过程中属水平上的微生物相对丰度Fig.5 Relative abundance of bacteria in chilled chickens during storage at 4 ℃
假单胞杆菌属、希瓦氏菌属、不动杆菌属和嗜冷杆菌属是在整个贮藏过程中丰度较高的4种菌属,但在微冻和冷藏贮藏条件下,其丰度变化存在差异,结果见图6。假单胞杆菌属在微冻条件下,在0到7 d贮藏期间,除了在贮藏后第7天数量偏高以外,其生长速度低于冷藏环境。在微冻贮藏2 d、4 d后,假单胞杆菌丰度增加不明显占比分别为2.16%和13.53%,而在冷藏条件下,贮藏后第2天假单胞杆菌属的比例已经增加到11.04%,贮藏第4天达到33.17%。在两种贮藏条件下的贮藏末期,假单胞杆菌属都是其优势腐败菌,这与以前的研究报道一致[23,24]。研究报道嗜冷杆菌属、希瓦氏菌属是冷鲜肉中的常见腐败菌,在冷藏过程中快速生长,使肉腐败变质[25-27]。在本研究中,冷鲜鸡肉在贮藏的0~7 d,希瓦氏菌属和嗜冷杆菌属均呈现上升趋势,在冷藏条件下,其生长速度高于微冻条件,在冷藏的第7天,其优势菌属为:假单胞菌属(54.93%)、希瓦氏菌属(26.69%)、不动杆菌属(8.74%)、嗜冷杆菌属(5.66%)、气单胞杆菌属(1.93%)、黄杆菌属(0.90%)、金黄杆菌属(0.50%)、乳球菌属(0.13%)和肠杆菌属(0.11%)。在微冻条件下,贮藏14~28 d,希瓦氏菌属和嗜冷杆菌属其占比降低,在贮藏28 d其占比分别为0.02%和0.49%,其生长受到了抑制。不动杆菌属中大部分细菌被认为是动物类食品中常见的致病菌属之一[28],在冷藏条件下,贮藏0~4 d,其丰度逐渐增加,到第4天达到峰值,为34.2%,第7天时又回落到8.74%。而在微冻条件下,贮藏0~7 d,其值低于冷藏条件,第7天时,丰度值接近,在贮藏21 d和28 d时,其丰度值较低,均为0.67%。由以上结果可以看出,在微冻条件下,随着贮藏时间的延长,其菌相组成趋向单一,在贮藏第28天时,主要为假单胞杆菌属。但在微冻整个贮藏过程中,冷鲜肉中假单胞杆菌属、希瓦氏菌属和嗜冷杆菌属的变化情况较为复杂,分析其原因有可能是在样本储存过程中,-3 ℃的冰箱温度有波动,导致其腐败微生物的丰度变化较冷藏条件下复杂,并不是简单递增或递减,而是一个不断变化的过程。
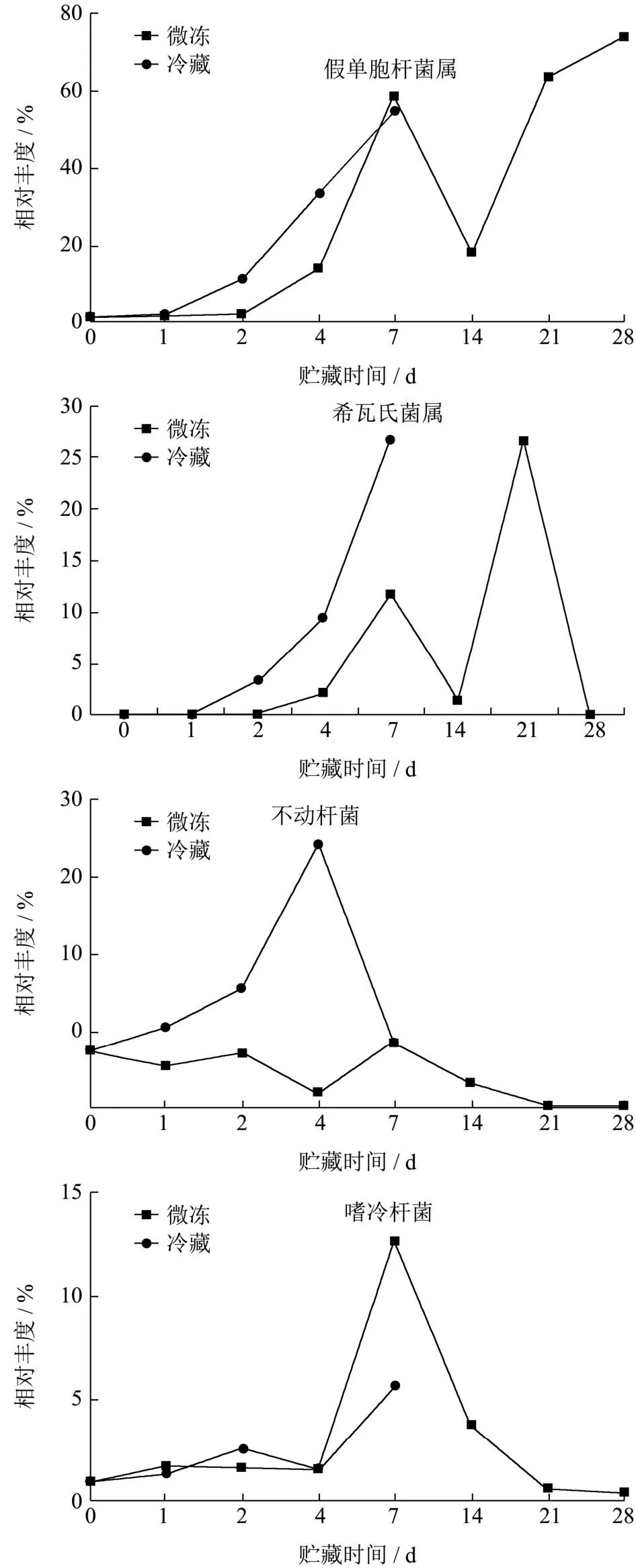
图6 冷鲜鸡在微冻和冷藏条件下不同冷藏时间4种优势腐败菌的相对丰度Fig.6 Fourdominant spoilage microorganisms in chilled chicken of different storage days under freezing storage conditions at-3 ℃ and 4℃
虽然对冷鲜鸡在贮藏期间微生物菌相的变化已有大量的研究报道[12,14],但不同的鸡肉样品其初始的微生物菌相以及贮藏后期的优势腐败菌并不相同。Zhang等[29]研究发现引起冰鲜鸡腐败变质的优势腐败菌属为热杀索丝菌、肉食杆菌属、发光杆菌属、假单胞菌属、不动杆菌属、沙雷氏菌属、库尔特氏杆菌属、希瓦氏菌属和肥杆菌属。茹志莹等[20]研究报道冰鲜鸡保鲜期间假单胞杆菌在后期急剧增加,成为优势腐败菌。温冬玲等[30]对不同温度下冷鲜鸡肉细菌的群落多样性的研究发现,在贮藏前期,假单胞杆菌比例最大,而类香味菌属为中后期优势腐败菌。吴海虹等[13]对不同贮藏温度(4、0和-1.5 ℃)对冷鲜鸡肉样品中菌群多样性的变化影响进行了研究,结果发现在4 ℃贮藏条件下样品的优势菌群为假单胞菌群,而在0 ℃和-1.5 ℃贮藏条件下样品的优势菌群为葡萄球菌。本研究发现冷藏条件下样品的优势菌群为假单胞菌属、希瓦氏菌属、不动杆菌属、嗜冷杆菌属和气单胞杆菌属,而微冻条件下贮藏末期样品的优势菌属主要是假单胞杆菌以及其他未明确的菌属。可见优势腐败菌因鸡只本身携带微生物的种类、不同屠宰企业的污染环境不同,以及不同的冷藏温度而有所差异。
3 结论
运用16S rRNA高通量测序分析冷鲜鸡在微冻条件下的菌群结构组成,结果显示,在微冻贮藏过程中,优势菌门为变形菌门、厚壁菌门、拟杆菌门和放线菌门,优势菌属为假单胞杆菌属、希瓦氏菌属、不动杆菌属和嗜冷杆菌属,在贮藏末期以假单胞杆菌属为主;在冷藏贮藏末期主要以变形菌门和拟杆菌门为主,假单胞菌属、希瓦氏菌属、嗜冷杆菌属和气单胞杆菌属为优势菌属。

