硼胁迫下烟草叶片转录组分析
王潇然, 李笑语, 孙慧, 于海东, 石永春
(河南农业大学生命科学学院,郑州 450002)
硼元素是植物细胞壁中重要的微量元素之一,与植物碳、氮代谢及核酸合成等众多生物学过程紧密相关[1]。硼含量的变化可能改变膜结合蛋白的结构,进而将外界信号通过细胞壁-细质膜-细胞骨架路径传递到胞内;同时,进入细胞核内的硼元素与相关蛋白结合影响部分转录因子活性,从而实现对内源基因转录水平的调控[2]。
Ali 等[3]发现,高硼含量影响烟草对氮素的吸收,可能是由于硼改变了H+-ATPase 活性,影响跨膜质子的运输,最终导致与质子共转运的氮素吸收受到抑制。硼含量的改变导致细胞内第二信使的Ca2+信号发生显著变化,并通过调节活性氧(reactive oxygen species,ROS)水平和NAD(P)H 氧化酶活性影响细胞代谢过程[4]。因此,土壤中适宜的硼含量是烟叶品质和产量的重要保证。研究表明,最适于烟草生长的土壤有效硼含量为0.5~1.0 mg·kg-1[5]。在我国干旱或半干旱植烟地区,土壤中硼含量多高于2.0 mg·kg-1,易造成严重的硼胁迫现象[6]。在西南烟区,重庆长江沿岸和湘西地区土壤中有效硼含量均高于烟草正常需硼量[7-8]。由于烟草对硼元素的敏感性较高,即使在缺硼地区,也容易因过量施用硼肥而导致短期的硼胁迫[9]。研究表明,硼胁迫会导致花椰菜蒸腾速率和光合速率下降[10];白桦叶片淀粉和己糖(葡萄糖和果糖)含量降低[11];向日葵[12]、小麦和大麦[13]根中总氮含量减少,硝酸还原酶活性下降;花生叶片中总氮和蛋白质含量下降[14];抑制茶树对磷的吸收[15]。
对烟苗进行无土栽培时,发现用200 mg·L-1的硼酸处理2 周即可导致硼胁迫现象,其株高仅为对照的70.00%,叶长为对照的80.93%,叶尖和叶缘出现变黄、干枯等现象[9]。但烟叶硼胁迫的临界值和烟叶对长期硼胁迫的响应机制都未见报道。烟叶是烟草的收获器官,因此,为深入研究烟草对硼胁迫的响应机理,本文通过高通量测序技术,结合生理和分子检测技术,对烟草响应硼胁迫的相关基因进行初步筛选,为深入理解烟草对硼胁迫的响应机制奠定基础。
1 材料和方法
1.1 试验材料
将栽培烟草‘K326’(Nicotiana tabccumcv.K326)种子铺于湿润的滤纸,萌发后转移至灭菌的烟草专用基质上,24 ℃、16 h 光/8 h 暗环境育苗至8叶期开始进行硼胁迫处理。
1.2 试验设计
将8 叶期烟草移入蛭石中,分别以含硼量为0、0.05、1.00、2.00、3.00 mmol·L-1的Hoagland 培养液浇灌,分别命名为T0、T0.05、T1、T2、T3。处理4 周,处理期间每隔3 d 浇100 mL 处理液,每次浇灌处理液之前用5 倍蛭石体积的去离子水冲淋,以确保处理水平的一致性。胁迫结束后,将第9 或第10 片叶去除叶缘和叶脉,液氮速冻后存于-80 ℃冰箱备用。
1.3 测定项目及方法
1.3.1形态学指标测定 叶长、叶宽和根长用软尺测量,根体积用排水法测定,根系面积用甲烯蓝法[16]测定。
1.3.2生理指标检测 利用比色法[17]测定叶绿素含量。脯氨酸含量按照Chakrabarty 等[18]的方法进行检测。总糖含量采用蒽酮法[17]定量检测。使用蔗糖/葡萄糖/果糖试剂盒(德国拜发,E0139 041)分析果糖、葡萄糖和蔗糖含量。依据邹琦[17]的方法测定淀粉含量。依据Van 等[19]的方法检测纤维素含量。果胶含量按照比色法[20]进行测定。蛋白质含量按照Bradford 等[21]的方法测定,H2O2含量按照Liu 等[22]的方法进行检测。硼含量采用杨洁等[23]的方法用安捷伦ICP-OES 光谱仪测定。
1.3.3抗氧化酶活性测定 过氧化氢酶(catalase,CAT)活性采用紫外吸收法,过氧化物酶(peroxidase,POD)活性采用愈创木酚法,超氧化物歧化酶(superoxide dismutase,SOD)采用硝基四氮唑蓝还原法测定[17];蔗糖合成酶(sucrose synthetase,SS)、蔗糖磷酸合成酶(sucrose phosphate synthetase,SPS)活性的测定采用Pramanik等[24]的方法测定。
1.4 高通量测序及数据分析
将T0.05和T2处理后冻存的烟草叶片送到壹基因公司测序,每个处理3 次重复。提取样品总RNA 并使用DNase Ⅰ消化,然后用带有Oligo(dT)的磁珠富集mRNA;打断后合成一链cDNA 和二链cDNA,回收加接头,再进行PCR 扩增建库;质检合格后用Illumina HiSeqTM4000 测序仪进行测序。将获得的原始序列(raw reads)进行质控(quality control,QC)后过滤得到分析数据(clean reads),用SOAPaligner/SOAP2 与参考序列进行比对,而后利用R语言DESeq数据包筛选差异表达的基因(differentially expressed genes,DEGs),筛选标准为|log2Ratio|≥1 且FDR(false discovery rate)≤0.05。利用Kyoto Encyclopedia of Genes and Genomes(https://www.genome.jp/kegg/)和The Gene Ontology Resource(http://geneontology.org/)数据库对差异基因进行注释,利用R 语言完成GO 和KEGG pathway显著性富集分析。
1.5 实时荧光定量PCR检测
随机选取部分差异表达基因对上述冻存的样品进行荧光定量PCR 检测,以actin为内参,参照TB Green®Premix Ex Taq™ Ⅱ (TliRNaseH Plus,TaKaRa 公司)试剂盒的说明书配制反应体系。所用引物如表1所示。
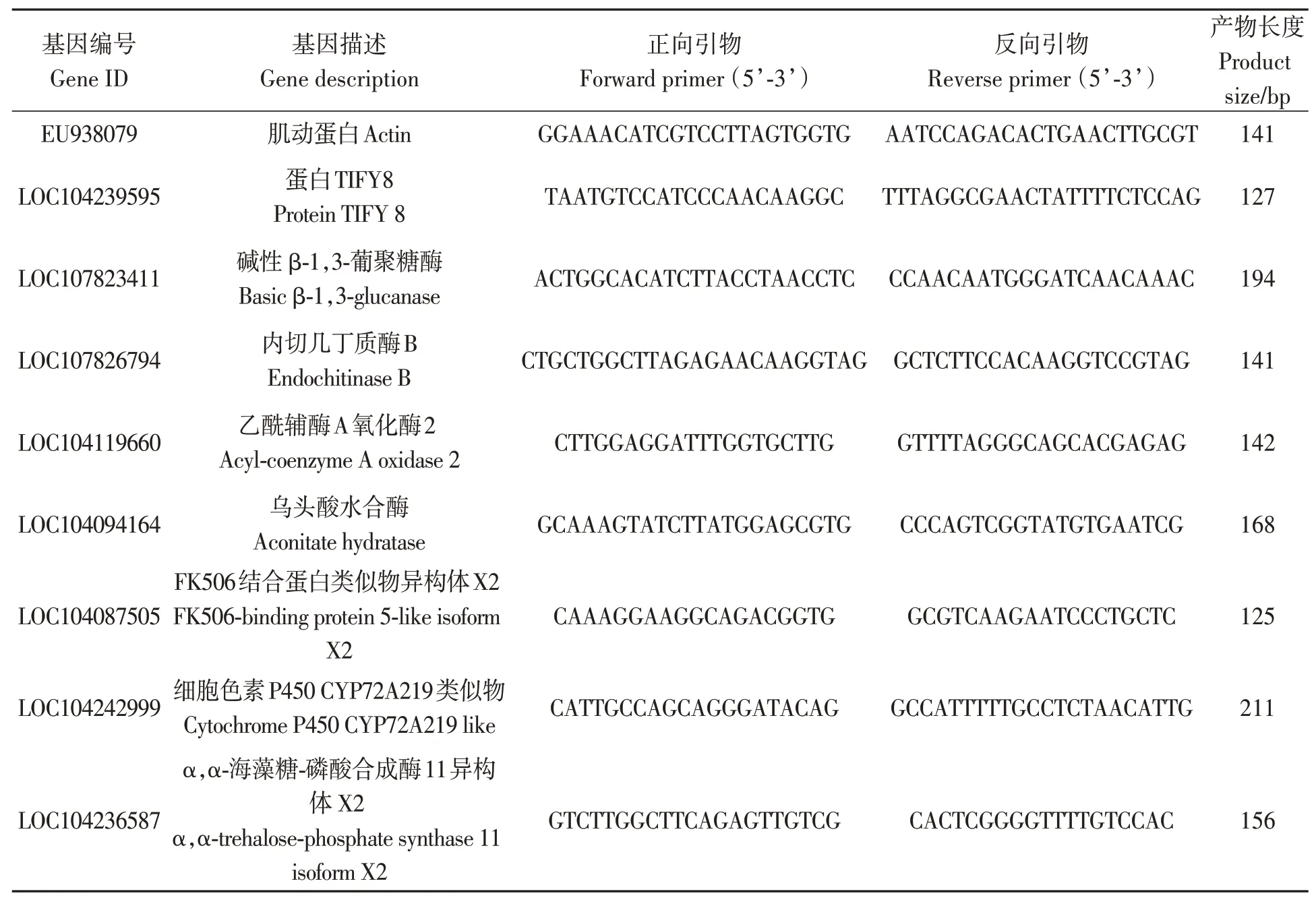
表1 引物序列Table 1 Primer sequences
1.6 数据分析
采用SPSS 21.0 和Excel 2010 软件对数据进行统计分析。
2 结果与分析
2.1 硼胁迫对烟草生长的影响
为明确硼胁迫对烟叶生长的影响,以烟草栽培种‘K326’为试验材料,在8 叶期连续4 周进行不同水平的硼处理,结果(图1)表明,处理4周后,与T0相比,硼胁迫处理均导致烟株矮小,叶片变小,且对烟叶生长的抑制作用随硼用量的增加而加重。其中,T0.05的叶片略小但生长状态最好,T1处理出现叶缘轻微焦枯现象;T2处理叶缘出现明显焦枯现象;T3处理则更严重。分析不同处理下烟叶的叶长和叶宽,结果(图2)表明,处理组第10叶的叶长和叶宽均显著低于对照,且表现为随硼含量的增加而减少,其中T2和T3处理又极显著低于T0.05和T1处理;而T0.05与T1处理、T2与T3处理间差异不显著。因此,后续试验及分析均以2.00 mmol·L-1(T2处理)进行硼胁迫处理。

图1 不同硼处理下烟草的生长Fig. 1 Growth of tobacco in different treatments

图2 不同处理下烟草的叶片形态Fig. 2 Morphological indexes of tobacco leaves in different treatments
2.2 硼胁迫对烟叶内主要成分的影响
为进一步分析硼胁迫抑制烟叶生长的原因,对T0和T2处理烟草相同叶位叶片的硼含量及其生理指标和酶活性进行了对比分析(表2~4)。结果表明,硼胁迫4 周后,硼主要积累在烟叶中,T2处理叶片中的硼含量是T0的7.256 倍;茎和根中的硼含量分别为T0的1.353 和1.554 倍(表2)。硼胁迫处理叶片中的可溶性总糖含量极显著降低,仅为T0的57.7%;葡萄糖和果糖含量变化较小,但蔗糖含量显著降低,仅为T0的38.4%;淀粉含量显著下降,为T0的48.7%;叶绿素及类胡萝卜素含量与T0差异不显著;作为细胞壁主要组成成分的纤维素和果胶,硼胁迫处理后分别降至T0的64.0%和65.9%;硼胁迫极显著提高了烟叶中脯氨酸、蛋白质和H2O2含量,分别为T0的1.582、1.421、5.198倍(表3)。酶活性检测显示(表4),T2处理叶片中SOD 活性极显著低于T0;POD 活性极显著高于T0;SPS 活性显著高于T0;SS 活性与T0差异不显著。

表2 不同处理下烟株各器官的硼含量Table 2 Boron contents in different tissues of tobacco under different treatments (mg·g-1 DW)

表3 不同处理下烟草叶片的生理指标Table 3 Physiological indexes of tobacco leaves under different treatments (mg·g-1 FW)

表4 不同处理烟草叶片的酶活性Table 4 Enzyme activities in tobacco leaves of different treatments(U·g-1)
2.3 硼胁迫对烟草叶片中碳代谢的影响
形态及生理指标检测证实,高水平硼胁迫影响烟叶的物质代谢及生长发育,但烟草的正常生长又需要硼,因此,为筛选响应高浓度硼胁迫的基因及代谢通路,本研究以T0.05(常规Hoagland培养液)为对照,T2为处理对烟叶样品进行转录组测序分析,共获得差异表达基因389 个。对上述基因进行KEGG富集分析,获得显著富集的前20个途径,硼胁迫主要影响烟草次生代谢物的合成、苯丙烷类合成、植物和病原菌互作、苯丙氨酸代谢,植物激素信号转导、淀粉和蔗糖代谢、芪类和姜醇代谢、黄酮类合成、氨基糖和核苷酸糖代谢、亚麻酸和甘油磷脂代谢等途径(图3)。

图3 硼胁迫响应基因KEGG富集分析Fig. 3 KEGG enrichment analysis of DEGs responding to boron toxicity
在淀粉和蔗糖代谢途径中,硼胁迫处理后,烟叶中内切葡聚糖酶11(LOC104086800)和18(LOC104216009)、β-淀粉酶3(LOC104239567)、果胶酯酶(LOC104118953)、α, α-海藻糖磷酸合酶11 同型X1(LOC104236587)、β-D-木糖苷酶2(LOC104210063)显著上调;内切葡聚糖酶6 类(LOC104116779、 LOC104215840)、海藻糖酶(LOC107800135)、β-葡糖苷酶13 类同型X1(LOC104110715)、β-D-木糖苷酶5(LOC104228982)、蚕豆氰苷水解酶(LOC104218490)、半乳糖醛酸转移酶类1(LOC104087120)、果胶酯酶抑制子51 同型X1(LOC104117285)显著下调(表5)。其中,上调的磷酸海藻糖合酶催化合成海藻糖,下调的海藻糖酶降解海藻糖,这可能导致烟叶中海藻糖的积累。由于海藻糖参与植物的抗病信号途径[25],这一现象可能暗示硼参与烟草抗病信号调控。另外,上调的内切葡聚糖酶和果胶酯酶分别催化纤维素和果胶的分解;果胶酯酶抑制子51 同型X1的下调则进一步促进了果胶的水解。β-D-木糖苷酶参与木聚糖的分解,不同种类β-D-木糖苷酶的表达水平变化可能暗示木聚糖的分解在不同的组织中受到的影响不同。
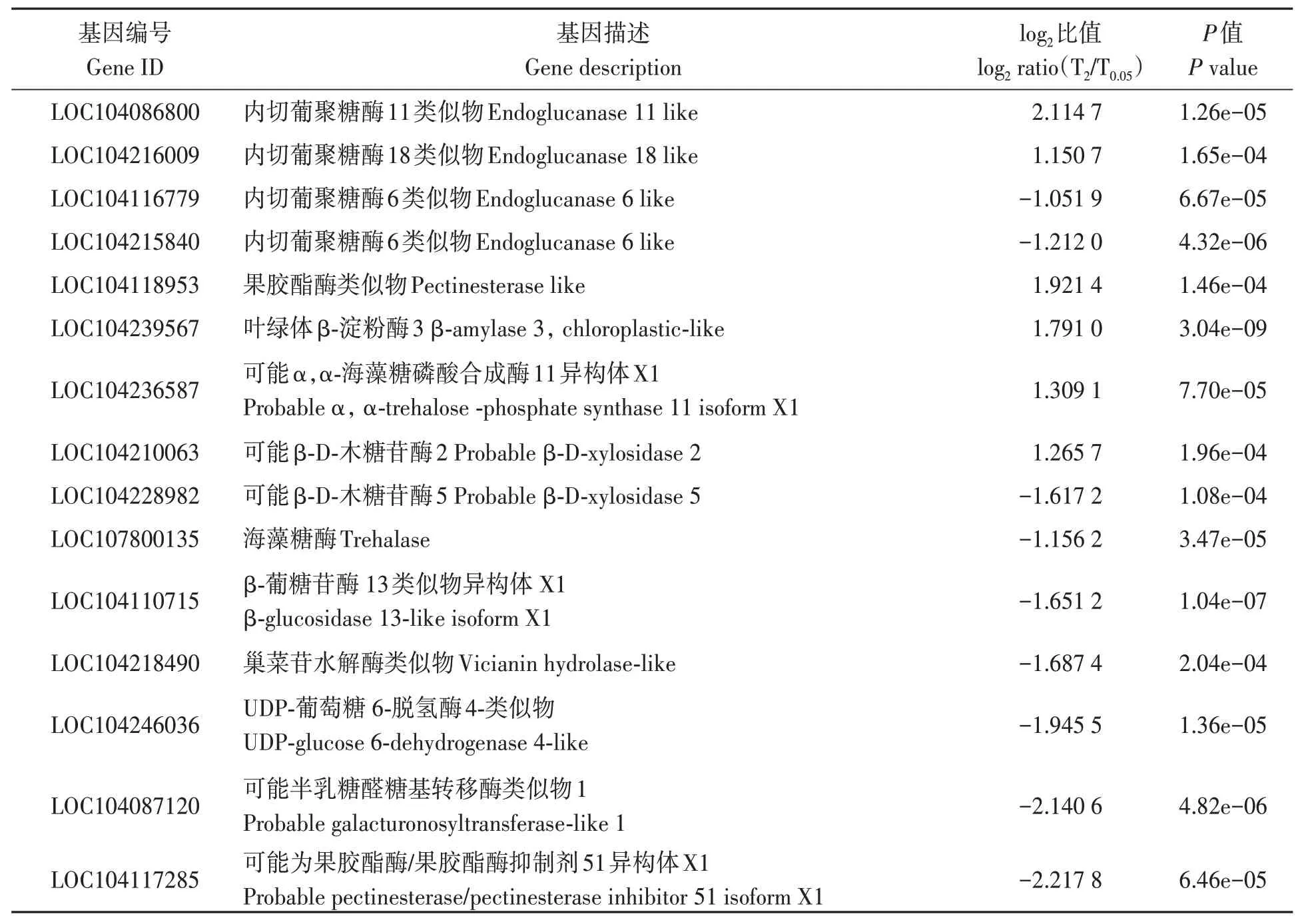
表5 响应硼胁迫的淀粉和蔗糖代谢途径相关基因Table 5 Genes related to starch and sucrose metabolic pathways responding to boron toxicity
2.4 硼胁迫对烟叶脂类代谢的影响
脂类是烟叶中重要的香气来源和组成成分,KEGG 分析表明,硼胁迫导致脂类代谢途径相关基因的表达丰度发生波动(表6)。其中涉及脂肪酸合成的乙酰CoA 羧化酶1 类(LOC104089343)、3- 酮二氢鞘氨醇还原酶类同型 X2(LOC1042 45391)均显著下调,表明脂肪酸的合成受到抑制;参与脂肪酸降解的过氧化物酶体中的酰基CoA 氧化酶2(LOC104119660)显著上调,表明硼胁迫可能促进脂肪酸的降解;而参与脂肪酸延长的3-酮酯酰CoA 合酶6(LOC104214086、LOC104094697)、3- 酮酯酰CoA 合酶19 类(LOC104228778、 LOC104218838)、长链酰基CoA合成酶2(LOC104110787)显著下调,暗示硼胁迫可能抑制长链脂肪酸的合成;但涉及不饱和脂肪酸合成的长链烯酰CoA 还原酶类(LOC104114213)显著上调,推测硼胁迫可能影响某些长链不饱和脂肪酸的含量。

表6 响应硼胁迫的脂肪酸代谢途径相关基因Table 6 Fatty acid metabolic related genes that responding to boron toxicity
2.5 硼胁迫影响烟叶的抗逆能力
硼胁迫导致烟叶中脯氨酸含量和酶活性发生变化,由此表明硼胁迫可能影响烟草的抗逆性。由表7 可知,硼胁迫后,除抗病蛋白RPP13(LOC104234903)基因显著下调外,碱性发病相关蛋白PR1(LOC104235161)、抗病蛋白(LOC104116631)、抗病蛋白RPM1 类(LOC104233182)的表达显著上调;富含半胱氨酸的受体类蛋白激酶3(LOC104216132)、响应胁迫的G 类植物凝集素S-受体类丝氨酸/苏氨酸蛋白激 酶 At4g27290 同 型 X1(LOC104217774、LOC104241125、 LOC104246103)的表达水平上调,仅G 类植物凝集素S-受体类丝氨酸/苏氨酸蛋白激酶At5g24080 同型X1(LOC104096948)表达下调;富含脯氨酸的受体类蛋白激酶PERK9(LOC104103311)表达水平上调;响应胁迫的磷酸烯醇式丙酮酸羧化酶激酶1 类(LOC104236563、LOC104091723)表达水平上调;PTI1 类酪氨酸蛋白激酶At3g15890 类(LOC104223256)、ZmPK1 类受体类蛋白激酶(LOC104084644)、丝氨酸/苏氨酸蛋白激酶同型X2(LOC104216857)的表达水平上调;响应胁迫的多聚半乳糖醛酸酶抑制剂类(LOC104112558) 、 转 录 因 子 PIF1 类(LOC104093573)、参与抗病途径的TIFY8(LOC104239595)的表达水平上调,呼吸爆发氧化酶蛋白E类(LOC104111058)的表达下调。
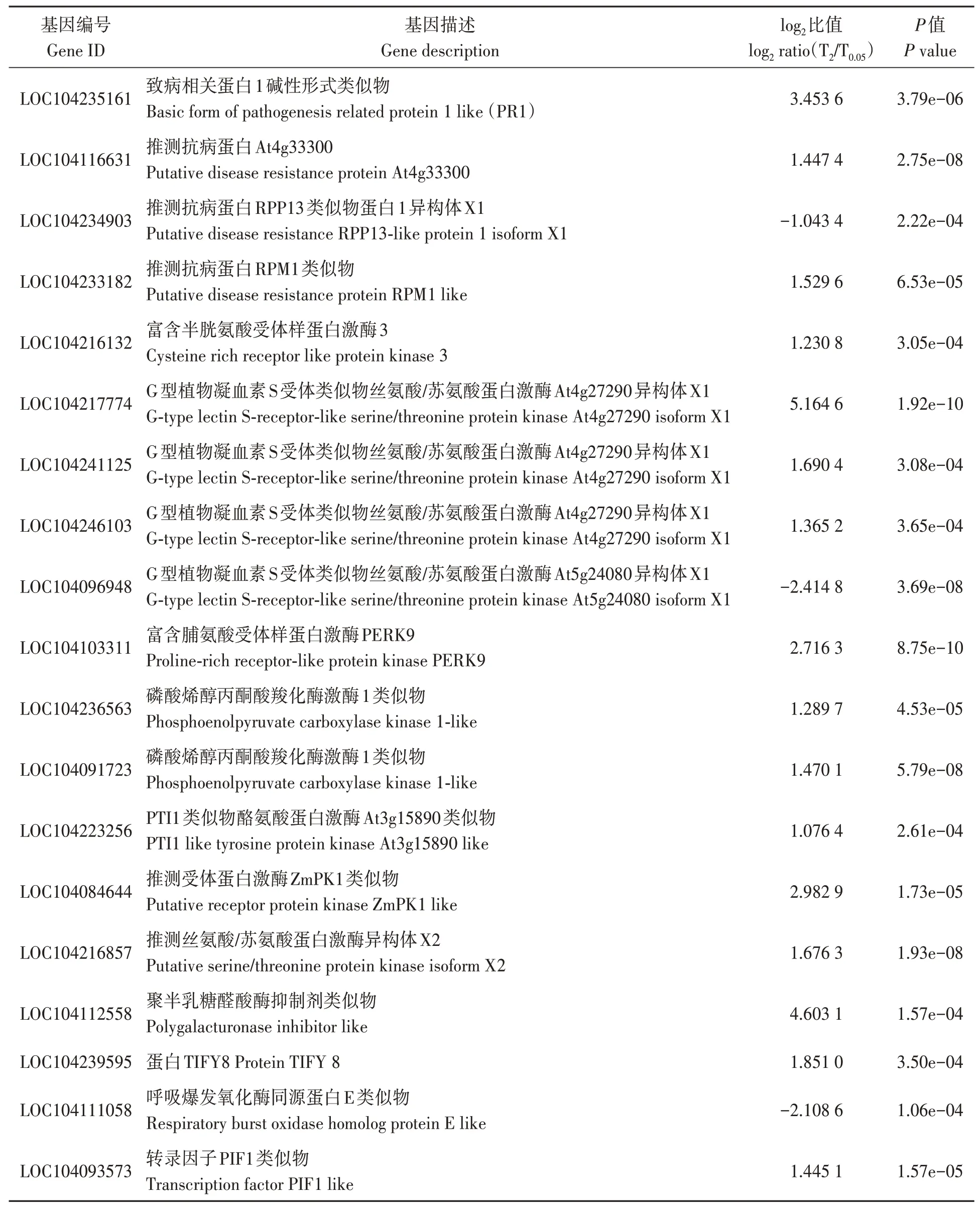
表7 响应硼毒害的生物胁迫应答基因Table 7 Genes responding to boron toxicity
2.6 硼胁迫影响烟叶的激素信号转导
激素是调节植物生长发育的重要信号之一。转录组分析发现,硼胁迫造成多个激素信号通路改变(表8)。响应乙烯(ethylene)信号途径的乙烯响应转录因子ERF003(LOC104096661)和乙烯受体蛋白(LOC107784797)表达水平上调,表明硼胁迫激活乙烯信号途径。硼胁迫处理后,烟叶中的生长素(IAA)受体蛋白TIR1(LOC104085449)表达水平显著下调;而抑制生长素信号的生长素响应蛋白IAA26(LOC104100899)和生长素响应因子ARF9(LOC104243881)表达水平上调,表明生长素信号途径被显著抑制,从而影响烟叶生长。响应茉莉酸(jasmonic acid,JA)信号途径的TIFY8蛋白(LOC104239595)和响应水杨酸(salicylic acid,SA)信号途径的转录因子 TGA2.1(LOC107782457)的表达水平均上调,它们都能激活碱性PR1 蛋白(LOC104235161),从而增强烟叶抗病性。负调控脱落酸(abscisic acid,ABA)信号的蛋白磷酸酶PP2C 37(LOC104086506)表达水平下调;响应ABA 的转录因子PIF1(LOC104093573)表达水平上调,推测硼胁迫促进了ABA信号途径。

表8 响应硼胁迫的植物激素信号转导相关基因Table 8 Genes related to hormone signal transduction in plants responding to boron toxicity
2.7 荧光定量PCR验证分析
为验证转录组数据的可靠性,随机选取8个差异基因(表1)进行qRT-PCR验证,而后将验证基因T2/T0.05的相对表达倍数取Log2,与转录组数据比对线性关系,结果(图4)显示,二者间存在良好的线性关系(R2=0.872 6),表明转录组数据真实可靠。
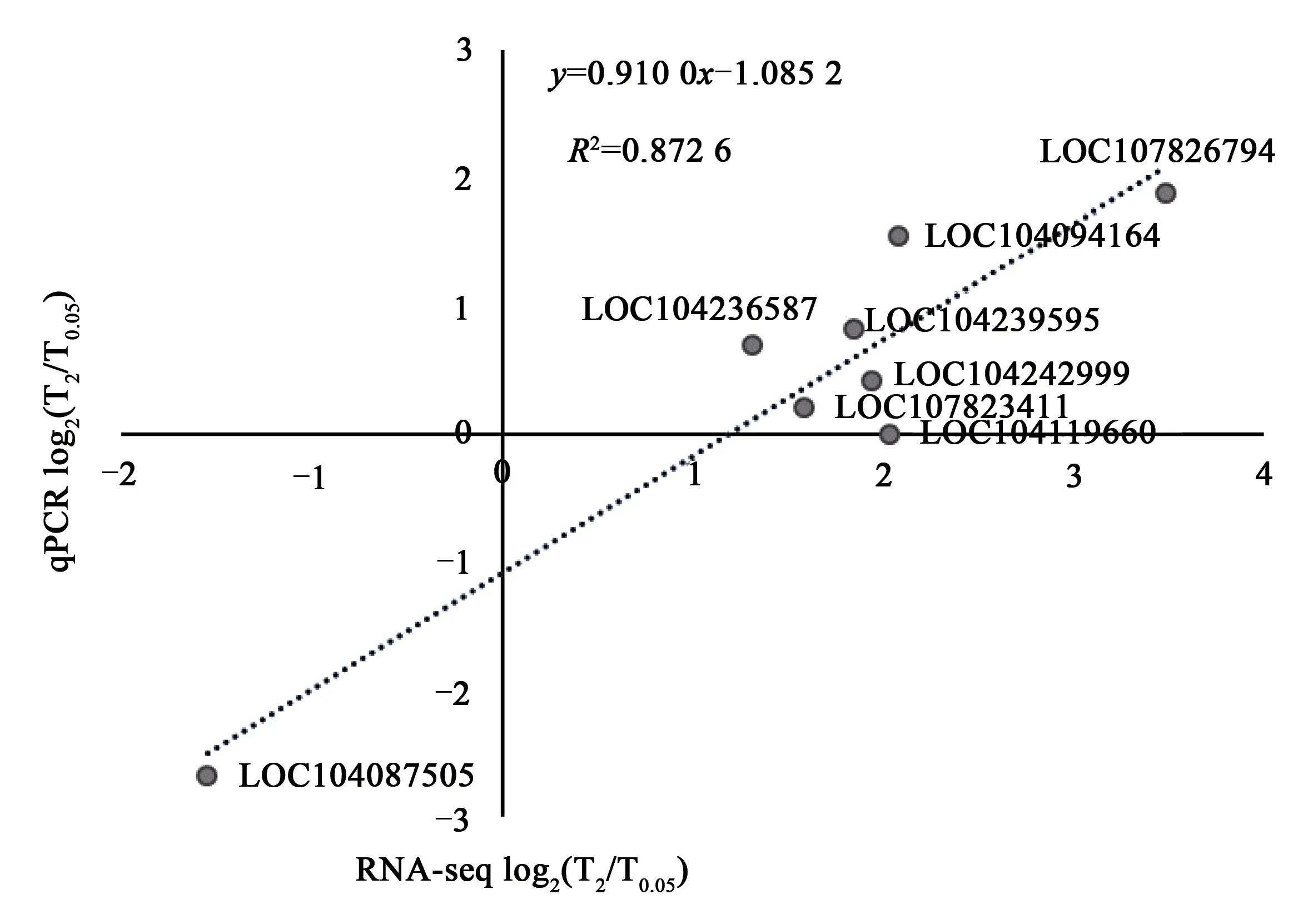
图4 差异表达基因qRT-PCR验证Fig. 4 Validation of transcript abundance of differentially expressed genes based on qRT-PCR
3 讨论
硼胁迫影响植物生长发育已经被广泛报道,在棉花、小麦等作物中均有发现[26-27];在烟草中,硼胁迫影响烟株的农艺性状,并导致净光合速率、POD 活性、干物质量及经济效益均显著降低[28]。本研究发现,硼胁迫导致烟株矮小,烟叶变小变厚;且发现硼主要积累于烟叶中,硼毒害造成烟叶中可溶性总糖含量显著降低,仅为对照的57.7%,其中蔗糖含量仅为对照的38.4%;淀粉、纤维素和果胶的含量也显著降低。组学分析显示,负责降解淀粉的β-淀粉酶3(LOC104239567)和纤维素的内切葡聚糖酶11(LOC104086800)、18(LOC104216009)均上调表达,与生理检测结果趋势一致。Massod 等[29]对小麦进行高硼胁迫6 周后,也发现叶片中总糖和蔗糖含量显著降低,认为这是由于矿质元素紊乱造成的碳代谢抑制。高硼处理凤梨也导致叶片中矿质元素紊乱,总糖和淀粉含量降低[30]。长期高硼胁迫导致烟草的总糖含量降低是否也与矿质元素紊乱有关,且影响了哪些矿质元素,还有待进一步的研究。
在大豆中发现硼胁迫导致脂肪酸总量降低,尤其是软脂酸显著降低[31]。本研究发现,硼胁迫造成烟草脂肪酸从头合成途径的关键酶乙酰CoA羧化酶表达水平下调,而脂肪酸β-氧化途径的酰基CoA 氧化酶表达水平上调,参与脂肪酸延长途径的3-酮酯酰CoA合酶和长链酰基CoA合成酶表达水平下调,表明硼胁迫可能在促进脂肪酸降解的同时,又抑制了脂肪酸、尤其是长链脂肪酸的合成,进而导致烟叶中脂肪酸含量降低。脂肪酸是脂类物质合成的原料,其含量降低将导致烟叶油分减少,品质下降。同时,脂肪酸是合成细胞膜的主要成分之一,其合成受阻可能干扰细胞的正常分裂。
氮素代谢直接关系烟叶的产量和品质。番茄受硼胁迫后叶片中谷草转氨酶和谷丙转氨酶活性升高,蛋白质含量随硼胁迫强度的升高而增加[32]。大豆[31]种子、拟南芥[33]和玉米[34]叶中的蛋白质也随着硼胁迫强度的增加而增加。本研究发现,硼胁迫后烟叶中蛋白质含量显著增加。尽管组学分析未检测到氮素代谢相关基因的表达变化,但其他作物在硼胁迫后蛋白含量增加,由此推断硼胁迫可能在加速糖类分解代谢的同时,促进了糖类碳骨架向蛋白质的转换。
硼与植物的抗病性密切相关[35]。植物的抗病能力通常借助抗氧化酶活性的提高、启动超敏反应、增强防御基因表达等体现[36]。Rezaee 等[37]发现,0.1 mmol·L-1硼处理洋桔梗24 h 后,洋桔梗中的SOD、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性增强,其中CAT 尤其显著。Kayihan 等[33]将拟南芥在含有3.0 mmol·L-1硼的MS 培养基上培养14 d,其叶片中GR、DHAR和APX基因的表达水平显著增加,表明激活了AsA-GSH 循环,提高了拟南芥抗氧化能力和抗病性。本研究发现,硼胁迫处理烟株4周,不仅显著增强了烟叶POD 活性,还在植物抗病机制信号途径中,上调了发病相关蛋白PR1、抗病蛋白RPM1 以及响应胁迫的大量受体类蛋白激酶基因的表达,如富含半胱氨酸的受体类蛋白激酶3、G类植物凝集素S-受体类丝氨酸/苏氨酸蛋白激酶[38]、磷酸烯醇式丙酮酸羧化酶激酶[39]等关键生物胁迫应答基因的表达水平,因此,硼元素可能具有提升植物耐受生物胁迫的能力。尽管如此,但高硼积累通常引发烟草代谢紊乱,使其产量及品质下降。因此,探索科学合理的硼肥施用方案,可实现在稳产优质的同时,提升烟株抗病性,在烟草乃至其他作物栽培过程中具有重要应用价值。
植物生长受多种激素信号系统的综合调控。Eggert 等[40]研究了油菜幼苗受短期(7 d)低硼处理(2.0 mg B·kg-1土)后叶片中的激素变化,发现随硼水平的增加,叶片中IAA 和ABA 含量降低,GA含量增加,SA 含量无显著变化。对玉米叶面喷施萘乙酸(naphthlcetic acid,NAA)和IAA,可有效降低硼胁迫对叶片造成的氧化胁迫[35]。由此推测,激素信号途径可能是硼胁迫抑制植物生长的主要途径,尤其是IAA信号途径。本研究发现,硼胁迫处理4 周后,烟叶中多个激素信号途径相关基因表达发生变化。其中IAA 受体TIR1的表达水平显著下调;SA 信号途径中的TGA表达水平上调;乙烯信号途径中的乙烯响应转录因子ERF 和乙烯受体蛋白的表达水平上调,暗示硼胁迫还可能激活烟叶中SA 和乙烯信号途径。硼胁迫导致负调控ABA 信号的蛋白磷酸酶基因PP2C-37的表达水平下调,响应ABA的转录因子基因PIF1的表达水平上调[41],推测硼胁迫促进了ABA 信号途径信号转导。由于SA 和ABA 信号途径与植物的抗病和抗逆响应机制密切相关[34],通过检测SA 信号途径中的TGA、ABA 信号途径中的PP2C 和抗病蛋白PR1 的表达变化,可为硼在烟叶抗病或抗逆机制中的应用提供参考。

