多价态金属离子与藻菌共生体胞外聚合物作用对膜污染的影响
孙 晨,史康佳,冯自强,陈姝灿,高梦嘉,丁梓尧,罗 娜,王锌针,熊川懿,李 昆
(南昌大学a.资源与环境学院;b.鄱阳湖环境与资源利用教育部重点实验室,江西 南昌 330031)
近年来,随着各种水环境问题愈演愈烈以及污水排放标准的不断提高,基于微藻和细菌共生形成的藻菌共生体的污水处理技术获得了越来越多的关注。在藻菌共生体处理废水的过程中,微藻的生长繁重过程所需要的碳源可以通过CO2提供,同时利用废水中过量的氮磷等营养物质,通过光合作用产生氧气供细菌利用;而细菌可以将废水中的有机物降解为CO2,将有机氮磷降解为无机氮磷供微藻利用,形成藻菌共生关系,使得藻菌共生体在污水处理中获得更好的污染物去除效果和更好的生长状况,实现协同作用。膜过滤技术是依靠膜的选择性,借助膜两侧的能量差作为驱动力,从而使液料分离的一种技术[1]。将膜过滤技术与藻菌共生体相结合,可以有效截留生化处理工艺中的微生物絮体,提高生物负荷和处理效率,是目前非常具有应用前景的新型废水资源化处理工艺之一。而目前针对藻菌共生体-膜耦合工艺中的膜污染的形成机制尚有待进一步研究和探索。
研究显示,膜污染与微生物絮体胞外聚合物(Extracellular Polymeric Substances,EPS)的组成和性质密切相关[2-3]。EPS作为造成膜污染的重要成分[4],其主要由多糖、蛋白质及腐殖酸、脂质和核酸物质等组成[5-6]。EPS与水可以形成稳定的水凝胶,被认为是生物膜稳定的原因,而金属离子则被认为会影响EPS的凝胶机制,从而影响生物膜的稳定性[7]。废水中的某些金属离子的存在,如Ca2+,Mg2+,Fe3+,Al3+等,也会与EPS有机物成分发生相互作用,并在一定程度上对膜污染产生影响[8-10]。有研究显示在富藻水中的超滤膜污染情况,Ca2+和Al3+对缓解膜污染有显著影响,且Ca2+的影响要大于Al3+,而K+则对膜污染的影响较小[11]。还有研究发现,在MBR除磷系统中将铁盐或铝盐添加到混合液中,有助于减少跨膜压差,主要原因是金属离子会导致上清液中有机物减少或是形成了较大的絮凝物造成的,减轻了膜孔堵塞作用,进而在一定程度上减缓膜污染[12]。
尽管关于膜污染的研究已有很多,但针对藻菌共生体分泌的EPS与不同价态金属离子在混合液中相互作用对膜污染的影响的研究还有待深入研究,基于此,本研究将多种不同价态金属(典型二价盐类CaCl2、MgCl2及三价盐类FeCl3、AlCl3)离子加入EPS混合液中,通过对膜通量变化的监测和进出水成分的测定,并结合膜污染模型拟合和分析,考察超滤过程中金属离子与EPS组分相互作用对膜污染状况的影响和作用机制。
1 材料和方法
1.1 实验材料及装置
分别选取未驯化的小球藻和活性污泥进行驯化培养,待小球藻和活性污泥生长良好后通过干重法测定生物量。反应器内小球藻浓度0.2 g·L-1,活性污泥浓度1.0 g·L-1,小球藻和活性污泥接种浓度比例为1:5。实验温度为室温25 ℃,光照强度设定为4 000 lux,明暗周期比为12 h:12 h。
实验所用超滤膜为PVDF平板膜(上海SINAP,中国),超滤膜孔径0.1 μm,截留分子量约为100 kDA,有效过滤面积28.3 cm2。
采用8200型超滤装置(UFSC20001,Millipore,美国)进行死端过滤,超滤膜有效过滤面积28.3 cm2,加入料液的体积约190 mL,外加压力通过氮气钢瓶提供,外加压力通过压力阀控制,稳定压强在0.02 MPa,料液开盖倒入,滤液经过导管流向电子天平上的容器中,电子天平连接在线监测仪,利用在线监测仪记录数据变化。
1.2 实验方法
将小球藻和活性污泥按浓度接种进入稀释处理后的养殖废水中,进行光照和曝气,定时进行取样,测定其废水水质各项指标,待处理效果趋于稳定时,进行EPS的提取。提取采用超声波提取法:取300 mL样品,在6 000 r·min-1离心5 min,倒去上清液,加入0.85%NaCl溶液直至体积到达原体积,重复进行此步骤3次完成污泥洗涤,之后将样品加热超声提取30 min,超声设置为70 ℃,200 W,40 kHz。待液体完全冷却之后,在离心机中以10 000 r·min-1离心10 min,离心结束之后取上清液过0.45 μm膜所得溶液即为EPS。
分别向八组EPS溶液中添加Ca2+、Mg2+、Fe3+、Al3+离子,每种离子分别为浓度为20、30 mg·L-1,添加后搅拌30 min以上,使离子与EPS充分反应,反应后溶液加入超滤杯中,在一定压力下进行过滤,实时记录液体的质量。
2 结果与讨论
2.1 废水水质变化
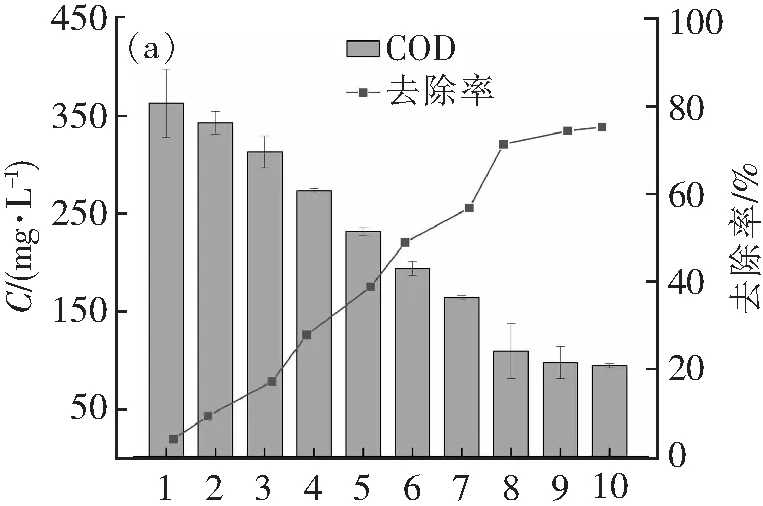
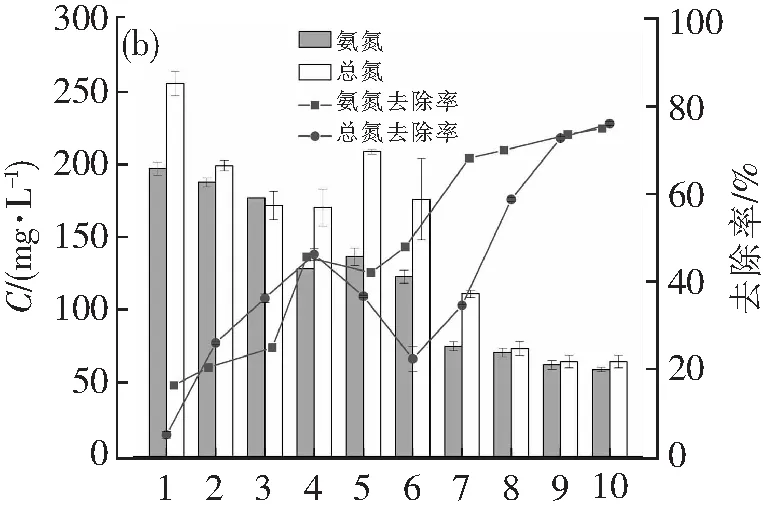
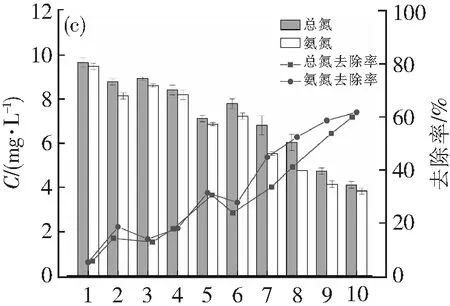
图1显示了藻菌共生体系对废水中COD、氨氮和总氮、磷酸盐和总磷的去除情况。COD去除率在1~8 d呈现出快速上升的趋势,在第8~10 d均开始呈现减缓的稳定趋势。COD由363.3 mg·L-1降为93.3 mg·L-1,去除率为75.34%。氨氮及总氮的去除效果接近,其中氨氮在第5天经历了上升到136.5 mg·L-1,再下降到122.8 mg·L-1的过程,最后氨氮浓度稳定在59.4 mg·L-1,去除率为74.71%;而总氮也在在第5、6天经历了上升到208.4 mg·L-1,再下降到175.6 mg·L-1的过程,浓度最终稳定在64.7 mg·L-1,去除率为75.82%,这可能是小球藻释放有机氮,细菌将其吸收转化为无机氮的原因造成的。磷酸盐及总磷则分别从9.47、9.65降至3.83及4.11 mg·L-1,去除率分别为61.62%,59.79%。说明藻菌共生体对养殖废水的处理有明显的效果,其中COD和氨氮的降解效果较好。
t/d
t/d
t/d
2.2 膜通量变化
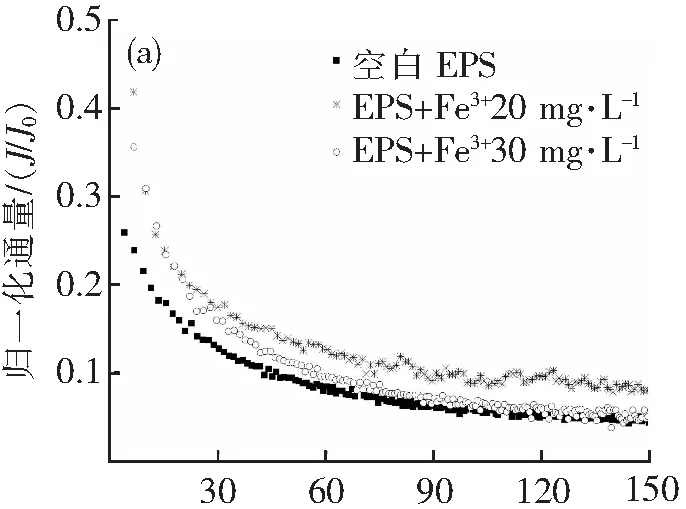
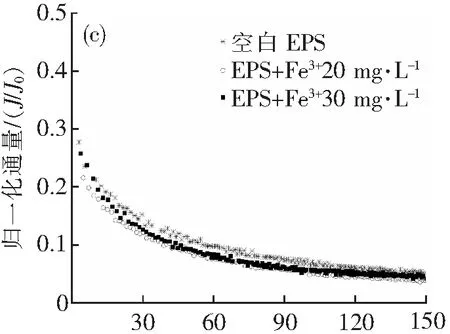
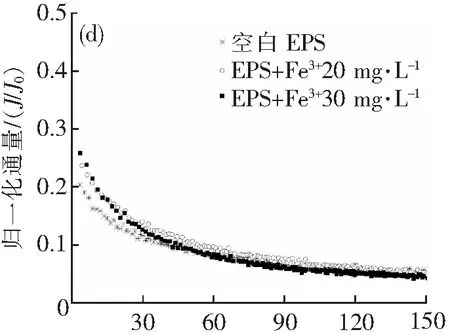
由图2可知,在超滤过程中,呈现出两阶段衰减过程:在0~40 mL这一阶段,由于溶液中的EPS成分快速吸附堆积在膜面和膜孔隙中,使膜通量迅速衰减,为快速衰减阶段;40~150 mL这一阶段称为假稳态阶段,经过第一阶段的快速堆积,膜面形成了稳定的滤饼层,因此膜通量开始趋于稳定[13]。实验通过在EPS溶液中加入不同浓度的Fe3+、Al3+、Ca2+、Mg2+,考察了共混溶液对超滤膜的膜污染情况,可以看出这些金属离子都会对膜通量产生一定程度的影响。
V/mL

V/mL
V/mL
V/mL
如图2所示。从三价金属离子Fe3+、Al3+组来看,空白EPS的初始归一化通量为0.258,稳定归一化通量为0.042;添加Fe3+20与30 mg·L-1的初始归一化通量分别为0.418、0.356,稳定归一化通量为0.079、0.049;添加Al3+20与30 mg·L-1的初始归一化通量分别为0.607、0.783,稳定归一化通量为0.129、0.115。在快速衰减阶段中,两组的初始膜通量都要比空白组大,在Al3+组尤为明显,这是因为Fe3+、Al3+离子在溶液中具有混凝作用,使胶粒聚集,在初期减少了在膜面和膜孔隙的快速堆积;在第二阶段三组趋势则类似,且Fe3+及Al3+组的稳定归一化通量都有所升高,膜污染都有减轻,这说明三价Fe、Al离子都具有减轻膜污染的作用,Al的作用尤其明显,推测这是因为在Fe3+作用下生成的螯合物相比在Al3+作用下生成的配合物稳定性更强,从而在快速衰减阶段的堆积作用也更强。值得注意的是在20 mg·L-1Fe3+的条件下的归一化通量衰减曲线,第一阶段曲线与30 mg·L-1Fe3+接近,而在第二阶段则与空白EPS接近,这能是因为20 mg·L-1Fe3+条件下和30 mg·L-1Fe3+条件下,初期都是混凝聚集的物质在膜面堆积,而在第二阶段由于Fe3+投加量的差异,20 mg·L-1Fe3+条件下尚有较多未聚集物质,因此与空白EPS的衰减曲线较为接近。
从二价金属离子Ca2+、Mg2+组可知,添加20和30 mg·L-1Ca2+时,初始归一化通量值分别为0.278和0.216,稳定归一化通量为0.052、0.040;在添加20 mg·L-1和30 mg·L-1Mg2+时,初始归一化通量值分别为0.230和0.237,稳定归一化通量为0.046、0.047。和Ca2+相比,Mg2+在两个浓度条件下都与空白EPS的差别不大,说明相对Ca2+而言Mg2+对膜污染的影响很小。有研究发现,腐殖酸中的羟基有较强的螯合反应能力,能与Ca2+产生具有复杂结构的高分子聚合物[13],海藻酸钠也能和钙离子形成“蛋盒”结构[15]。在不同Ca2+浓度下形成的聚合物胶粒粒径不同,对膜污染的影响也不同。从图2可知在Ca2+浓度为30 mg·L-1膜污染较为严重,而在Ca2+浓度为20 mg·L-1的情况下,可能形成的胶粒的粒径与切割分子量为10 000的超滤膜孔径相当,容易形成完全堵塞,随后使得这些高分子物质吸附在膜表面形成渗透性较高的滤饼层,膜孔内部污染相对减缓。

表1 添加了Fe3+、Al3+、Ca2+、Mg2+的EPS溶液两阶段过滤用时Tab.1 Two-stage filtration of EPS solution with Fe3+,Al3+,Ca2+,Mg2+ added
结合图2和表1,可知在二价金属离子Ca2+、Mg2+组中Mg2+对膜片造成的污染比Ca2+严重。4组不同的离子浓度中,20 mg·L-1Mg2+造成的污染最重,20 mg·L-1Ca2+对膜片的污染最轻。随着Ca2+浓度的增加,膜污染是加剧的;对比空白组,Mg2+的加入加剧了膜污染。可能因为Ca2+的加入对生物絮凝起了一定的强化作用。而Fe3+、Al3+组中Fe3+对膜片造成的污染比Al3+严重,且随浓度的增加,Al3+造成的污染逐渐减轻,而Fe3+造成的污染则是逐渐严重。4组不同的离子浓度中,30 mg·L-1Fe3+造成的污染最重,30 mg·L-1Al3+对膜片的污染最轻。与空白组相比,三价Fe3+、Al3+的加入都对膜污染有不同程度的减轻。推测是由于Fe、Al与EPS中的成分发生螯合作用,通过阳离子架桥作用等,增强絮体的强度,在膜面上形成更多的多孔饼层来减轻膜污染。
有研究显示,Ca2+和Al3+对EPS的膜污染有缓解的情况[8];Arabi[9]认为Mg2+浓度越高,絮凝体的体积越大,越加剧膜污染;而Mehrnia等[10]研究认为Fe3+吸附EPS,通过架桥作用减轻膜污染。其中Al3+和Fe3+、Mg2+情况本研究结果一致,而当Ca2+浓度为20 mg·L-1对超滤过程影响较小,但也加剧了膜污染。
2.3 过滤模型拟合
采用hermia经典模型对各组膜通量进行拟合,所得R2值如表2所示。R2的值越大,说明拟合程度越好。对于未添加金属离子的EPS溶液,以及添加了不同浓度金属离子的EPS溶液拟合结果都符合标准堵塞>滤饼层堵塞>中间堵塞>完全堵塞,表明主要以标准堵塞模型为主。
加入二价金属离子Ca2+、Mg2+后,4种模型的拟合程度均有所增加,但仍以标准堵塞模型为主。其中加入Ca2+后,随着离子浓度的增大,四种模型的拟合程度均有所增加,但仍标准堵塞模型的拟合程度最好。在加入Mg2+后,完全堵塞模型拟合程度最低,标准堵塞模型拟合程度最高,R2分别为0.998 2和0.997 6。
在加入三价金属离子Fe3+、Al3+后,标准堵塞模型拟合度最好,其它模型的拟合程度均较差。由于低相对分子质量有机物可能会粘附于膜孔内部,导致标准堵塞,而高相对分子质量的有机物可能会保留在膜表面形成滤饼层,由此推测在投加Ca2+、Mg2+离子后,溶液内的有机物分子量的分布变得更宽,而在投加Fe3+、Al3+,溶液内的低相对分子质量有机物增多。
2.4 EPS成分分析
EPS作为细胞代谢过程中的产物,其产生定会受酶活性的影响。金属离子的存在也会对酶的活性产生一定影响,所以必然会对EPS的各组分产生影响[16]。有研究显示,金属铁对蛋白质污染的影响是显著的,并且随着Fe3+的浓度的增加膜污染先加重后减小,Fe3+浓度达到20 mg·L-1时,膜污染最为严重[17]。图3为原液及滤液EPS中各组分的浓度变化,由于A、B两组的不同在于提取EPS后加入的盐离子不同,从图中可以看出,超滤膜对蛋白质的截留作用最强,与未添加离子的EPS溶液相比,蛋白质的截留率Fe3+、Al3+分别提高了约13%,8%,而Ca2+、Mg2+组的蛋白质截留率都下降了,说明加入的Fe3+或Al3+可能主要与蛋白质相互作用,Fe3+或Al3+与蛋白质或多糖上的官能团形成螯合作用,同时絮凝作用使蛋白质和多糖相互聚集,从而提高截留率,而Ca2+、Mg2+与蛋白质多糖虽然产生螯合作用,但并没有絮凝作用。此外,有研究报道[18],即使溶液中蛋白质等大分子物质的浓度较低(0.001~0.01 g·L-1),膜面产生的吸附作用依然可以使通量下降达37%,吸附是也是造成污染的主要原因之一,这表明在超滤膜污染中蛋白质是主要因素之一。值得关注的是,加入Fe3+、Al3+后超滤膜对于蛋白质和多糖的截留率有所提高,但是膜的通量却是加入离子后的溶液更高,这可能是有机物截留在滤饼层中,而相对松散的滤饼层有利于降低过滤阻力,所以通量相对较高。
3 结论
藻菌共生体对养殖废水中COD及氮磷有一定的处理效果,在10日内COD去除率达到75.34%,氨氮去除率达到74.71%,总氮的去除率达到75.82%,磷酸盐去除率达到61.62%,总磷去除率达到59.79%。本次实验通过将藻菌共生体分泌的EPS进行提取,分别加入20 mg·L-1,30 mg·L-1的Fe3+、Al3+、Ca2+、Mg2+的金属离子后分别进行超滤实验,来探究这四种离子对膜污染的影响。结果显示膜通量衰减情况表现出典型的两阶段式,即快速衰减阶段和假稳态阶段。
本文探究了二价金属离子Ca2+、Mg2+、三价金属离子Fe3+、Al3+对胞外聚合物(EPS)在超滤中的膜污染机理,通过数据分析可以看到,在超滤过程中,Mg2+的加入,在一定程度上减小了膜通量,增强了膜污染;Ca2+对超滤过程影响很小,但也在一定程度上增强了膜污染;Fe3+和Al3+的加入则对膜通量都有一定程度的提高,减轻了膜污染。在超滤过程中,初始通量和稳定通量都得到了一定程度的提高,而且Fe3+对膜通量提高较小,Al3+对膜通量的提高较大。
总体来看,二价、三价金属离子加入后污染模型拟合程度都符合标准堵塞>滤饼层堵塞>中间堵塞>完全堵塞。其中二价金属离子的加入对膜污染有不同程度的加剧,而三价金属离子的加入则对膜通量有一定程度的提高,膜污染得到了减轻。通过超滤前后EPS主要成分进行分析,猜测造成膜污染的主要污染物是蛋白质,加入的金属离子则主要与蛋白质相互作用从而对膜污染产生影响。

