血细胞比对时校准系数调整的方法研究
汪秀红,谭启友
广西壮族自治区柳州市柳城县妇幼保健院检验科,广西柳州 545299
目前本院实验室有2台不同品牌的血细胞分析仪(希森美康500I、迈瑞5390),尽管仪器的参考区间相同[1-2],由于不同血细胞分析仪的检验原理和方法不尽相同,导致同一标本在不同仪器上分析可能出现测定值的偏差,给评估和结果解释及临床动态监测带来困难。为保证不同血细胞分析仪检验结果的准确性及可靠性,应对本实验室的不同血细胞分析仪检验结果进行比对[3],以评价检验参数——白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(Hb)、红细胞平均体积(MCV)、血小板计数(PLT)的准确性[4]和一致性[5]。参照美国临床实验室改进修正案(CLIA′88)[6]能力比对检验质量的要求,以其标准的1/2作为可接受误差来判断2台或2台以上血细胞分析仪检验结果的可比性[7]。本研究对血细胞比对时校准系数调整的方法进行了探索,现报道如下。
1 资料与方法
1.1一般资料 采用5份前来就诊患者的新鲜EDTA-K2抗凝全血。标本1是满足WBC、RBC、Hb、MCV、PLT低值要求的标本(低值标本),标本2是满足WBC、RBC、Hb、MCV、PLT高值要求的标本(高值标本),标本3、4、5是满足WBC、RBC、Hb、MCV、PLT中值要求的标本(中值标本)。高、中、低值的划分如下:WBC,<4×109/L为低值,(4~10)×109/L为中值,>10×109/L为高值;RBC,<3.5×1012/L为低值,(3.5~5.5)×1012/L为中值,>5.5×1012/L为高值;Hb,<110 g/L为低值,110~160 g/L为中值,>160 g/L为高值;PLT,<100×109/L为低值,(100~300)×109/L为中值,>300×109/L为高值;MCV,<80 fL为低值,80~100 fL为中值,>100 fL为高值。
1.2仪器及试剂 血细胞分析仪迈瑞5390、希森美康500I,均使用配套试剂。
1.3方法 采用全自动进样模式进行血常规检测,以参加广西临检中心成绩合格的血细胞分析仪(希森美康血细胞分析仪500I)作为基准仪器(靶机)进行血常规各项参数比对,比对标准按CLIA′88标准进行。每份标本在每台仪器检测两次,取两次检查结果的均值进行比对。比对结果超出范围的项目需要进行人工校准[8],则需要计算出与目标值的相对偏差(偏倚度),计算出仪器新的校准系数,录入新校准系数后重新检测比对,当测定结果与靶值的偏差在1%~2%时可以将此标本进行5~10次检测,计算均值,用均值来调整校准系数,以获得偏差最小的系数为最佳调整系数。相对偏差=(需比对仪器测定值-基准仪器测定值)/基准仪器测定值,新校准系数=旧系数±相对偏差%,仪器的旧校准系数可以在仪器人工校准界面读取,迈瑞5390系数调整的允许范围是75%~125%。
2 结 果
2.12台仪器5份标本WBC、RBC、Hb、MCV、PLT检测结果比对 WBC在5份标本的偏差绝对值均>7.5,结论为不合格;RBC在5份标本的偏差绝对值均>3.0,结论为不合格;PLT在标本1、2、4的偏差绝对值均>12.5,结论为不合格;MCV在5份标本的偏差绝对值均<3.0,结论为合格。WBC、RBC、PLT检测结果超出允许误差,需要进行人工校准。见表1。

表1 2台仪器5份标本WBC、RBC、Hb、MCV、PLT检测结果比对
2.2失控项目的第一次新校准系数 以标本1(低值标本)、标本2(高值标本)、标本5(中值标本)进行调整,计算失控的WBC、RBC、PLT的第一次新校准系数。见表2。
2.3根据第一次新校准系数重新检测比对
2.3.1WBC参数 从表3中可以看出,用标本2(高值标本)计算的第一次WBC新校准系数录入后5份标本结果偏差绝对值均>7.5,结论为不合格。从表4中可以看出,用标本5(中值标本)计算的第一次WBC新校准系数录入后5份标本结果偏差绝对值均>7.5,结论为不合格。从表5中可以看出,用标本1(低值标本)计算的第一次WBC新校准系数录入后,标本1、4、5测定结果的偏差绝对值>7.5,标本2、3测定结果的偏差绝对值<7.5,结论为不合格。WBC在用标本1(低值标本)计算的新校准系数录入后检测的结果更靠近靶值。WBC还需继续进行人工校准。
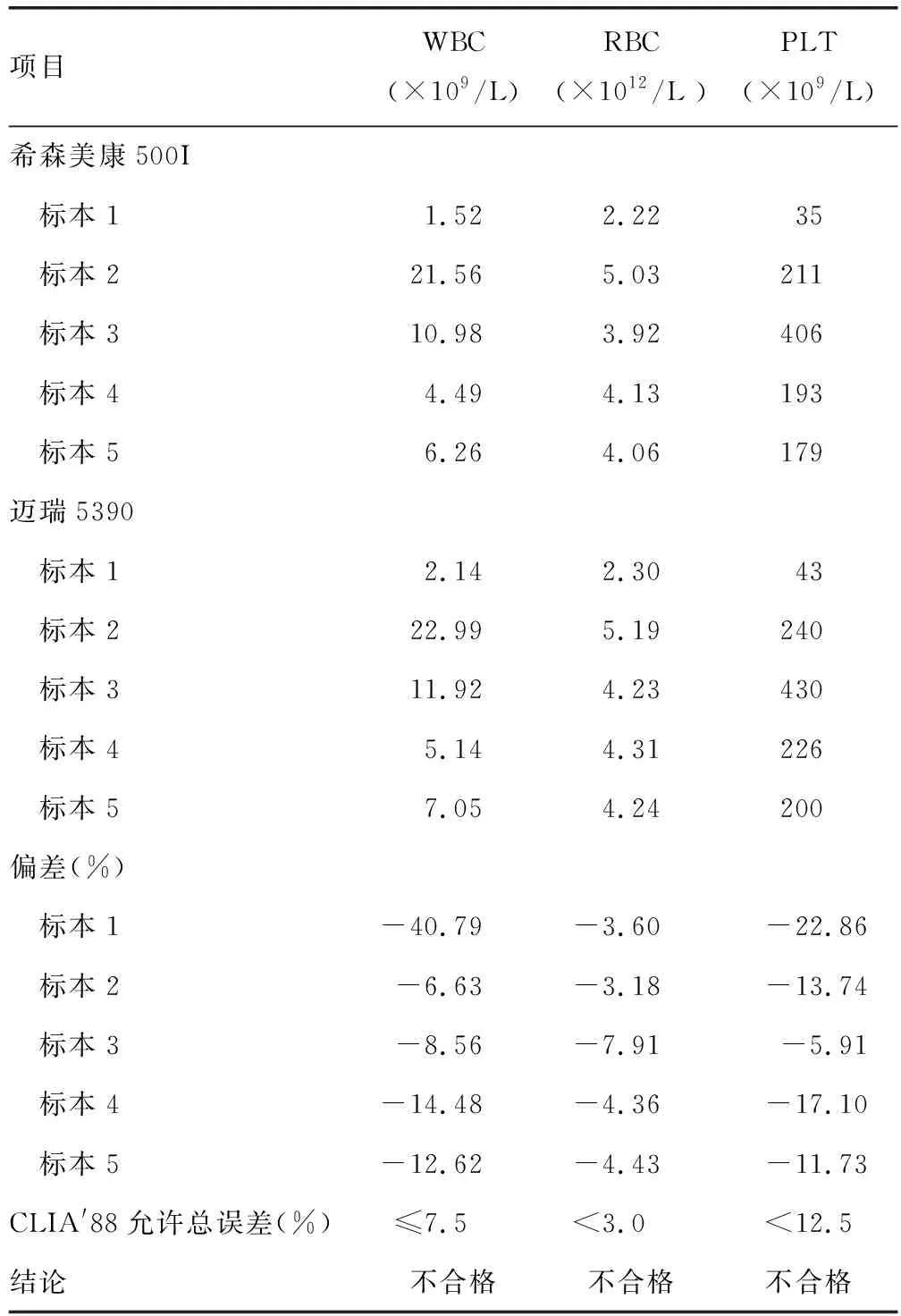
表3 以标本2(高值标本)计算的第一次新校准系数调整后2台仪器5份标本WBC、RBC、PLT检测结果的比对
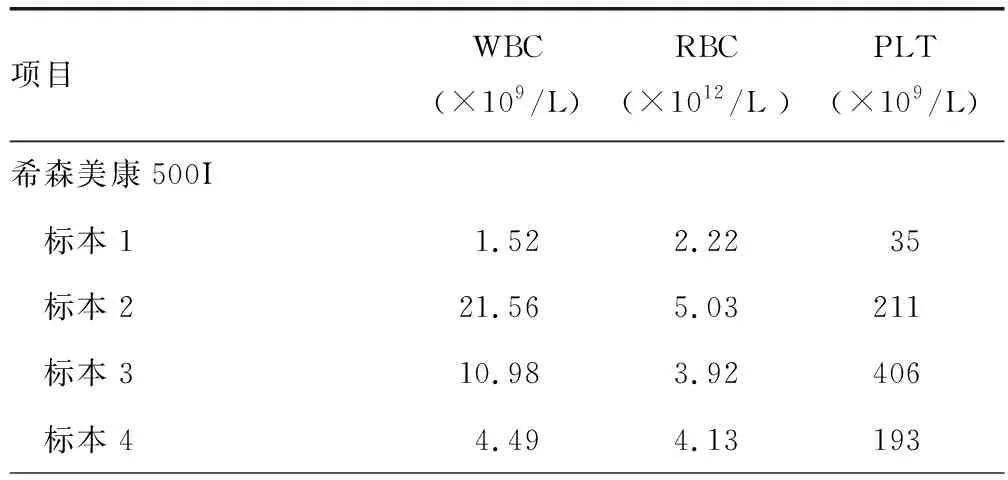
表4 以标本5(中值标本)计算的第一次新校准系数调整后2台仪器5份标本WBC、RBC、PLT检测结果的比对

表5 以标本1(低值标本)计算的第一次新校准系数调整后2台仪器5份标本WBC、RBC、PLT检测结果的比对
2.3.2RBC参数 从表3中可以看出,用标本2(高值标本)计算的第一次RBC新校准系数录入后,5份标本结果偏差绝对值均>3.0,结论为不合格。从表4中可以看出,用标本5(中值标本)计算的第一次RBC新校准系数录入后,有5份标本结果偏差绝对值>3.0,结论为不合格。从表5中可以看出,用标本1(低值标本)计算的第一次RBC新校准系数录入后,标本1~5测得的结果偏差为-4.50%、-3.58%、-7.40%、-4.36%、-2.96%,绝对值均接近3.0,结论为不合格。RBC用标本5(中值标本)计算出的新校准系数录入后检测的结果总体更靠近靶值。RBC还需继续进行人工校准。
2.3.3PLT参数 从表3中可以看出,用标本2(高值标本)计算的第一次PLT新校准系数录入后,有2份标本结果偏差绝对值<12.5,3份标本结果偏差绝对值>12.5,结论为不合格。从表4中可以看出,用标本5(中值标本)计算的第一次PLT新校准系数录入后,标本1~5测定结果的偏差绝对值<12.5,结论为合格。从表5中可以看出,用标本1(低值标本)计算的第一次PLT新校准系数录入后,标本1、2测定结果的偏差绝对值>12.5,标本3、4、5测定结果的偏差绝对值<12.5,结论为不合格。PLT用标本5(中值标本)计算出的新校准系数录入后检测的结果更靠近靶值,结果在控,保留此校准参数。PLT不需继续进行人工校准。
2.4多次校准系数调整后2台仪器5份标本WBC、RBC、Hb、MCV、PLT重新检测的结果比对 在第一次新校准系数的基础上进行测试后,以偏离最远的那个浓度的标本再次进行相应校准系数调整。经过反复调整,当WBC的校准系数调整到104.40、RBC的校准系数调整到100.20、PLT的校准系数调整到103.03时进行5份标本检测。结果显示:WBC测定结果的偏差绝对值均≤7.5,结论合格;RBC测定结果的偏差绝对值均≤3.0,结论为合格;Hb的测定结果的偏差绝对值均≤3.5,结论为合格;MCV测定结果的偏差绝对值均≤3.0,结论为合格;PLT测定结果的偏差绝对值均<12.5,结论为合格。见表6。

表6 多次校准系数调整后2台仪器5份标本WBC、RBC、Hb、MCV、PLT检测结果的比对
3 讨 论
大部分血细胞分析仪检测WBC的原理多采用电阻抗法、化学染色法、荧光染色法,但不同血细胞分析仪的检验原理和方法不尽相同,其检验结果存在一定偏差。本实验室有2种不同品牌的血细胞分析仪,由于品牌和型号的不同将会导致同一标本在不同仪器上分析可能出现测定值的偏差,给评估和结果解释及临床动态监测带来困难。为保证不同血细胞分析仪检验结果的准确性及可靠性,应对同一实验室的不同血细胞分析仪检验结果进行比对,以评价检验项目WBC、RBC、Hb、HCT、PLT的准确性和一致性。参照CLIA′88的要求对本实验室迈瑞5390及希森美康500I两种不同品牌的血细胞分析仪进行比对,用5份有不同的高、低、中值标本进行2台仪器测试,确定在控的项目,已经在控的项目不需要进行系数校准,对不在控的项目要计算出相对偏倚度(偏差),通过偏倚度(偏差)来进行仪器校准[9]。本试验5份标本比对后Hb、MCV均在控,WBC、Hb、PLT不在控,计算出WBC、Hb、PLT不同水平的偏倚度及新校准系数,录入仪器后重新检测。以标本2(高值标本)计算的新系数后录入仪器后重新测定得到的结果,WBC、Hb、PLT的偏倚度均超出CLIA′88的允许总误差,因此不能接受用高值标本计算的校准系数;以标本5(中值标本)计算偏差进行调整仪器系数后重新检测标本,PLT的偏倚度在控,可以接受此次PLT的校准系数;WBC、RBC的结果靠近靶值但仍然失控因此不能完全接受由中值标本计算的校准系数;以标本1(低值标本)计算的新系数后录入仪器后重新测定得到WBC、RBC的结果靠近靶值,但仍然失控因此不能接受由低值标本计算的校准系数。通过观察3组数据中标本1(低值标本)计算出的校准系数,WBC检测结果更靠近靶值,因此暂时接受此系数并且在此基础上再次进行仪器的校准系数调整,以偏离最远的那个浓度的标本进行相应校准系数调整,针对中值的失控则选取5号标本进行计算;RBC则以中值标本计算的校准系数为基础进行下一步的调整。最后得到WBC的校准系数为104.40、RBC的校准系数为100.20、PLT 的校准系数为103.03时,WBC、RBC、PLT的检测结果均在允许范围内[10]。
以上说明,针对不合格的血细胞分析仪进行校准系数调整时可以用高、中、低值标本进行初次的校准系数调整,接受最佳的校准系数(即失控最少的);再以失控较多的水平进行二次调整;最后重新进行高、中、低值标本的测试,观察结果是否在目标偏倚度内,偏倚度越接近0越好,如果全部结果都在控则接受此次的系数调整;在没有低值标本的情况下各项参数的校准可以先以中值进行比对,计算出相对偏差及新校准系数录入血细胞分析仪,再进行第2次比对;逐次调整系数。每个项目的调整都以倾向于靶值的校准系数为基础进行下一步调整;但是也不会立即达到最佳系数状态,还要进行2次、3次或多次的中值标本调试,才能将失控的仪器调整到在控状态,使比对仪器检验结果具有较好的可比性、准确性、一致性[11]。
在工作中血细胞分析仪每年需要进行两次校准[12]及比对,以确保及时发现和调整系统误差,确保检验科室内各类型血细胞分析仪的可比性;在更换试剂批号后要观察室内质控结果记录,变异系数越小说明其性能稳定精密度[13]越好;经过调整的校准系数[14]一般不再变更,除非比对不合格需要重新校准。实验室有多台血细胞分析仪时应选择一台性能较好的仪器作为基准仪器,其条件需满足:(1)使用原厂配套试剂;(2)每年用配套校准品进行校准;(3)规范开展室内质控[15],参加室间质评成绩优良。以此台基准仪器为标准开展不同厂家血细胞分析仪和不同型号血细胞分析仪的比对和校准,使所有仪器的检测结果非常接近,可解决仪器的可比性问题。

