肉汤纸片洗脱法和全自动药敏系统应用于黏菌素药敏试验的方法学评价*
周春妹,黄嘉仪,黄声雷,马 艳,单玉璋,沈佳瑾,王蓓丽,潘柏申,郭 玮
复旦大学附属中山医院检验科,上海 200032
黏菌素是从多黏杆菌中分离的一种多肽类杀菌剂,其杀菌机制是通过分子中的聚阳离子环与革兰阴性杆菌细胞膜上的磷酸基结合,使细胞膜通透性增加,从而导致细胞内的嘌呤、嘧啶等小分子物质外漏,最终使细菌膨胀、溶解、死亡[1]。由于存在肾毒性和神经毒性等严重药物不良反应,黏菌素一度在临床上被停止使用[2]。但近几年随着多重耐药甚至泛耐药的革兰阴性杆菌感染比例不断升高,如何遏制耐药革兰阴性菌的传播并合理使用抗菌药物提高抗感染治疗成功率成为临床亟须解决的问题[3]。黏菌素类抗菌药物作为少数几种对泛耐药的革兰阴性杆菌保持较好体外抗菌活性的药物之一,在2017年被国家食品药品监督管理总局批准重新用于抗感染治疗[4]。由于黏菌素中阳性离子团与琼脂的静电相互作用使其不易溶于琼脂,难以在琼脂内扩散,导致扩散方法的准确性较差[5],因此2016年欧洲抗菌药物敏感性试验委员会(EUCAST)和美国临床和实验室标准协会(CLSI)联合声明不推荐使用琼脂稀释法、纸片扩散法和浓度梯度扩散法用于常规检测黏菌素类药物的敏感性,并建议临床实验室使用微量肉汤稀释法(BMD)。为了减少实验室成本和方便操作,2020年CLSI又推出了黏菌素肉汤纸片洗脱法(CBDE)作为检测革兰阴性杆菌对黏菌素敏感性的方法。本研究评估了CBDE和自动化药敏系统与参考方法BMD检测革兰阴性杆菌对黏菌素药敏结果的一致性,现将结果报道如下。
1 材料与方法
1.1菌株来源 收集2021年1-6月本院临床标本分离的非重复黏菌素耐药菌株和随机选取等量的敏感菌株共133株革兰阴性杆菌,其中大肠埃希菌67株、肺炎克雷伯菌66株。本研究获得本院医学伦理委员会批准。
1.2仪器与试剂 基质辅助激光解析电离飞行时间质谱仪、Vitek CompactⅡ全自动药敏分析仪和AST-GN335药敏卡购自法国生物梅里埃公司;Phoenix M50全自动药敏分析系统及Phoenix NMIC-413药敏卡购自美国BD公司;黏菌素纸片(10微克/片)、阳离子调节肉汤(CAMHB)、BMD-96孔板(测定浓度为0.06~32 mg/L)均购自温州康泰生物科技有限公司。药敏试验质控菌株为大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853和大肠埃希菌MCR-1阳性NCTC13846,以上菌株均购自上海市临床检验中心。
1.3方法
1.3.1CBDE和BMD CBDE根据 CLSI M100-S30文件推荐操作进行。具体做法如下:将CAMHB试管和黏菌素纸片恢复至室温。在含有10 mL CAMHB试管中加入不同数量的黏菌素纸片,以制作含0 μg/mL(不放纸片)、1 μg/mL(加1个纸片)、2 μg/mL(加2个纸片)和4 μg/mL(加4个纸片)最终黏菌素浓度的肉汤。将加入纸片的试管在室温下轻轻漩涡振荡洗脱30~60 min。在10 mL管中加入50 μL 0.5麦氏浊度的菌悬液,使最终接种浓度为7.5×105CFU/mL。用10 μL接种环取原始接种物至血平板上纯培养。加入纸片的CAMHB试管在低速下短暂涡旋,混匀,防止黏菌素黏附于盖子或液面上方的玻璃表面。轻轻松开盖子,将试管和平板在35 ℃的环境中孵育16~20 h后,记录最低抑菌浓度(MIC)。BMD具体操作如下:黏菌素微量肉汤稀释板和CAMHB试管恢复至室温。200 μL CAMHB试管中加入10 μL的0.5麦氏浊度受试菌悬液,然后取100 μL加入黏菌素微量肉汤稀释板孔内。在35 ℃的环境中孵育16~20 h后,记录MIC。黏菌素的判断标准根据EUCAST的折点表10.0版进行解释,即MIC≤2 mg/L判为敏感,MIC >2 mg/L判为耐药。为了保证测试菌的同质性,同一株待测菌的所有测试均在同一天进行。
1.3.2细菌鉴定和全自动药物敏感性试验 使用基质辅助激光解析电离飞行时间质谱仪将分离菌鉴定到种。分别使用Vitek CompactⅡ全自动药敏分析仪及AST-GN335药敏卡(黏菌素检测浓度为0.5~16 mg/L)和Phoenix M50全自动药敏分析系统及Phoenix NMIC-413药敏卡(黏菌素检测浓度为1~4 mg/L)进行黏菌素的药敏试验。具体操作步骤参考厂家的说明书。
1.4观察指标 根据我国2018年发布的WS/T639—2018《抗菌药物敏感性试验的技术要求》,以BMD为本研究参考方法,评估方法学的指标如下:(1)基本一致性(EA)。EA是指被评估方法检测MIC与BMD的MIC值之间相差±1个稀释度的菌株百分比。(2)分类一致性(CA)。CA是指按照药物敏感性折点标准判读为敏感和耐药一致的菌株百分比。(3)重大误差(ME)。ME是指菌株在同一折点判断标准下,被评估方法将敏感判定为耐药的百分比(即假耐药率,分母是参考方法检测出的敏感菌株数)。(4)非常重大误差(VME)。VME是指菌株在同一折点判断标准下,被评估方法将耐药判定为敏感的百分比(即假敏感率,分母是参考方法检测出的耐药菌株数)。当CA和EA均≥90%且所有耐药菌株的VME以及所有敏感菌株的ME均≤3%时,作为评估方法的可接受标准。
1.5统计学处理 采用SPSS 23.0软件进行数据处理。计数资料以例数或百分率表示,对3种方法检测结果与BMD结果的一致性分析使用Kappa检验。以P<0.05为差异有统计学意义。
2 结 果
2.1BMD检测黏菌素的结果 BMD检测133株菌株对黏菌素的耐药率为39.8%(53/133),MIC50为1 μg/mL,MIC90为64 μg/mL。其中大肠埃希菌和肺炎克雷伯菌对黏菌素的耐药率分别为10.4%(7/67)和69.7%(46/66)。BMD检测黏菌素MIC的分布见表1。
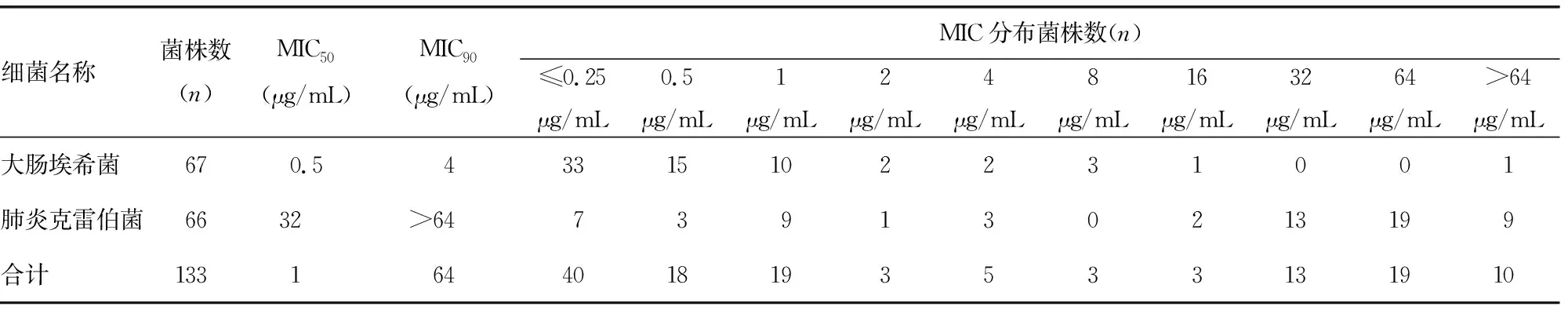
表1 BMD检测黏菌素MIC的分布
2.2CBDE检测黏菌素的结果以及与BMD结果比较 使用CBDE检测,133株菌株对黏菌素的耐药率为39.8%(53/133),MIC50为≤1 μg/mL,MIC90为>4 μg/mL。其中大肠埃希菌和肺炎克雷伯菌对黏菌素的耐药率分别为10.4%(7/67)和69.7%(46/66)。CBDE和BMD结果比较:CBDE检测大肠埃希菌和肺炎克雷伯菌总体的EA为97.7%,CA为100.0%,ME和VME均为0.0%。见表2。
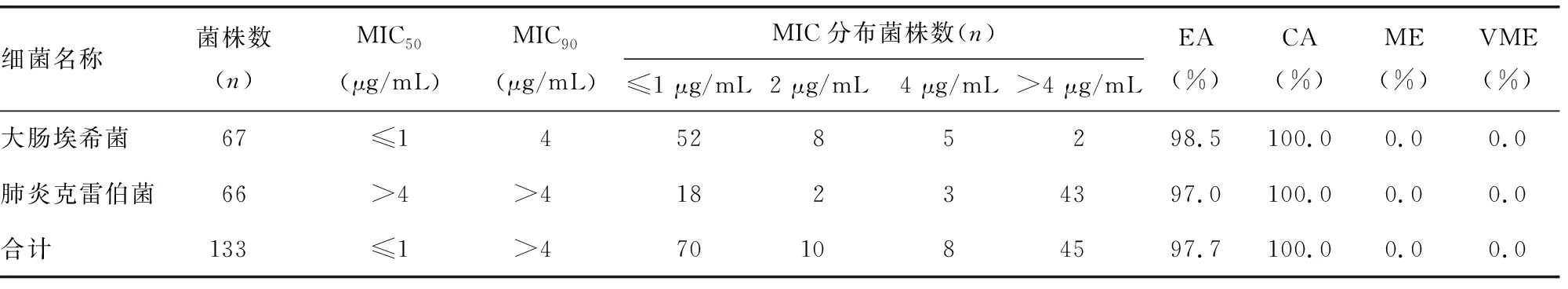
表2 CBDE检测黏菌素的结果及与BMD比较
2.3Phoenix NMIC-413检测黏菌素的结果以及与BMD结果比较 使用Phoenix NMIC-413药敏卡检测,133株菌株对黏菌素的耐药率为34.6%(46/133),MIC50为≤1 μg/mL,MIC90为>4 μg/mL。其中大肠埃希菌和肺炎克雷伯菌对黏菌素的耐药率分别为7.5%(5/67)和62.1%(41/66)。与BMD结果比较,NMIC-413药敏卡检测大肠埃希菌和肺炎克雷伯菌总体的EA和CA均为94.7%,ME为0.0%,VME为13.2%。见表3。
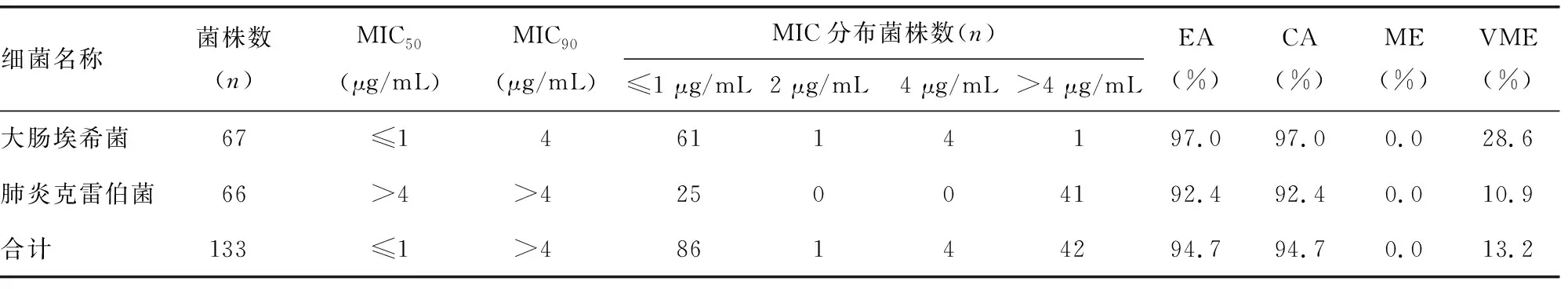
表3 PhoenixNMIC-413检测黏菌素的结果及与BMD比较
2.4Vitek CompactⅡ-GN335检测黏菌素的结果以及与BMD结果比较 使用Vitek CompactⅡ-GN335药敏卡检测,133株菌株对黏菌素的耐药率为35.3%(47/133),MIC50为≤0.5 μg/mL,MIC90为≥16.0 μg/mL。其中大肠埃希菌和肺炎克雷伯菌对黏菌素的耐药率分别为8.9%(6/67)和62.1%(41/66)。与BMD结果比较,Vitek CompactⅡ-GN335药敏卡检测大肠埃希菌和肺炎克雷伯菌总体的EA和CA均为95.5%,ME为0.0%,VME为11.3%。见表4。
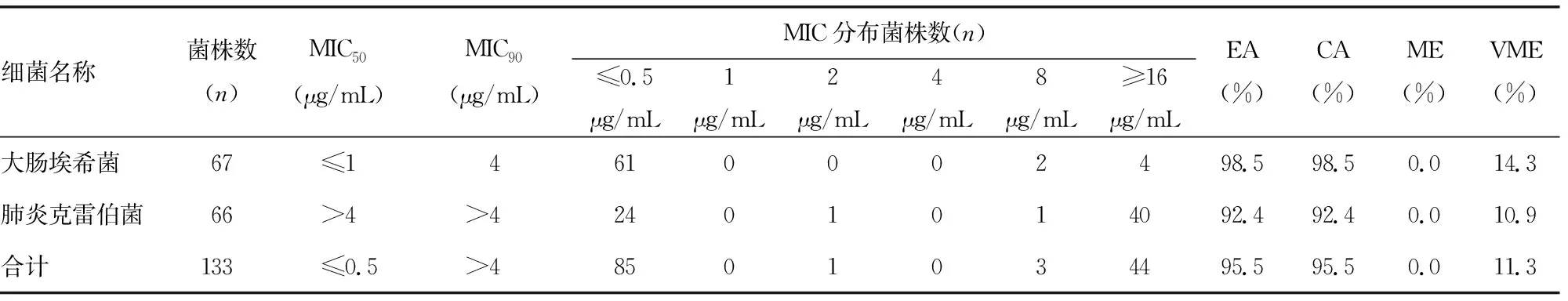
表4 VitekCompactⅡ-GN335检测黏菌素的结果及与BMD比较
2.5一致性分析 CBDE、Phoenix NMIC-413和Vitek CompactⅡ-GN335检测大肠埃希菌和肺炎克雷伯菌对黏菌素敏感性的结果与BMD的检测一致性分析显示,Kappa值分别为1.000(P=0.000 1)、0.888(P=0.000 1)和0.904(P=0.000 1)。
3 讨 论
2017年世界卫生组织把耐碳青霉烯类的革兰阴性菌列为全球耐药的紧急威胁,并将研发针对性抗菌药物列为最高优先等级。黏菌素作为“老药新用”的代表已成为目前临床对抗耐碳青霉烯类的革兰阴性菌重要“武器”之一[6]。随着黏菌素在临床的使用量不断增加,其耐药率也逐年上升[7],这要求微生物实验室需提供快速并准确的黏菌素药敏结果以满足临床合理使用抗菌药物的要求。为了应对这种情况,EUCAST/CLSI指南均添加了黏菌素类的药敏检测方法和对应判读折点,且每年都进行更新。EUCAST和CLSI目前首选推荐使用BMD进行多黏菌素B和黏菌素的药敏试验。但是由于BMD相较于纸片法以及商品化全自动药敏系统,操作烦琐且成本较高,限制了其在微生物实验室常规工作中的广泛使用。国外学者HUMPHRIES等[8]在2019年对CBDE进行了评估,共检测了498株革兰阴性杆菌(包括肠杆菌目细菌270株、铜绿假单胞菌122株和鲍曼不动杆菌106株),总体上94.4%CBDE的MIC值与参考方法BMD的MIC值基本一致,97.9%CBDE的判读结果与参考方法BMD的判读结果分类一致;498株细菌CBDE检测的VME和ME分别为3.2%和0.9%,其中肠杆菌目细菌CBDE检测的CA为98.6%、VME为2.5%、ME为0%,铜绿假单胞菌检测CBDE的CA为99.3%、VME为0%、ME为0.7%,不动杆菌检测CBDE的CA为93.1%、VME为5.6%、ME为3.3%。正是基于这个研究数据,2020年CLSI批准了CBDE成为检测肠杆菌目细菌和铜绿假单胞菌的黏菌素体外敏感性的试验方法,但是目前国内有关CBDE的研究报道较少。
本研究为了验证CBDE方法的准确性,共检测了133株肠杆菌目细菌。研究结果发现,97.7%CBDE的MIC值和参考方法BMD的MIC值基本一致,只有3株细菌(1株大肠埃希菌和2株肺炎克雷伯菌)的两个方法的MIC值相差大于1个稀释度。在判读结果分类一致性上,CBDE的判读结果与参考方法BMD的结果100.0%相同。国内学者黄丽等[9]对CBDE的研究结果显示,CBDE 检测肠杆菌目细菌对黏菌素敏感性的 EA为90.3%、CA为99.6%、ME为0.4%、VME为0%,CBDE与BMD的结果具有较高的一致性,这和本研究结论相同,并验证了CLSI的推荐。
2020年《协和医学杂志》刊登了《多黏菌素药物敏感性检测及临床解读专家共识》,该共识不常规推荐自动化药敏检测仪器用于黏菌素的体外敏感性试验,自动化药敏检测仪器只有经过临床实验室性能验证后,满足临床报告需求时才可以使用。目前自动化药敏检测仪器是否能用于黏菌素的检测还存在一些争议。国内ZHU等[10]研究结果显示,使用Phoenix NMIC-413药敏卡检测136株大肠埃希菌和26株肺炎克雷伯菌对黏菌素的药物敏感性,结果显示CA和EA均为100%,ME和VME均为0%。该研究认为NMIC-413药敏卡可作为临床实验室检测黏菌素敏感性的方法,而使用Vitek CompactⅡ-GN335药敏卡对这些菌株进行黏菌素敏感性检测结果显示与BMD一致性较差,CA分别为89.7%和63.0%,且有较高的VME,分别为26.3%和0%,因此Vitek CompactⅡ-GN335药敏卡不能作为临床实验室检测黏菌素药敏的方法。然而PFENNIGWERTH等[11]报道,使用Phoenix检测206株肺炎克雷伯菌对黏菌素的敏感性,结果显示存在较高的VME(8%),提示Phoenix仪器法不能为实验室提供准确的黏菌素药敏数据。为了更好地了解微生物实验室使用的自动化药敏检测仪器检测黏菌素药敏结果的准确性,本次试验分别评估了Phoenix NMIC-413药敏卡和Vitek CompactⅡ-GN335药敏卡,研究结果显示两种商品化的药敏卡与BMD比较,CA和EA均超过95.0%,与参考方法的一致性较好;但是两种商品化的药敏卡检测结果存在一定假敏感率,VME分别为13.2%和11.3%。本研究和刘晓妤等[12]的研究结果相似。本研究存在一些局限性:首先,本次收集的肠杆菌目细菌种类较单一,仅仅包含了大肠埃希菌和肺炎克雷伯菌;其次,CLSI推荐CBDE也可以检测铜绿假单胞菌对黏菌素的敏感性,但本研究没有纳入铜绿假单胞菌进行研究。本研究团队将会在后续的研究工作中扩大测试细菌的种类和数量。
综上所述,CBDE由于其较低的成本、简便的操作和准确的结果可以作为临床微生物实验室检测肠杆菌目细菌对黏菌素敏感性的可靠试验方法。自动化药敏检测仪器检测黏菌素体外药敏的结果有一定价值,但对于那些由自动化药敏检测仪器判读为敏感的菌株仍需使用BMD进行复核。

