利血平灌胃诱导大鼠低血压模型的构建
张璇 王慈 张泽宇 张培培 任秋安 王贤良 毛静远
摘要:目的 確定利血平诱导大鼠低血压模型的适合剂量与时间。方法 60只雄性Wistar大鼠按照体重及收缩压水平进行分层,然后每层再按照随机数字表法分为对照组和5个不同剂量实验组,每组10只。对照组灌胃0.5%羧甲基纤维素钠溶液10 ml/kg,实验组灌胃利血平混悬液10 ml/kg,给药浓度分别为0.016、0.032、0.064、0.128、0.160 mg/kg,各组均每日灌胃2次。每日监测大鼠体重,分别于造模前和给药后1~6周末测量大鼠收缩压及心率变化。给药6周后,目内眦取血检测大鼠血清乳酸脱氢酶、肌酸激酶同工酶、谷丙转氨酶、谷草转氨酶、血肌酐及尿素氮水平,每组随机选取3只观察停药后大鼠收缩压变化情况,其余大鼠处死后测定脑内去甲肾上腺素及多巴胺水平。结果 与对照组比较,不同浓度利血平均可降低大鼠收缩压水平(F=28.492,P<0.001),收缩压下降幅度随药物浓度的增高而增加,第1周达到最低,随后稍有回升,给药3周后趋于稳定。其中0.016 mg/kg组大鼠收缩压水平自灌胃第5周开始与对照组比较差异均无统计学意义(P均>0.05);0.032、0.064、0.128、0.160 mg/kg组各时间点大鼠收缩压水平均显著低于对照组(P均<0.001),但4种不同给药浓度组间比较差异无统计学意义(P=0.204)。停药1周后,不同浓度利血平组大鼠收缩压均回升至基线水平,并维持稳定。各组间大鼠心率随时间的变化趋势一致,均呈现先增快后减慢的变化特点,相同时间点不同组间大鼠心率差异无统计学意义(F=0.922,P=0.475)。与对照组比较,不同浓度利血平组大鼠海马去甲肾上腺素含量(P均<0.001)及0.128 mg/kg(P=0.045)、0.160 mg/kg(P=0.042)组大鼠纹状体多巴胺水平显著降低,但不同浓度利血平组间比较差异无统计学意义(P=0.343,P=0.301)。不同浓度利血平组大鼠血清乳酸脱氢酶、肌酸激酶同工酶及尿素氮水平随利血平浓度增高而增加,其中0.160 mg/kg组乳酸脱氢酶(P=0.001)、肌酸激酶同工酶(P=0.020)、谷草转氨酶(P=0.007)及尿素氮(P=0.001)与对照组比较差异有统计学意义。结论 利血平灌胃可成功诱导大鼠低血压模型,其中利血平0.032 mg/kg、每日2次灌胃、连续3周为造模适宜条件,成模后需持续给药以维持大鼠稳定的低血压状态。
关键词:低血压;动物模型;利血平
中图分类号: R544.2文献标志码: A文章编号:1000-503X(2023)04-0533-08
DOI:10.3881/j.issn.1000-503X.15376
Establishment of a Rat Model of Hypotension Induced by Reserpine
ZHANG Xuan1,2,WANG Ci1,2,ZHANG Zeyu1,2,ZHANG Peipei1,2,
REN Qiuan1,2,WANG Xianliang1,MAO Jingyuan1
1Cardiovascular Department of First Teaching Hospital of Tianjin University of Traditional Chinese Medicine,National
Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion,Tianjin 300381,China
2Graduate School of Tianjin University of Traditional Chinese Medicine,Tianjin 301617,China
Corresponding author:MAO Jingyuan Tel:022-27986333,E-mail:jymao@126.com
ABSTRACT:Objective To determine the optimal dosage and intervention duration of reserpine to establish a rat model of hypotension.Methods According to the body weight and systolic blood pressure (SBP),60 male Wistar rats were assigned to six groups (n=10),including a control group and five observation groups with different doses.The control group was administrated with 10 ml/kg 0.5% sodium carboxymethyl cellulose solution,and the observation groups with 0.016,0.032,0.064,0.128,and 0.160 mg/kg reserpine suspensions,respectively.All the groups were administrated by gavage twice a day,and the body weights of rats were monitored daily.SBP and heart rate (HR) were measured before modeling and 1-6 weeks after administration.After 6 weeks of administration,the blood samples of inner canthus were collected.The levels of lactate dehydrogenase (LDH),creatine kinase MB isoenzyme (CK-MB),alanine aminotransferase,aspartate aminotransferase (AST),serum creatinine,and blood urea nitrogen (BUN) were measured by an autoanalyzer.Three rats in each group were randomly selected for observation of the changes in SBP after drug withdrawal and the rest rats were sacrificed for measurement of the levels of norepinephrine and dopamine in the brain.Results Compared with the control group,different doses of reserpine lowered the SBP of rats (F=28.492,P<0.001).The decline in SBP increased in a concentration-dependent manner.SBP reached the lowest value after 1 week,rose slightly later,and was stable after 3 weeks of administration.There was no significant difference in SBP between 0.016 mg/kg reserpine group and the control group after the 5th week (P>0.05).The SBP levels of rats in 0.032,0.064,0.128,and 0.160 mg/kg reserpine groups showed no significant difference between each other (P=0.204) and were lower than that in the control group (all P<0.001).One week after drug withdrawal,the SBP of rats in the observation groups rose to the baseline level and remained stable.HR showed similar changes among groups,first increasing and then decreasing.There was no significant difference in HR among different groups at the same time point (F=0.922,P=0.475).Compared with the control group,reserpine of different doses reduced the norepinephrine content in the hippocampus (all P<0.001),and 0.128 mg/kg (P=0.045) and 0.160 mg/kg (P=0.042) reserpine lowered the dopamine level in the striatum,which showed no significant differences between different reserpine groups(P=0.343,P=0.301).The levels of LDH,CK-MB,and BUN in the serum increased with the increase in reserpine concentration,and the levels of LDH (P=0.001),CK-MB (P=0.020),AST (P=0.007),and BUN (P=0.001) in the 0.160 mg/kg reserpine group were significantly different from those in the control group.Conclusions The rat model of hypotension can be induced by gavage with reserpine.The gavage with reserpine at a dose of 0.032 mg/kg,twice a day for three consecutive weeks is the optimal scheme for the modeling.After the model establishment,continuous administration is essential to maintain the hypotension.
Key words:hypotension;animal model;reserpine
Acta Acad Med Sin,2023,45(4):533-540
利血平灌胃诱导大鼠低血压模型的构建
中国医学科学院学报
低血压病临床较为常见,多伴有头晕、心悸、疲乏甚至黑矇、晕厥等临床表现[1],虽无明显致死率,却严重影响患者生活质量,增加心理及经济负担[2-4]。其确切发病机制至今未明,临床常采用α受体激动剂、盐皮质激素、谷维素、维生素及补充营养等治疗措施,疗效均不理想[5-7]。建立一种高效、稳定的低血压动物模型,将有助于对低血压发病机制的认识和新药的开发。目前,广泛应用于低血压研究的动物模型包括手术模型和药物模型,其中手术模型最常用缩窄腹主动脉法[8],手术模型稳定性较高,但仅在结扎点以下表现为低血压,与人类低血压病的整体状态有较大差异;药物模型常使用利血平灌胃诱导大鼠形成整体低血压状态,与临床实际情况较为贴切,更适宜药效评价与机制探讨[9]。鉴于利血平诱导大鼠低血压模型的剂量和干预时间尚无统一标准,现有文献显示,一般为每日2次灌胃给药,给药浓度0.0128~0.1600 mg/kg,干预时间1~6周[10-11]。因此,本研究在此区间设定不同给药浓度,进行为期6周的实验观察,以期筛选最佳造模条件,为低血压的研究提供稳定的动物模型。
材料和方法
实验动物 健康清洁级雄性Wistar大鼠60只,体重200~220 g,购自北京维通利华实验动物技术有限公司[合格证号:SCXK(京)2021-0006],饲养于中国医学科学院放射医学研究所动物中心[实验动物使用许可证:SYXK(津)2019-0002],温度22~25 ℃,湿度55%~60%,昼夜各半循环照明,饲养期间各组大鼠自由饮水,喂养普通维持饲料(批号:22073231)。正式实验前适应性饲养1周。所有实验操作均严格遵照动物伦理相关规定执行并通过中国医学科学院放射医学研究所实验动物伦理委员会审批(伦理审查批号:IRM-DWLL-2022133)。
主要试剂与儀器 复方利血平片(石药集团欧意药业有限公司,每片含利血平0.032 mg,批号:H13024462)、羧甲基纤维素钠(西格玛奥德里奇贸易有限公司,规格100 g,货号:419273)、三溴乙醇(西格玛奥德里奇贸易有限公司,批号:MKCM1060)、大鼠去甲肾上腺素酶联免疫试剂盒(上海江莱生物科技有限公司,货号:JL13428)、大鼠多巴胺酶联免疫吸附测定试剂盒(上海江莱生物科技有限公司,货号:JL12965);智能无创血压计BP-2010A(北京软隆生物技术有限公司)、精密电子天平(梅特勒-托利多仪器有限公司)、L550台式低速大容量离心机(湘仪离心机仪器有限公司)、STATFAX2100全自动酶标仪(美国Awareness Technology公司)、BS-350E全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)。
药物配置 实验组设置5种不同浓度的利血平混悬液,分别取1、2、4、8、16片复方利血平片于研钵中研磨至粉碎,成细粉后边研磨边向其中加入0.5%羧甲基纤维素钠溶液,研磨混匀后转移至烧杯,定容至20 ml,每次使用前均需现用现配,避光放置,4 ℃保存。
实验分组及模型制备 60只雄性Wistar大鼠适应性饲养1周,期间进行血压测量适应性训练。1周后按照大鼠体重及收缩压水平进行分层,然后每层再按照随机数字表法分为对照组和5个不同剂量实验组,每组10只。对照组大鼠灌胃0.5%羧甲基纤维素钠10 ml/kg,实验组灌胃利血平混悬液10 ml/kg,给药浓度分别为0.016、0.032、0.064、0.128、0.160 mg/kg,各组均每日早晚灌胃2次,连续给药6周。
观察指标及方法
一般状态观察:每天固定时间称量大鼠体重,密切观察给药后大鼠精神状态、活动量及对外周刺激的反应程度,记录各组的死亡分布情况。
大鼠收缩压及心率测定:分别于造模前,给药第1、2、3、4、5、6周末进行收缩压及心率测定。测量时,选择安静、温暖、避风场所,先将清醒大鼠于昏暗、温暖的保温筒(39 ℃)中进行稳定,待智能无创血压计BP-2010A显示脉波平稳后进行测量,每只大鼠重复测量5次,记录平均值。
血清生化指标水平测定:给药6周末,目内眦采血1.5 ml加入分离胶促凝管,静置30 min,3500 r/min(r=15.7 cm)离心10 min分离血清,收集上清液,全自动生化分析仪检测血清乳酸脱氢酶、肌酸激酶同工酶、谷丙转氨酶、谷草转氨酶、血肌酐及尿素氮水平。
脑内儿茶酚胺水平测定:给药6周末,完成大鼠收缩压及心率测定后,每组随机选取3只观察停药后大鼠血压变化情况,其余大鼠禁食不禁水,12 h后采用1.5%三溴乙醇(0.008 mg/g)腹腔注射麻醉大鼠,断头处死,迅速在冰台上剥离海马及纹状体,分别称重,按比例加入预冷的PBS溶液,玻璃匀浆器冰上匀浆,4 ℃ 5000 r/min(r=15.7 cm)离心15 min,取上清液,根据酶联免疫试剂盒操作步骤检测海马去甲肾上腺素及纹状体多巴胺含量。
统计学处理 采用SPSS 21.0统计软件进行统计分析,实验数据用均数±标准差表示,两样本计量资料进行t检验,多组间比较采用单因素方差分析,不同时间点重复测量数据进行重复测量的方差分析。P<0.05为差异有统计学意义。
结果
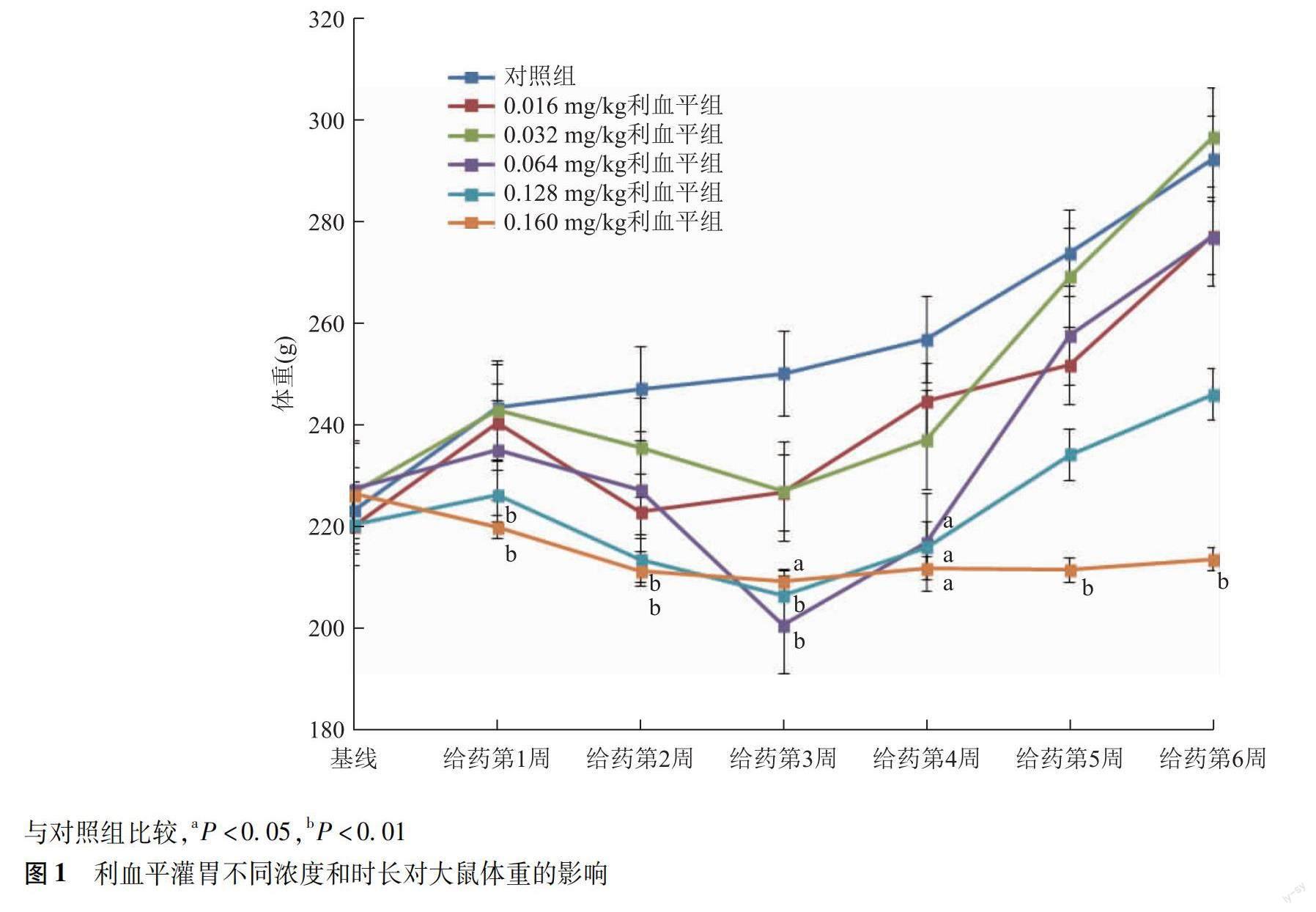
一般情况 对照组大鼠精神活泼,反应灵敏,体重逐日增加,活动量及食量正常;与对照组相比,实验组大鼠蜷缩少动,活动量相对减少,给药1周后体重开始下降,多数大鼠于第3周体重达最低值,随后逐渐恢复呈增长趋势。给药5周后,除0.160 mg/kg组大鼠体重显著低于对照组外(P=0.006),其余4组大鼠体重与对照组比较差异均无统计学意义(P均>0.05)(图1)。
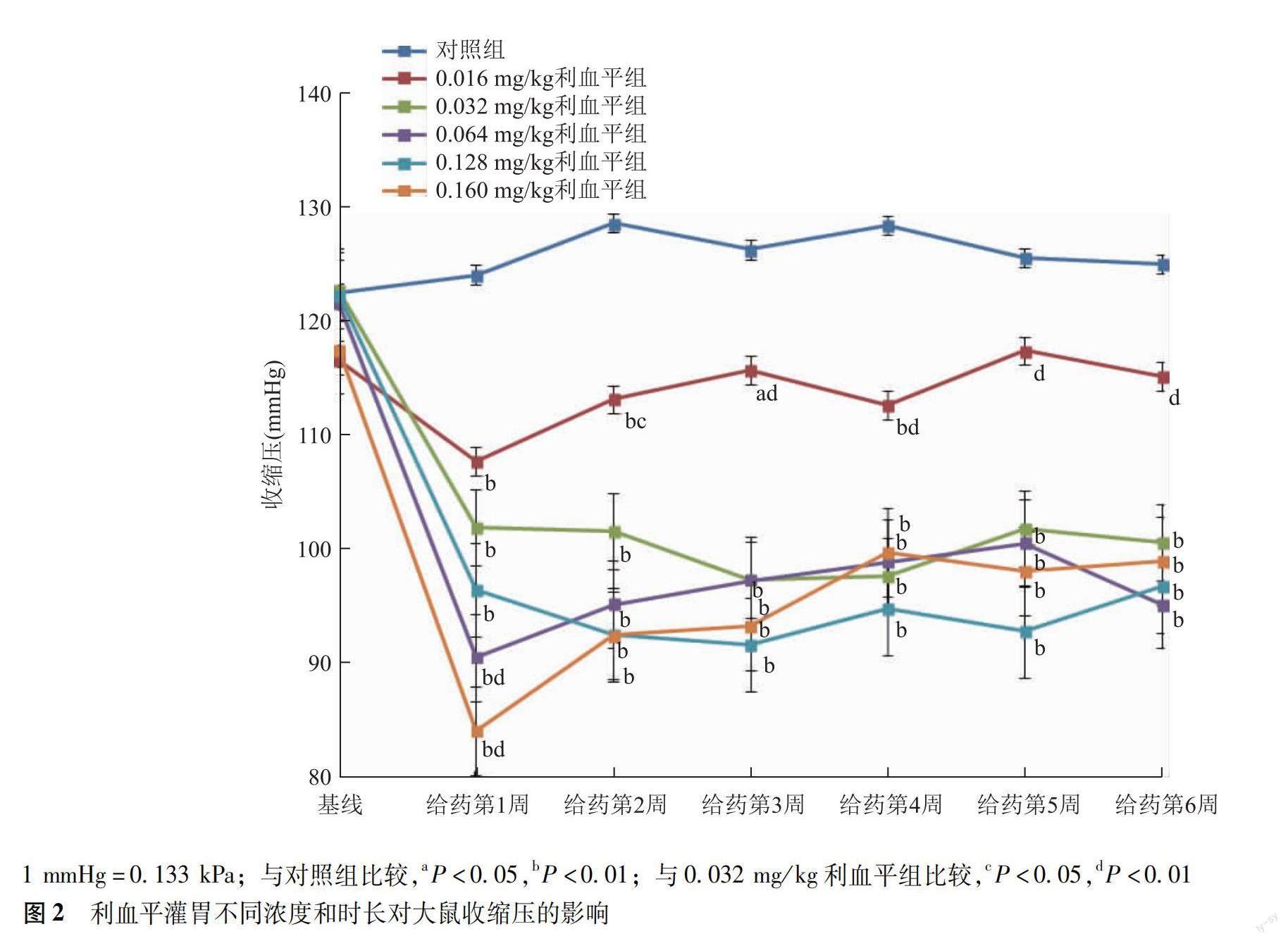
收缩压 给药前各组大鼠收缩压基线一致,组间比较差异无统计学意义(P>0.05),具有可比性。重复测量的方差分析显示,灌胃不同浓度利血平大鼠收缩压差异有统计学意义(F=28.492,P<0.001),与对照组比较,不同浓度利血平均可显著降低大鼠收缩压水平(P均<0.001),且收缩压下降幅度随药物浓度的增高而增加,呈现一定的剂量依赖趋势(F=27.022,P<0.001)。给药时长亦对大鼠收缩压产生影响(F=24.994,P<0.001),多数大鼠于第1周收缩压达最低值,随后稍有回升,给药3周后开始趋于稳定。给药浓度与时长存在交互效应,随给药时间延长,不同浓度利血平收缩压变化差异有统计学意义(F=4.892,P<0.001)。其中0.016 mg/kg浓度组大鼠收缩压水平自灌胃第5周开始与对照组比较差异均无统计学意义(P均>0.05);0.032、0.064、0.128、0.160 mg/kg浓度组各时间点大鼠收缩压水平均显著低于对照组(P均<0.001),但4种浓度利血平组间比较差异无统计学意义(P=0.204)(图2)。
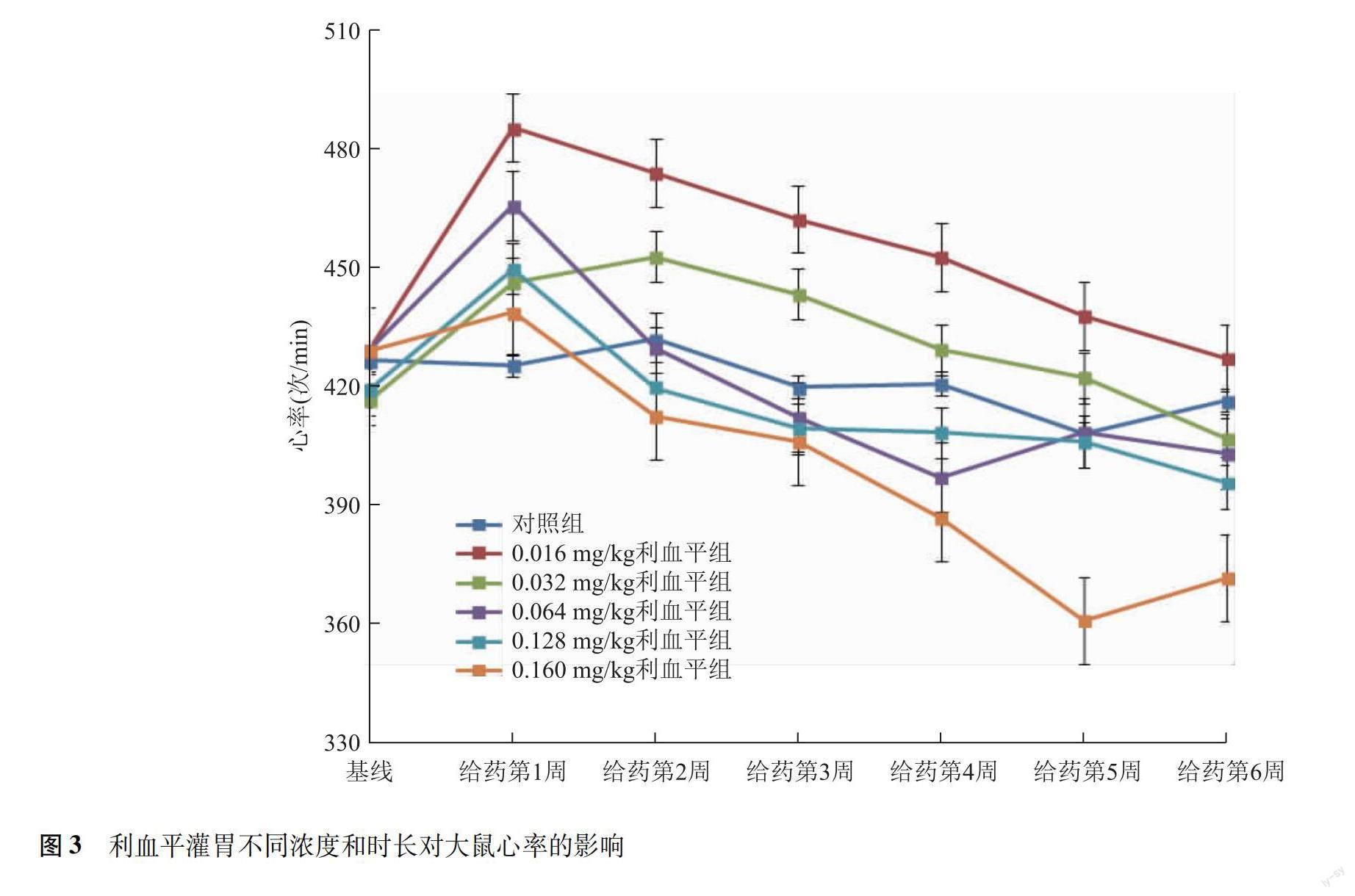
心率 给药后不同时间大鼠心率差异有统计学意义(F=9.276,P<0.001),但相同时间不同组间心率差异无统计学意义(F=0.922,P=0.475),各组间大鼠心率随时间的变化差异无统计学意义(F=0.934,P=0.570),均呈现先增快后减慢的变化特点,多于给药后1~2周达最高值,随后下降(图3)。
脑内儿茶酚胺水平 不同组间大鼠海马去甲肾上腺素含量差异有统计学意义(F=7.789,P<0.001),与对照组比较,不同浓度利血平大鼠海马去甲肾上腺素含量均显著减少(P均<0.001),但不同浓度利血平组间比较差异无统计学意义(P=0.343);不同组间大鼠纹状体多巴胺水平差异有统计学意义(F=6.170,P=0.001),与对照组比较,0.128、0.160 mg/kg浓度组大鼠脑内多巴胺水平显著降低(P=0.045,P=0.042),但不同浓度利血平组间比较差异无统计学意义(P=0.301)(图4)。
安全性评价
大鼠死亡率:至6周末,60只大鼠共计死亡7只,分别为0.064 mg/kg浓度组1只、0.128 mg/kg浓度组2只、0.160 mg/kg浓度组4只。死亡大鼠均明显消瘦,死亡时体重144.50~167.00 g。
大鼠血清生化指标变化:不同浓度利血平组大鼠血清乳酸脫氢酶、肌酸激酶同工酶及尿素氮水平随利血平浓度增高呈增长趋势,其中0.160 mg/kg浓度组乳酸脱氢酶(P=0.001)、肌酸激酶同工酶(P=0.020)、谷草转氨酶(P=0.007)及尿素氮(P=0.001)水平与对照组比较差异有统计学意义(表1)。
停药后血压恢复情况 停药后大鼠收缩压开始回升,停药后1周各组大鼠收缩压与自身基线水平相比差异无统计学意义(P=0.389),随后趋于稳定(图5)。
讨论
低血压病是多因素引发的临床疾病,与已广泛研究的高血压不同,现代医学对低血压病理机制的认识较少。1995年,杨为国等[12]采用3项紧张刺激方法进行测试,显示原发性低血压病患者植物交感系统兴奋性减弱,副交感神经兴奋性相对增强;2012年,Covassin等[13]进一步选取相对无外界干扰的睡眠状态,评估原发性低血压病患者与正常血压者的心血管自主神经活动,再次证实低血压患者存在交感神经张力降低合并副交感神经兴奋性增强的病理特征。
利血平是从萝芙木属植物蛇根木中提取的生物碱,作为一种有效的单胺囊泡转运蛋白抑制剂,可通过影响交感神经末梢中儿茶酚胺类物质摄取进入囊泡而致使其被单胺氧化酶降解,耗竭去甲肾上腺素的贮存以妨碍交感神经冲动的传递,从而使血管舒张、血压下降,常被用作有效的降压药物使用[14]。同时,利血平可透过血脑屏障,故临床长期应用利血平患者常出现嗜睡、抑郁和运动障碍等不良反应。鉴于此,有研究将利血平用于啮齿类动物抑郁症及帕金森模型的构建,但区别于灌胃利血平诱导的低血压模型,多采用腹腔或尾静脉注射,且给药剂量更大[15-18]。此外,利血平还被广泛应用于中医脾虚证的建模[19]。王璇[20]梳理了近30年中医药治疗低血压病的相关文献,结果显示低血压病病机以气虚为主,核心病位在脾。利血平诱导的慢性低血压模型与低血压病患者的发病特点及临床特征高度契合,适宜药效的评价研究及机制探讨。
本研究显示灌胃不同浓度利血平均可导致大鼠收缩压降低,且不同浓度利血平对大鼠收缩压的影响程度不同,存在一定的量效关系,即一定浓度范围内增加利血平浓度可导致大鼠收缩压相应减低。不同浓度利血平组大鼠收缩压多于给药1周后达最低值,随后稍有回升,并于给药后3周开始趋于稳定。其中0.016 mg/kg组大鼠收缩压水平自灌胃第5周开始与对照组比较差异无统计学意义,予以排除。0.032、0.064、0.128、0.160 mg/kg 组各时间点大鼠收缩压水平均显著低于对照组,但4种浓度利血平组间比较差异无统计学意义,即降压效果不再随利血平浓度的增加而增强,随着交感神经末梢儿茶酚胺类物质的耗竭,利血平已达最大降压效应[21]。同时,随着利血平浓度的增加,大鼠血清乳酸脱氢酶、肌酸激酶同工酶及尿素氮等心、肾毒性指标逐渐升高,0.064、0.128与0.160 mg/kg组大鼠开始出现死亡,死亡率分别为10%、20%与40%,药物过量使用的毒性逐渐显现。本研究提示灌胃利血平0.032 mg/kg可成功诱导大鼠形成稳定的低血压状态,安全性良好,易化性较高,相较于结扎腹主动脉法,与人体低血压发病机制及临床表现的相似程度更高;相较于失血性模型所造成的整体低血压状态,操作简单且易于控制,对模型大鼠的伤害较小,稳定性及可重复性高,是适宜药效评价的理想模型。
利血平灌胃后大鼠心率较给药前明显增快,给药1周后达最高值,随后缓慢下降。分析可能原因,用药第1周大鼠收缩压显著降低,外周灌注不足,体内压力感受器激活,生理反馈被启动,机体通过提升心率的方式增加心输出量,以代偿性维持有效循环血量[22];1周后大鼠血压轻度上升逐渐趋于稳态,生理反馈伴随减弱,利血平对交感神经的抑制作用逐渐显现,大鼠心率减慢。
综上,利血平灌胃可成功诱导大鼠低血压模型,其中利血平0.032 mg/kg、每日2次灌胃、连续3周为利血平诱导大鼠低血压模型的适宜条件,成模后仍需持续给药以维持大鼠稳定的低血压状态。
参 考 文 献
[1]陈灏珠.心脏病学—心血管内科学[M].北京:人民卫生出版社,2016.
[2]Afari N,Buchwald D.Chronic fatigue syndrome:a review[J].Am J Psychiatry,2003,160(2):221-236.DOI:10.1176/appi.ajp.160.2.221.
[3]Barrett-Connor E,Palinkas LA.Low blood pressure and depression in older men:a population based study[J].BMJ,1994,308(6926):446-449.DOI:10.1136/bmj.308.6926.446.
[4]Duschek S,Schandry R.Reduced brain perfusion and cognitive performance due to constitutional hypotension[J].Clin Auton Res,2007,17(2):69-76.DOI:10.1007/s10286-006-0379-7.
[5]罗德,陈少雄.七味平衡升压汤联合西药治疗原发性低血压病的疗效观察[J].中国民族民间医药,2018,27(13):86-88.
[6]朱林章.维生素B1、甲钴胺联合参松养心胶囊治疗原发性低血压病的探讨[J].中国医学创新,2009,6(36):53.DOI:10.3969/j.issn.1674-4985.2009.36.032.
[7]吕耀成.七味平衡升压汤联合盐酸米多君篇治疗原发性低血压病41例[J].中医研究,2019,32(8):25-28.DOI:10.3969/j.issn.1001-6910.2019.08.11.
[8]Liu SQ,Fung YC.Relationship between hypertension,hypertrophy,and opening angle of zero-stress state of arteries following aortic constriction[J].J Biomech Eng,1989,111(4):325-335.DOI:10.1115/1.3168386.
[9]秦彩玲,刘婷,张毅,等.桂枝汤对大鼠血压双向调节作用及其有效部位探讨[J].中国实验方剂学杂志,2001,7(4):20-23.DOI:CNKI:SUN:ZSFX.0.2001-04-009.
[10]杨路,吴春晓,陈莹,等.针刺手三阴经原穴对高、低血压模型大鼠经穴特异性的影响[J].广州中医药大学学报,2016,33(3):334-338.DOI:10.13359/j.cnki.gzxbtcm.2016.03.013.
[11]田原.人参超微粉及水提物对大鼠实验性低血压的升压作用研究[D].吉林:吉林大学,2018.
[12]杨国为,周岩,林红华.原发性低血压病紧张刺激研究分析[J].福建医药杂志,1995,17(6):66.
[13]Covassin N,De Zambotti M,Cellini N,et al.Nocturnal cardiovascular activity in essential hypotension:evidence of differential autonomic regulation[J].Psychosom Med,2012,74(9):952-960.DOI:10.1097/PSY.0b013e318272db69.
[14]中老年医学会高血压分会,中华医学会心血管病学分会,中国医师协会高血压专业委员会,等.复方利血平氨苯蝶啶片(0号)临床应用中国专家共识2021版[J].中华老年多器官疾病杂志,2021,20(9):5.DOI:10.3969/j.issn.1007-5410.2021.05.005.
[15]Willner P.The validity of animal models of depression[J].Psychopharmacology,1984,83(1):1-16.DOI:10.1007/BF00427414.
[16]Carlsson A,Lindqvist M,Magnusson T.3,4-dihydroxypheylalanine and 5-hydroxy-tryptophan as reserpine antagonitst[J].Nature,1957,180(4596):1200.DOI:10.1038/1801200a0.
[17]高雪松,王永志,李麗,等.利血平致抑郁样啮齿类动物模型的研究进展[J].实验动物学,2017,34(2):57-60.
[18]Ahmed-Farid OA,Taha M,Bakeer RM,et al.Effects of bee venom and dopamine-loaded nanoparticles on reserpine-induced parkinsons disease rat model[J].Sci Rep,2021,11(1):21141.DOI:10.1038/s41598-021-00764-y.
[19]李亚欢,张冬梅,王淑艳,等.脾虚证动物模型研制概况[J].中医药导报,2019,25(1):100-102.
[20]王璇.低血压症的中医证候-方药分布特点及临床观察[D].济南:山东中医药大学,2015.
[21]李艳芳,师树田.受体激动剂与阻滞剂在心血管病的临床应用[M].北京:人民军医出版社,2014.
[22]王庭槐.生理学[M].北京:人民卫生出版社,2018.
(收稿日期:2022-11-08)

