鲜食葡萄降酸酵母菌的筛选、鉴定及酿造特性研究
吕银德,赵俊芳*,秦令祥
(漯河食品职业学院 食品工程系,河南 漯河 462300)
葡萄酒酿造是一个复杂的多菌种参与的生物转化过程,主要包括由酵母菌完成的乙醇发酵和由乳酸菌完成的苹果酸乳酸发酵[1]。乙醇发酵是葡萄酒酿造中最主要的发酵过程,在此过程中,糖类物质被转化为乙醇和二氧化碳,同时产生其他代谢产物。根据酵母菌酒精产能特性,其被分为酿酒酵母菌(Saccharomyces cerevisiae)和非酿酒酵母菌(non-Saccharomycesyeast)。酿酒酵母菌具有较强的乙醇耐受性和乙醇代谢能力,在发酵过程中通过转化糖类可产生大量乙醇;而非酿酒酵母菌在发酵过程中可产生甘油、酸类、酯类、醛类、高级醇等多种次级代谢物,决定着葡萄酒的风味、丰富性和复杂度,使葡萄酒具有独特的典型性[2-4]。苹果酸乳酸发酵是葡萄酒酿造中继乙醇发酵后重要的二次发酵,在此过程中酿酒乳酸菌—酒类酒球菌(Oenococcus oeni)将苹果酸转化为乳酸和二氧化碳,同时产生其他代谢产物[5]。苹果酸乳酸发酵具有降低葡萄酒酸度、提高葡萄酒生物稳定性和增加葡萄酒香气等多种作用,是酿造红葡萄酒和部分白葡萄酒的重要步骤,对葡萄酒口感、风味和典型性具有重要影响[6-7]。
通常情况下乙醇发酵结束后葡萄酒具有较高的酸度,其主要是由酸度较高的苹果酸和酒石酸造成[8]。过高的酸度对葡萄酒口感和品质具有较大的负面影响,令消费者难以接受,因此乙醇发酵结束后进行降酸处理是葡萄酒酿造中的必要步骤。通常苹果酸是在乙醇发酵结束后的苹果酸乳酸发酵阶段通过乳酸菌将其降解为一元酸乳酸,从而达到降酸的目的[9-11]。而目前在乙醇发酵阶段通过酵母菌将苹果酸降解为乳酸的研究还较少。部分鲜食葡萄酒酸度高,通过生物方法降低酒体酸度也是提高其品质的重要途径[12-13]。不同来源酵母菌具有不同的功能和发酵特性[14],将鲜食葡萄来源的酵母菌用于葡萄酒生产可能会产生意想不到的效果,而关于此方面的研究还较少。
本试验从鲜食葡萄自然发酵液分离出的酵母菌中筛选降酸酵母菌,并对其发酵性能、耐受性和糖苷酶活性进行测定,筛选出具有良好性能的葡萄酒酿造酵母菌。这对提高葡萄酒品质和开发新的酵母菌资源具有重要意义。
1 材料与方法
1.1 材料与试剂
酵母菌株:从夏黑葡萄自然发酵液中分离,保存于实验室,命名为XH1~XH20;商业化酵母菌DV01:上海杰兔生物科技有限公司。
L-苹果酸:上海阿拉丁生化科技股份有限公司;L-苹果酸试剂盒:上海科艾博生物技术有限公司;对硝基苯基-β-葡萄糖苷:北京威知生物科技有限公司;溶菌酶:上海生工生物工程股份有限公司;其他试剂均为国产分析纯。
苹果酸降解指示培养基[15]:在YNB培养基的基础上添加硫酸铵5 g/L,L-苹果酸20 g/L,溴甲酚绿0.1 g/L,双蒸水配制,0.45 μm滤膜过滤。121 ℃高压蒸汽灭菌15 min。
酵母浸粉蛋白胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:广东环凯微生物科技有限公司;酵母氮源基础(yeast nitrogen base,YNB)培养基:今品化学技术(上海)有限公司。
1.2 仪器与设备
DSX-280B型式压力蒸汽灭菌器:上海申安医疗器械厂;JBCJ-V超净工作台:苏州佳宝净化工程设备有限公司;PSH-300生化培养箱:中科生命科技股份有限公司;LIOOJS500双目显微镜:无锡万物生态科技有限公司;UH5300紫外分光光度计:日本日立公司;FE28 pH计:梅特勒-托利多仪器上海股份有限公司。
1.3 试验方法
1.3.1 降酸酵母菌的筛选
参照白玉峰等[15]所述方法筛选具有L-苹果酸降解能力的酵母菌。每天观察并记录培养基颜色变化,若培养基颜色从黄色变为蓝色,说明菌株具有L-苹果酸降解能力,颜色变化越大说明L-苹果酸降解能力越强。每株菌做3个平行。
1.3.2 降酸酵母菌的鉴定
参照邓晓茜等[16]所述方法,提取酵母菌脱氧核糖核酸(deoxyribonucleic acid,DNA)后,采用通用引物ITS1/ITS4扩增ITS并测序,序列经序列经美国国家生物技术信息中心(national center of biotechnology information,NCBI)的Gen Bank数据库中,采用基本局部比对搜索工具(basic localalignment search tool,BLAST)进行比对,采用MEGA-7软件以邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.3 降酸酵母菌的发酵性能测定
产酒精力测定及香气评价:参照李亚辉等[17]所述的方法,测定酵母菌的产酒精能力并由感官评定小组进行香气评价,重复测定3次。
发酵力测定:采用董亚晨等[18]所述CO2质量损失法测定酵母菌的发酵能力,重复测定3次,绘制发酵力曲线。
1.3.4 降酸酵母菌的耐受性能测定
葡萄糖耐受性测定:调整YPD培养基葡萄糖的质量浓度分别为150 g/L、200 g/L、250 g/L、300 g/L、350 g/L、400 g/L,以葡萄糖质量浓度20 g/L为对照[19]。考察其对发酵液活菌数的影响。
乙醇耐受性测定:调整YPD培养基中乙醇体积分数分别为10%、12%、14%、16%、18%、20%,以不添加乙醇为对照[17]。考察其对发酵液活菌数的影响。
SO2耐受性测定:调整YPD培养基中SO2质量浓度分别为100 mg/L、150mg/L、200 mg/L、250 mg/L、300 mg/L、350 mg/L,以不添加SO2为对照[20]。考察其对发酵液活菌数的影响。
以上均按5%(0.6×106CFU/mL)的接种量接种酵母菌,28 ℃、100 r/min条件下培养48 h,采用血球计数板法测定不同葡萄糖质量浓度、不同乙醇体积分数、不同SO2质量浓度下发酵液中的活菌数,重复测定3次。
1.3.5 降酸酵母菌的糖苷酶活性测定
样品处理:参照LI Y H等[21]所述方法获得酵母培养液上清、完整细胞和细胞破碎液。
酶活测定:参照李亚辉等[22]所述方法分别对酵母培养液上清、完整细胞和细胞破碎液进行β-葡萄糖苷酶活测定。酶活定义为:在每克酵母菌(干质量)作用下每分钟生成对硝基苯酚的量为一个酶活单位,μmol/(g·min)。每个样品酶活测定重复3次。
1.3.6 降酸酵母菌的降酸性能测定
以夏黑葡萄为原料,分别按0.5%接种量接种筛选的降酸酵母菌,以商业化酵母菌DV01为对照,于25 ℃条件下发酵,当糖含量低于4.0 g/L时发酵结束。利用苹果酸试剂盒分别在发酵前和发酵后测定发酵液中苹果酸含量。
1.3.7 数据分析
利用SPSS18.0和Design Expert V8.0数据处理软件进行数据处理及统计分析。
2 结果与分析
2.1 降酸酵母菌的筛选及鉴定
2.1.1 降酸酵母菌的筛选
20株酵母菌培养后显色结果见表1。由表1可知,酵母菌XH8降酸能力强,XH10降酸能力较强,XH3和XH15降酸能力弱,其余菌株无降酸能力,故选择菌株XH8、XH10、XH3和XH15进行后续实验。

表1 酵母菌在苹果酸降解指示培养基上的显色结果Table 1 Chromogenic results of yeasts on malic acid degradation indicator medium
2.1.2 酵母菌的鉴定
筛选出的菌株XH3、XH8、XH10和XH15的菌落和细胞形态见图1。由图1可知,4株菌菌落呈圆形,中间凸起,乳白色,质地均匀,表面光滑、湿润、粘稠,边缘规整;4株菌细胞形态呈椭圆形,生殖方式为芽殖,无菌丝。菌落和细胞形态均符合酵母菌特点。
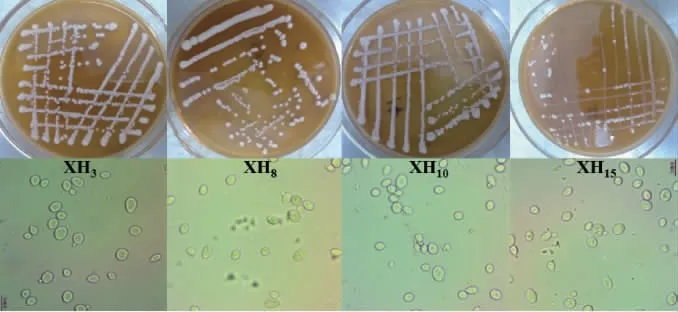
图1 4株降酸酵母菌的菌落和细胞形态Fig.1 Colony and cell morphology of 4 acid-reducing yeasts
菌株XH3、XH8、XH10和XH15的系统发育树见图2。由图2可知,菌株XH3、XH8和XH10与酿酒酵母具有100%相似度,可鉴定为酿酒酵母(Saccharomyces cerevisiae);菌株XH15与毕赤酵母具有100%相似度,可鉴定为黄皮毕赤酵母(Pichia scutulata)。
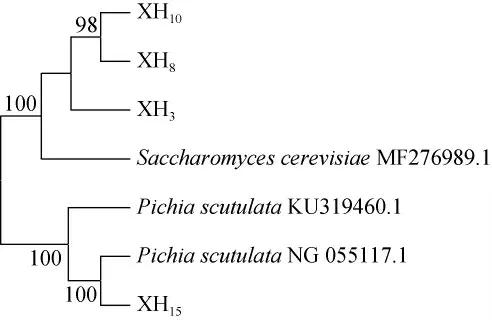
图2 基于ITS基因序列4株降酸酵母菌的系统发育树Fig.2 Phylogenetic tree of 4 strains of acid-reducing yeasts based on ITS gene sequence
2.2 降酸酵母菌的发酵性能
2.2.1 产酒精力测定及香气评价
对筛选的4株酵母菌XH3、XH8、XH10和XH15的产酒精力进行测定,并在培养后进行香气评价,结果见表2。

表2 4株降酸酵母菌的产酒精力和香气评价结果Table 2 Results of alcoholic yield and aroma evaluation results of 4 acid reducing yeasts
由表2可知,菌株XH3和XH15具有较强的产酒精能力,发酵液的酒精度分别为7.9%vol和8.3%vol,菌株XH8和XH10的产酒精力较差,发酵液的酒精度分别为4.2%vol和4.8%vol。4株酵母菌发酵后均具有发酵香和酒香。结果表明,菌株XH3和XH15不仅具有较强的产酒精能力,且能产生较好的香气。
2.2.2 发酵力测定
对筛选的4株降酸酵母菌XH3、XH8、XH10和XH15的发酵力进行测定,结果见图3。由图3可知,菌株XH3和XH15的总CO2产生量分别为19.75 g和20.56 g,菌株XH8和XH10的总CO2产生量分别为12.15 g和15.40 g。菌株XH3和XH15的CO2产生量明显高于菌株XH8和XH10;菌株XH3在发酵前60 h随着时间延长,CO2产生量逐渐升高,发酵第60小时时,CO2产生量最大为3.3 g,然后随着时间延长,CO2产生量逐渐下降;菌株XH15在发酵前72 h随着时间延长产生的CO2量逐渐升高,第72小时时,CO2产生量最大为3.4 g,然后随着时间延长,CO2产生量逐渐下降。菌株XH8和XH10分别在48 h和72 h CO2产生量最大,之后产量逐渐下降。菌株XH3和XH15具有较强的发酵能力,且高于菌株XH8和XH10。
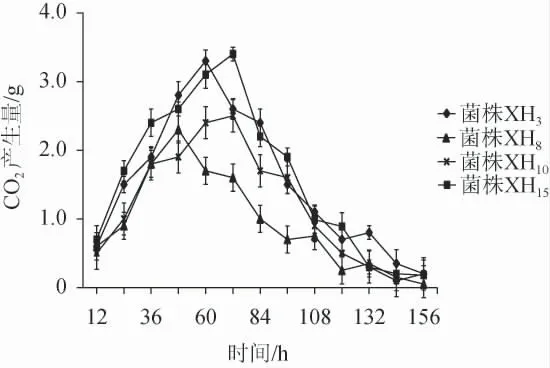
图3 4株降酸酵母菌的发酵力曲线Fig.3 Fermentation capacity curves of 4 acid-reducing yeasts
2.3 降酸酵母菌的耐受性能
2.3.1 葡萄糖耐受性
由图4可知,随着葡萄糖含量的增加,4株酵母菌的活菌数均逐渐降低;当葡萄糖含量≤200 g/L时,不同葡萄糖含量对4株菌的活菌数影响较小,无显著差异(P>0.05);和葡萄糖含量为200g/L时活菌数相比,葡萄糖含量为250 g/L时对菌株XH10和XH15的活菌数有明显的抑制作用(P<0.05),葡萄糖含量为300 g/L时对菌株XH3和XH8的活菌数有明显的抑制作用(P<0.05)。结果表明,菌株XH3和XH8的葡萄糖耐受性优于菌株XH10和XH15,菌株XH3和XH8葡萄糖耐受性最高为250 g/L,菌株XH10和XH15葡萄糖耐受性最高为200 g/L。通常情况下,葡萄酒发酵液中糖含量≤250 g/L[23],因此,在葡萄糖耐受性方面,菌株XH3和XH8可满足酿酒的需要。
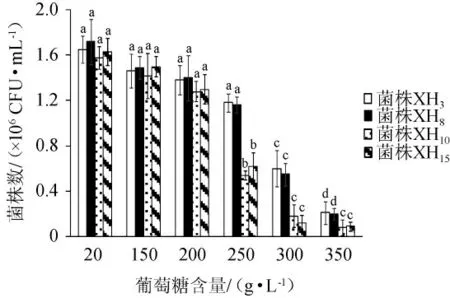
图4 不同葡萄糖含量对4株降酸酵母生长的影响Fig.4 Effect of different glucose contents on the growth of 4 acid-reducing yeasts
2.3.2 乙醇耐受性
由图5可知,随着乙醇体积分数的增加,4株酵母菌的活菌数均逐渐降低;当乙醇体积分数≤8%时,对4株菌的生长影响较小;乙醇体积分数为12%时对酵母菌XH8和XH10的活菌数有明显抑制作用(P<0.05),乙醇体积分数为14%时对酵母菌XH15的活菌数有明显抑制作用(P<0.05),乙醇体积分数为16%时对酵母菌XH3的活菌数有明显抑制作用(P<0.05);菌株XH3的乙醇耐受性最好,最高可耐受14%乙醇,其次为菌株XH15,最高可耐受12%乙醇,菌株XH8和XH10的乙醇耐受性较差,最高可耐受10%vol。通常情况下,葡萄酒的酒精度约为12%vol[22],因此,在乙醇耐受性方面,菌株XH3和XH15有较好的耐受性,可满足酿酒的需要。
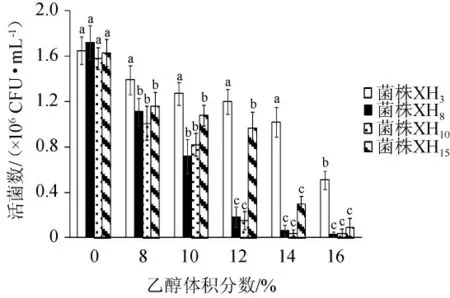
图5 不同乙醇体积分数对4株降酸酵母菌生长的影响Fig.5 Effect of different ethanol volume fraction on the growth of 4 acid-reducing yeasts
2.3.3 SO2耐受性测定
由图6可知,随着SO2含量的增加,4株菌的活菌数均逐渐降低;当SO2含量为200 mg/L时,对酵母菌XH10的活菌数有显著的抑制作用(P<0.05);当SO2含量为250mg/L时,对酵母菌XH3、XH8和XH15的活菌数有显著的抑制作用(P<0.05);当SO2含量为300 mg/L时,4株菌几乎不生长。结果表明,酵母菌XH3、XH8和XH15的SO2耐受性强于酵母菌XH10,菌株XH3、XH8和XH15的SO2耐受性最高为200 mg/L,菌株XH10的SO2耐受性最高为150 mg/L。通常情况下,葡萄酒酿造中SO2含量<200 mg/L[24],因此,在SO2耐受性方面,菌株XH3、XH8和XH15可满足葡萄酒酿造的需要。
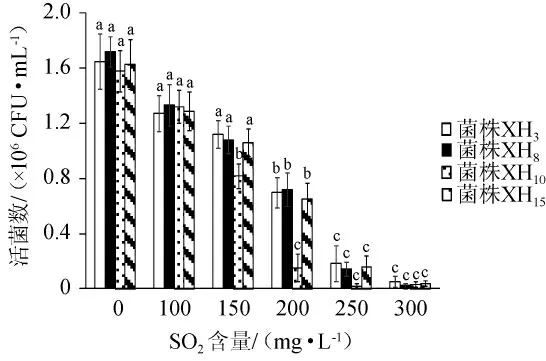
图6 不同SO2含量对4株降酸酵母菌生长的影响Fig.6 Effect of different SO2 contents on the growth of 4 acid-reducing yeasts
2.4 降酸酵母菌的糖苷酶活性
由图7可知,XH3、XH8、XH10和XH15菌株细胞破碎液的β-葡萄糖苷酶活性最高,分别为10.8 μmol/(g·min)、13.2 μmol/(g·min)、12.1 μmol/(g·min)和7.9 μmol/(g·min),其次是完整细胞,分别为5.5μmol/(g·min)、3.2μmol/(g·min)、1.6 μmol/(g·min)和2.1 μmol/(g·min),培养液上清中酶活性最低;菌株XH8细胞破碎液的酶活最高,菌株XH3完整细胞的酶活显著高于其他3株菌(P<0.05)。结果说明,4株降酸酵母菌的β-葡萄糖苷酶主要为胞内酶,胞外酶活较低,完整细胞也具有一定酶活;菌株XH8胞内酶活最高,菌株XH3完整细胞酶活最高。β-葡萄糖苷酶可降解香气前体物产生香气物质,在葡萄酒酿造中具有重要作用[25]。此结果与前人报道的酵母菌分泌的β-葡萄糖昔酶大多为胞内酶或胞壁结合酶一致[26-27]。
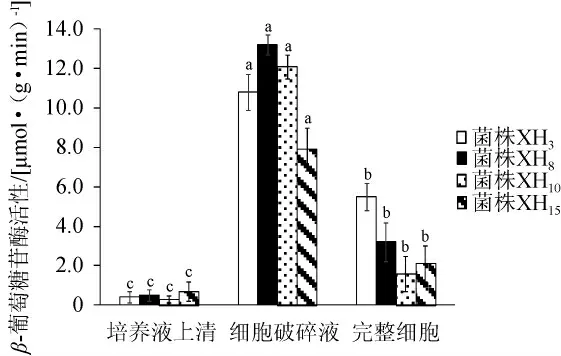
图7 4株降酸酵母菌β-葡萄糖苷酶活性Fig.7 β-glucosidase activities of 4 acid-reducing yeasts
2.5 降酸酵母菌的降酸性能
降酸酵母菌XH3、XH8、XH10和XH15在以夏黑葡萄为原料发酵液中降解L-苹果酸的测定结果见表3。由表3可知,菌株XH3和对照菌株DV01的发酵时间最短为195 h,其次是菌株XH15、XH8和XH10;菌株XH8对L-苹果酸降解量最高,降解量为0.545 g/L,其次是菌株XH10,降解量为0.404 g/L,这两株菌对L-苹果酸的降解量均超过对照菌株DV01的降解量0.099 g/L,菌株XH3和菌株XH15对L-苹果酸的降解量较低,分别为0.091 g/L和0.066 g/L,均低于对照菌株DV01的降解量。结果说明,菌株XH8的降酸能力最强,其次是菌株XH10,菌株XH3和菌株XH15的降酸能力较弱。但是由于菌株XH8耐受乙醇能力较差,所以最终选择菌株XH3为葡萄酒潜在酿造菌株。
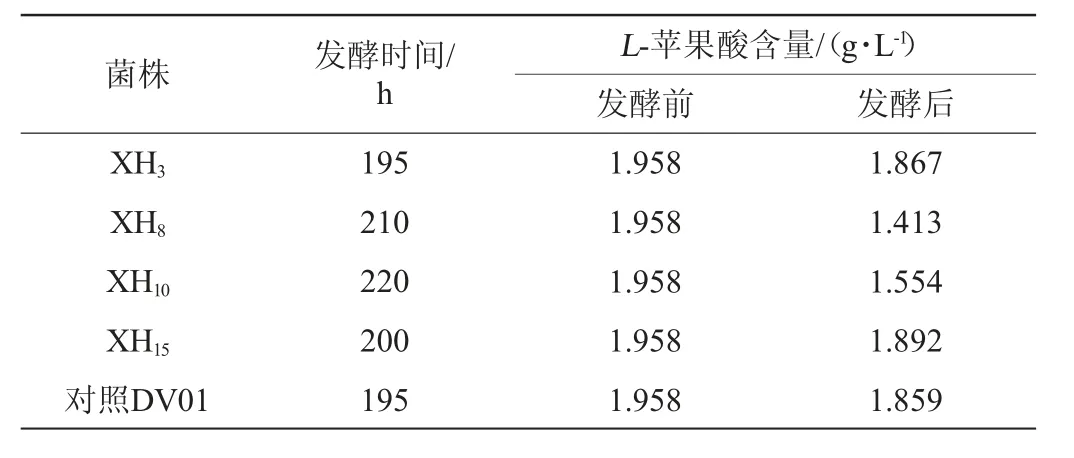
表3 4株降酸酵母菌降解L-苹果酸的测定结果Table 3 Results of degradation of L-malic acid of 4 acid-reducing yeasts
3 结论
该研究从分离于夏黑葡萄自然发酵液的20株酵母菌中筛选出了4株具有L-苹果酸降解能力的酵母菌,其中菌株XH8降酸能力最强,其次为菌株XH10,菌株XH3和XH15降酸能力稍弱;菌株XH3具有较好的发酵特性,较好的葡萄糖、乙醇和SO2耐受性,且完整细胞具有较高的β-葡萄糖苷酶活;菌株XH8具有较好的葡萄糖和SO2耐受性、较强的L-苹果酸降解能力,以及较高的胞内β-葡萄糖苷酶活。综上,酵母菌XH3可作为葡萄酒酿造的潜在菌株。本研究对开发新酵母菌资源和提高葡萄酒品质具有重要意义。

