基于网络药理学探讨巴蜀颗粒防治新型冠状病毒肺炎的潜在物质基础初探
古丽再帕尔·托合尼亚孜, 陈 伟, 王 楠, 马 芹
(1新疆医科大学药学院, 乌鲁木齐 830017; 2新疆华世丹药物研究有限责任公司, 乌鲁木齐 830011)
新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)是由新型冠状病毒(SARS-CoV-2)感染导致的肺炎,是一种急性呼吸道传染病,以发热、干咳、乏力等为主要表现,少数患者会伴有鼻塞、流涕等上呼吸道症状,重症患者可出现全身炎症反应综合征(SIRS)、急性呼吸窘迫综合征(ARDS)等[1]。SARS-CoV-2入侵人体细胞过程中,病毒膜衣壳上的刺突蛋白(S蛋白)与人血管紧张素转换酶2(ACE2)作为受体结合完成附着,进入细胞后基因组释放到胞质中,开始编码能精确剪切复制酶多肽的剪切酶,即为木瓜蛋白酶样蛋白酶(PLpro)和3C样蛋白酶(3CLpro)[2-5]。这些蛋白在SARS-CoV-2的治病过程中发挥着至关重要的作用。SARS-CoV-2入侵人体后患者血浆中细胞因子和趋化因子水平显著上升,即产生炎症因子风暴[6]。巴蜀颗粒由巴旦仁、蜀葵子、神香草、睡莲花、甘草浸膏、阿拉伯胶6种药材组成,临床上多用于感冒、咳嗽、痰多及哮喘的治疗。巴旦仁、蜀葵子和甘草浸膏可解表散寒,宣肺止咳,润喉解渴共为君药;神香草、 睡莲花疏散风寒,祛痰平喘,散气止痛共为臣药;阿拉伯胶宣肺下气、止咳化痰、利咽止痛共为佐药;甘草浸膏又兼使药,诸药相须相佐,相辅相成,共奏辛温解表,宣肺散邪之功。诸药合用具有解表散寒、调节异常气质、止咳祛痰、宣肺止喘、利咽止痛之功效。本研究通过网络药理学、分子对接和细胞炎症模型初步探究巴蜀颗粒治疗COVID-19的活性成分物质基础,揭示其作用机制和相关信号通路。
1 材料与方法
1.1 材料中药系统药理学数据库(Traditional Chinese Medicine Systems Pharmacology Database, TCMSP),中医药整合药理学研究平台(Integrative Pharmacology-based Research Platform of Traditional Chinese Medicine,TCMIP),Bioinformatics Analysis Tool for Molecular mechanismof Traditional Chinese Medicine,BATMAN-TCM),中药药理数据库(Traditional Chinese Medicines Integrated Database,TCMID),UniProt数据库,疾病数据库(GeneCard、OMIM、PharmGkb、TTD、DrugBank),String数据库、Pubchem数据库。AutoTools(1.5.7版)、PyMOL(1.0.0版)、Cytoscape(3.8.0版)网络分析软件,Imag软件,raphPadPrism8软件。Raw264.7细胞(武汉普诺赛生命科技有限公司),巴蜀颗粒(华世丹药物研究有限责任公司);RPMI-1640培养基(Gibco公司),胎牛血清(浙江天杭生物科技股份有限公司),LPS(Sigma-Aldrich公司),槲皮素、山奈酚、木犀草素(中国食品药品检定研究院),BCA蛋白测定试剂盒(武汉博士德生物工程有限公司),Phospho-NF-κBp65抗体、NF-κB p65抗体(AffinityBioscienc公司),iNOS抗体、β-actin抗体(Boster Biological Technology公司)。
1.2 巴蜀颗粒中6种药材的成分收集与筛选通过TCMSP、TCMIP、BATMAN-TCM、TCMID数据库分别搜索巴蜀颗粒6种药材中的化学成分,其中巴旦仁、蜀葵子、神香草、睡莲花、阿拉伯胶未完整收录于这4个数据库中,故采用在中国知网上查询已发表的相关文献来进行化学成分搜集,以药物口服生物利用度(OB)≥30%,类药性(DL)≥0.18作为筛选标准来选出巴蜀颗粒中的有效成分群,然后再通过数据库寻找该成份。
1.3 巴蜀颗粒中生物活性成分的靶点预测通过利用TCMSP数据库的靶点预测功能搜集出巴蜀颗粒中所含有化学成分的靶点蛋白,再用UniProt数据库对所预测的潜在靶点以“Homo sapiens”筛选并进行基因-蛋白名称转化,即将全部蛋白名称转换为基因标准化的名称。
1.4 新型冠状病毒肺炎发病相关基因靶点的获取在GeneCard、OMIM、PharmGkb、TTD、DrugBank等疾病数据库中以“COVID-19、SARS-Cov-2、Novelcoronavirus”为关键词搜集已知的与新冠病毒肺炎感染及发病相关的靶点基因的搜集和筛选,删除重复的基因,构建新冠病毒肺炎相关基因数据库。
1.5 构建巴蜀颗粒颗粒药物-成分-点网络与PPI网络将“1.3”项下中的药物成分相关基因与“1.4”项下中的发病相关靶基因取交集,通过String数据库对这些共同的交集基因进行蛋白-蛋白相互作用分析。对置信度得分≥0.95设定阈值,对蛋白相互作用进行筛选。以“Human Sapiens”为关键词筛选得到COVID-19感染及发病相关的主要靶基因,构建成蛋白-蛋白相互作用的网络图。采用Cytoscape 3.8.0软件进行药物-成分-靶点-疾病网络的构建与可视化,通过Bisogenet插件对潜在靶点进行蛋白互作网络(PPI)的构建,绘制核心蛋白互作网络图。
1.6 GO富集分析与KEGG通路富集分析采用Rx64软件对“1.5”项下获得的潜在靶点交集进行基因本体论富集分析(GO)和京都基因与基因组百科全书信号通路富集(KEGG)分析,设定阈值P≤0.05, 筛选具有显著性差异的生物过程和靶点,P值越小,表明富集显著程度越高。
1.7 核心成分-靶点分子对接通过PubChem数据库将“药物-成分-靶点网络图”中的关键活性成分的2D结构式下载下来后,用Chem3D软件进行3D优化,使结构式能量最小化作为对接配体。再把COVID-19感染发病相关的3CLpro、ACE2、PLpro蛋白靶点分子结构在PDB数据库中找到,用AutoTools 对其晶体结构蛋白进行预处理,计算电荷,作为用于做分子对接的受体。得到的配体和受体使用Autodock Vina进行对接,再用PyMOL软件对其分子对接结果进行构象作图。
1.8 巴蜀颗粒和活性成分对LPS刺激的巨噬细胞炎症调控蛋白的影响将Raw264.7细胞以每孔1×106个接种至6孔板,培养8h,贴壁,分为8组:空白组、LPS刺激组、巴蜀颗粒(高、中、低剂量)和LPS共刺激组、槲皮素和LPS共刺激组、山奈酚和LPS共刺激组、木犀草素和LPS共刺激组。在对应组别中分别加入巴蜀颗粒(高剂量200 μg/mL、中剂量100 μg/mL、低剂量10 μg/mL)、槲皮素、山奈酚、木犀草素终浓度10 μg/mL的药物溶液孵育0.5 h,再加入终浓度5 μg/mL LPS溶液,孵育24 h后,弃去上清,加入细胞裂解液,用BCA法对每组进行蛋白总浓度检测。加入上样缓冲液,100℃煮样10 min,以每组总蛋白蛋白上样量为20 μg,逐个加入至10% SDS-PAGE凝胶样品槽内,进行Western-blot蛋白检测;用凝胶成像系统曝光成像,将曝光后的条带用 ImageJ 软件进行灰度值分析,Graph Pad Prism8软件进行t检验分析。
2 结果
2.1 巴蜀颗粒中药物的活性成分与靶点检索到巴蜀颗粒中6种中药化学成分共144个,其中巴旦仁26个,甘草92个,蜀葵子11个,神香草7个,睡莲花8个。通过TCMSP数据库4查询作用靶点,去除重复的成分和靶点后共获得药物成分115个,靶点295个。通过Uniprot数据库中的人属基因-蛋白名称转化后得到的巴蜀颗粒中活性成分的靶点238个,筛选出对应的活性成分101个。
2.2 新型冠状病毒肺炎相关基因按照“1.4”项下方法在5个疾病数据库中搜集COVID-19相关基因靶点,其中GeneCards数据库1 812个,PharmGkb数据库8个,Drugbank数据库25个,OMIM数据库2个,TTD数据库67个。除去重复的基因靶点,共获得1879个相关疾病基因靶点,见图1。

图1 新型冠状病毒肺炎相关基因韦恩图
2.3 巴蜀颗粒治疗COVID-19的潜在基因将巴蜀颗粒活性化成分相关基因与COVID-19发病相关基因取交集,共获得巴蜀颗粒治疗新型冠状病毒肺炎的潜在基因66个,见图2。

图2 巴蜀颗粒与新冠肺炎基因交集韦恩图
2.4 巴蜀颗粒治疗COVID-19的药物成分-靶点-疾病网络将药物成分相关基因与发病相关靶基因取交集后的基因与药物成分导入到Cytoscape软件中,构建药物成分-靶点-疾病网络图。网络图中有167个节点,751条边。根据网络的拓扑学性质度值排序确定关键节点,度值大于等于2倍中位数的成分有3个,见表1;基因有14个,分别是ESR1、AR、NOS2、RELA、F10、GSK3B、SCN5A、DPP4、F2、BCL2、TNF、AKT1、HMOX1、SLC6A4,为网络中的较关键的基因节点是网络中关键的基因节点,见图3。

表1 巴蜀颗粒治疗新冠肺炎潜在活性成分

图3 巴蜀颗粒治疗新冠肺炎的药物成分-靶点-疾病网络图
2.5 蛋白相互作用网络分析通过String数据库对66个共同的交集基因进行蛋白-蛋白相互作用分析,再对关键靶点进行蛋白相互作用网络的构建,根据网络的拓扑学性质筛选出核心网络,见图4-7。蛋白互作网络中最终筛选出核心蛋白有STAT3、MAPK1、JAK1、IL-2。

图4 巴蜀颗粒与新冠肺炎交集基因的PPI网络图
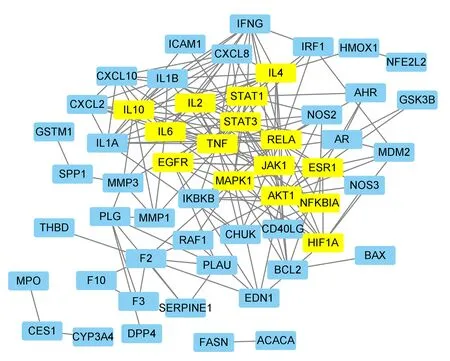
图5 靶点蛋白相互作用网络图

图6 一次筛选后的蛋白相互作用网络图

图7 二次筛选后的蛋白相互作用网络图
2.6 GO富集分析运用Bioconductor 生信软件包,借助R语言对66个交集靶点基因进行GO功能富集分析,2 140个GO项被显著富集(P<0.001),其中2 041项在生物过程(Biological Process,BP)中,17项在细胞组成(Cell Component,CC)中,82个在分子功能(Molecular Function,MF)中,见图8。

图8 巴蜀颗粒治疗新冠肺炎作用靶点的GO富集分析
2.7 KEGG通路富集分析运用Rx64对获得的66个交集靶点基因进行KEGG通路富集分析,得到148条信号通路(P<0.001),见图9。分析巴蜀颗粒治疗新冠肺炎作用靶点的前30个基因通路中发现包含有hsa05171:冠状病毒病-新型冠状病毒肺炎、hsa05164:甲型流感病毒病、hsa05167:卡波西肉瘤-相关的疱疹病毒感染、hsa05163:人巨细胞病毒感染、hsa05160:丙型肝炎、hsa05162:麻疹、hsa05161:乙型肝炎、hsa05169:爱泼斯坦-巴尔病毒感染等多种病毒引起疾病相关信号通路;包含一些寄生虫和细菌感染引起的疾病相关信号通路;以及hsa04064:NF-κB信号通路、hsa04657:白细胞介素-17信号通路、hsa04668:TNF信号通路、hsa04620:Toll样受体信号通路、hsa04660:T细胞受体信号通路等炎症相关信号通路。

图9 巴蜀颗粒治疗新冠肺炎作用靶点的KEGG富集分析
2.8 核心成分-靶点分子对接一般认为配体与受体结合的构象稳定时能量越低,发生作用的可能性越大。3CLpro与临床推荐药物Paxlovid的分子对接结合能为-7.0 kcal/mol,本研究选择的槲皮素、山奈酚、木犀草素3个活性成分与受体蛋白的结合能均小于-7.0 kcal/mol,表明以上3个活性成分有着治疗新冠肺炎的潜力,见表2。

表2 巴蜀颗粒活性成分作用于COVID-19中靶点的分子对接位点及结合能
2.9 巴蜀颗粒和筛选潜在成分对LPS刺激的巨噬细胞iNOS、p65调控蛋白的影响选择NOS2(iNOS)和RELA(p65)进行Western-blot蛋白检测,结果表明巴蜀颗粒高、中、低剂量组均可降低由LPS刺激而增多的iNOS的表达量,还可以降低p65蛋白的磷酸化,且具有剂量依赖性,见图10-12。3个活性成分的对照组iNOS和p-p65蛋白的表达量降低,差异均具有显著性,见图13-15。

图10 巴蜀颗粒对iNOS、p-65蛋白调控电泳图

图11 巴蜀颗粒对iNOS蛋白表达量变化的影响

图12 巴蜀颗粒对p-p65/p65蛋白表达量变化的影响

图13 活性成分对iNOS、p-65蛋白调控电泳图
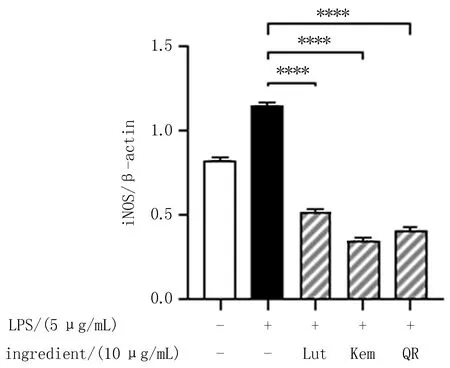
图14 活性成分对iNOS蛋白表达量变化的影响

图15 活性成分对p-p65/p65蛋白表达量变化的影响
3 讨论
新冠肺炎成为世界性流行病。金花清感颗粒、莲花清温胶囊、清肺解毒汤、宣肺败毒颗粒、化湿败毒颗粒等中药在新冠肺炎的防治中发挥了重要的作用。研究发现可结合分子生物学、网络药理学和分子对接分析用来探索中药方剂治疗新冠肺炎的潜在分子机制[7]。本课题组前期研究发现复方巴旦仁颗粒含有大量黄酮类成分如槲皮素、山奈素和鼠李糖苷,对小鼠有明显的止咳化痰作用[8]。
本研究通过细胞炎症模型验证巴蜀颗粒对iNOS表达和p65蛋白磷酸化有显著抑制作用。新冠病毒复制触发单核细胞、巨噬细胞、粒细胞的活化,导致细胞因子风暴,大量分泌包括IL-1、IL-2、IL-6、IL-8、IL-12、TNF-α的促炎细胞因子,趋化因子等,进而导致组织的重度炎症和组织纤维化及肺炎[9-10]。SARS-CoV-2感染会触发NF-κB和Toll样受体信号通路的激活,以诱导氧化应激和超炎症反应,最终导致急性肺损伤,即可认为炎症治疗在COVID-19治疗中至关重要[11]。网络药理学与分子对接的方法,以分子对接中配体分子与受体蛋白之间的最优结合能小于SARS-Cov-2的临床推荐化学药物为条件选择出巴蜀颗粒治疗COVID-19的活性成分,槲皮素、山奈酚和木犀草素是巴蜀颗粒治疗新冠肺炎最新变异株奥密克戎感染引起症状的潜在物质基础。以上3个活性成分均为天然的黄酮类化合物,具有较强的抗病毒[12-14]、抗炎[15-17]、抗菌[18]、抗癌[19-21]、抗氧化[22-23]等药理作用。槲皮素可通过调节T淋巴细胞的作用改善肺纤维化大鼠的气道高反应,使肺纤维化大鼠血清中IL-17表达降低,进而对肺纤维化气道有较好的治疗效果[24]。山奈酚参与抑制一氧化氮和iNOS水平,而一氧化氮和iNOS水平是导致炎症的氧化应激的关键介质[25]。木犀草素的处理可以抑制NF-κB信号通路中IκB激酶β亚基磷酸化,下调TNF-α、IL-6的mRNA水平[26]。本研究结果显示巴蜀颗粒中的活性成分具有抑制巨噬细胞炎症反应的作用。

