CircHIPK3在三阴性乳腺癌患者中的表达及对生物学行为影响
周晓静, 张 超, 李娟娟, 袁 媛, 孙伟莉, 李卫鹏
(蚌埠医学院1第一附属医院核医学科, 2肿瘤外科, 3第二附属医院消化内科, 安徽 蚌埠 233004)
三阴性乳腺癌(Triple negative breast cancer,TNBC)患者因缺乏雌激素受体(Estrogen receptor,ER)、孕激素受体(Progesterone receptor,PR)和人表皮生长因子受体2(Human epidermal growth factor receptor 2,HER2),在组织学类型、自然病程、临床行为及治疗反应方面多样化,目前仍缺乏有效的靶向治疗方式,因此寻找可有效诊断、治疗TNBC的生物标志物及靶分子是亟待解决的问题[1-2]。环状RNA(Circular RNA,circRNA)是新近发现的无5′和3′端的共价闭合非编码RNA分子,结构非常稳定,能有效对抗核酸外切酶介导的降解,通过调节基因的表达成为各种病理和细胞生理学的关键调节因子,还通过充当RNA结合蛋白和微小RNA(Micro RNA)的海绵调节转录后的基因表达[3],成为多种疾病诊断和预后生物标志物的研究热点。有研究发现,circRNA参与乳腺癌在内的多种癌症的发生发展,为TNBC靶点的研究提供了新的途径[4-5]。同源结构域相关的蛋白激酶(Homeodomain interacting protein kinase,HIPK)属于核蛋白激酶家族,HIPK3为HIPK家族的亚型,circHIPK3起源于HIPK3基因的外显子2,其同源结构域相互作用蛋白激酶3,与卵巢癌、膀胱癌、鼻咽癌、结直肠癌、肺癌、胆囊癌等人类癌症有关,且被验证作为miRNA的海绵调节基因调节细胞的增殖、迁移和侵袭[6-7]。
本课题组在前期研究中通过RNA-seq技术证实circHIPK3在人体不同组织中表达丰富且稳定,但其对TNBC进程的影响尚未明确。故本研究将探讨circHIPK3在TNBC患者中的表达及对生物学行为的影响,以期为TNBC的研究提供新的思考。
1 材料与方法
1.1 临床样本收集选取2019年1月至2022年12月收治的TNBC患者124例及乳腺良性肿瘤(乳腺囊性增生和乳腺纤维腺瘤)患者50例,均经穿刺或手术病理检查确诊,获取TNBC组织和癌旁组织及乳腺良性肿瘤组织标本,大小约0.5 cm×0.5 cm×0.5 cm,经PBS冲洗后于液氮中保存。纳入病例均为女性,年龄26~83岁,平均年龄(50.98±10.20)岁;TNM分期:Ⅰ期39例,Ⅱ期56例,Ⅲ期29例;新辅助化疗方案:TEC方案,第1天,多西他赛75 mg/m2,多柔比星50 mg/m2,环磷酰胺500 mg/m2,21 d为一周期[8]。研究均获取患者知情同意书,且获得医院伦理委员会批准。
1.2 细胞、主要试剂及仪器
1.2.1 细胞 正常乳腺上皮细胞MCF-10A和TNBC细胞系BT-549、MDA-MB -231和MDA-MB-468,均从American Type Culture Collection(ATCC)购买。
1.2.2 主要试剂 10%胎牛血清、青/链双抗、0.25%胰酶、L-15和H-DMEM培养基(北京索莱宝生物科技有限公司)DMSO、PBS(杭州晓柚生物科技有限公司),Trizol RNA抽提试剂盒、TB GreenTMPremix Ex Taq TM II试剂盒(上海生工生物工程技术服务有限公司)、Edu试剂盒、CCK-8试剂盒、Tunel试剂盒、Hoechst33342试剂(上海雅吉生物科技有限公司),LipofectamineTM2000阳离子脂质体、circHIPK3模拟物和circHIPK3抑制剂(上海GENECHEM有限公司)。
1.2.3 主要仪器 M500荧光显微镜(美国Thermo公司)、CO2培养箱(赛默飞世尔科技中国有限公司)、冰箱(-20℃,4℃)(Haier,HXC-158型)、酶标仪(杭州联科生物技术股份有限公司)、7500实时荧光定量PCR系统(美国Applied Biosystems公司)、transwell小室(8 μm,上海诺娃医药科技有限公司)。
1.3 细胞培养、转染及分组MCF-10A、MDA-MB-231使用H-DMEM培养基,MDA-MB-468使用L-15培养基,均添加10%胎牛血清和1%青/链双抗,37℃、5% CO2环境下培养。MDA-MB-468细胞使用LipofectamineTM2000阳离子脂质体分别转染circHIPK3模拟物和circHIPK3抑制剂,分别作为circHIPK3过表达组和circHIPK3抑制组,另取未转染circHIPK3的MDA-MB-468细胞为空白对照组。
1.4 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测circHIPK3表达TNBC组织、癌旁组织、乳腺良性肿瘤组织、未转染的MCF-10A和TNBC细胞系(BT-549、MDA-MB -231和MDA-MB-468)及转染48 h的MDA-MB-468细胞,使用TRIzol试剂盒提取总RNA,逆转录为cDNA,使用TB GreenTMPremix Ex Taq TM II,并以cDNA为模板进行qRT-PCR为反应液配置。扩增,进行预变性、变性、退火和延伸(条件:95℃/3 min,95℃/5 s,60℃/30 s、72℃/30 s),40个循环,单样品设三复孔,GAPDH为内参,紫外线下观察电泳结果,以2-△△ct法计算目的基因相对表达量。
1.5 CCK-8、克隆形成实验以及EdU实验检测细胞增殖能力
1.5.1 CCK-8 各组MDA-MB-468细胞转染48 h后以1×104个/mL接种于96孔板,加入10%浓度CCK-8试剂,以酶标仪检测450 nm处光密度(OD)值,分别记录24 h、48 h、72 h和96 h的OD值,绘制生长曲线。
1.5.2 克隆形成实验转染后的细胞 经0.25%胰酶消化,10%FBS的DMEM培养基重悬,以1×104个/mL接种于6孔板,37℃、5% CO2、饱和湿度环境下培养,2~3周后以4%多聚甲醛固定,1%结晶紫染色,低倍显微镜下拍照记录细胞克隆数量。
1.5.3 EdU实验细胞 转染48 h接种于24孔板(含爬片)中,培养箱内常规培养,每孔加入1 000∶1比例稀释的Edu溶液稀释(200 μL/孔),培养箱内孵育2 h,PBS清洗,加入细胞固定液孵育30 min,吸净固定液后加入甘氨酸(200 μL/孔),摇床孵育5 min,PBS洗涤后,加入0.5% TritonX-100(200 μL/孔),摇床孵育10 min,加入Apollo染色液200 μL,室温下避光脱色摇床孵育30 min,吸净反应液加入5% TritonX-100,脱色摇床清洗2次,后加入甲醇,PBS清洗加入33342染色液,避光孵育30 min,弃液,洗涤,取出爬片并封片,荧光显微镜下观察细胞增殖情况并摄片分析。
1.6 Transwell和划痕实验检测细胞侵袭、迁移能力
1.6.1 Transwell Matrigel 基质胶1∶40稀释液50 μL铺于Transwell小室上室,轻轻混匀后风干过夜,对数生长期细胞以1×104个/mL孔移入Transwell上室,下层加入完全培养基,5% CO2培养箱中孵育24 h,加入甲醛室温固定20 min,然后用结晶紫染色,PBS充分清洗后,显微镜下选3个视野拍照并计数。
1.6.2 划痕实验 各组细胞以1×104个/mL接种于96孔板,长满单层后,弃去培养基,使用200 μL枪头划痕,PBS轻柔洗涤3次,每孔依次加入DMEM培养液(不含胎牛血清),24 h后以倒置显微镜观察细胞迁移情况,根据0 h和24 h划痕距离差值计算迁移率。
1.7 TUNEL和Hoechst 33342染色检测细胞凋亡情况
1.7.1 TUNEL细胞 接种于24孔板中,37℃、5% CO2培养24 h后弃培养基,PBS清洗,室温下4%多聚甲醛固定,弃液,冰上通透2 min,清洗,染色,孵育,弃液,洗涤,抗荧光淬灭封片液进行封片,荧光显微镜下观察拍照。
1.7.2 Hoechst 33342染色转染后的六孔板细胞 接种于含爬片的24 孔板中,培养到细胞密度达到60%时,弃培养基,PBS清洗,室温下4%多聚甲醛固定,弃液,PBS清洗。取200 μL Hoechst 33342染色液加入各孔中,置于37℃避光孵育15 min,弃染色液,PBS清洗细胞,封片,荧光显微镜下用紫外光激发观察并拍照,随机选取视野,计算凋亡细胞数和细胞总数,计算凋亡率。

2 结果
2.1 CircHIPK3在TNBC组织和癌旁组织中的表达比较TNBC组织、癌旁组织及与乳腺良性肿瘤组织的circHIPK3相对表达量比较,差异有统计学意义(P<0.05);与TNBC组织比较,癌旁组织及乳腺良性肿瘤组织的circHIPK3相对表达量更低(P<0.05);与癌旁组织比较,乳腺良性肿瘤组织的circHIPK3相对表达量更低(P<0.05)。见表1、图1。

图1 CircHIPK3在TNBC组织和癌旁组织中的表达

表1 CircHIPK3在TNBC组织和癌旁组织中的表达
2.2 CircHIPK3在正常乳腺上皮细胞和TNBC细胞中的表达CircHIPK3在正常乳腺上皮细胞和TNBC细胞中的表达差异具有统计学意义(P<0.05)。与MCF-10A细胞比较,BT-549、MDA-MB -231和MDA-MB-468细胞的circHIPK3相对表达量上升(P<0.05),见表2、图2。

图2 正常乳腺上皮细胞和TNBC细胞中circHIPK3的表达

表2 CircHIPK3在正常乳腺上皮细胞和TNBC细胞中的表达
2.3 CircHIPK3对MDA-MB-468细胞增殖能力的影响CircHIPK3模拟物及抑制剂转染至MDA-MB-468细胞后,CCK-8实验结果显示:各组细胞48 h、72 h和96 h的增殖活性差异有统计学意义(P<0.05);与空白对照组和circHIPK3抑制组比较,circHIPK3过表达组48 h、72 h及96 h的增殖活性升高(P<0.05);与空白对照组比较,circHIPK3抑制组48 h、72 h及96 h的增殖活性下降(P<0.05)。克隆实验显示:各组细胞克隆数目差异有统计学意义(P<0.05);与空白对照组和circHIPK3抑制组比较,circHIPK3过表达组的克隆数目增加(P<0.05);与空白对照组比较,circHIPK3抑制组的克隆数目下降(P<0.05)。EdU实验显示:各组细胞的EdU/DAPI比值差异具有统计学意义(P<0.05);与空白对照组和circHIPK3抑制组比较,circHIPK3过表达组EdU/DAPI比值升高(P<0.05);与空白对照组比较,circHIPK3抑制组的EdU/DAPI比值下降(P<0.05)。见表3、图3。
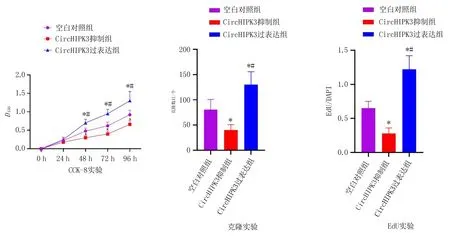
图3 CircHIPK3对MDA-MB-468细胞增殖能力的影响

表3 CircHIPK3对MDA-MB-468细胞增殖能力的影响
2.4 CircHIPK3对MDA-MB-468细胞侵袭、迁移能力的影响Transwell实验显示:各组细胞侵袭数目差异有统计学意义(P<0.05);与空白对照组和circHIPK3抑制组比较,circHIPK3过表达组的侵袭数目增加(P<0.05);与空白对照组比较,circHIPK3抑制组的侵袭数目下降(P<0.05)。划痕实验显示:各组细胞迁移率差异有统计学意义(P<0.05);与空白对照组和circHIPK3抑制组比较,circHIPK3过表达组的迁移率增加(P<0.05);与空白对照组比较,circHIPK3抑制组的迁移率下降(P<0.05)。见表4、图4。

表4 CircHIPK3对MDA-MB-468细胞侵袭、迁移能力的影响
2.5 CircHIPK3对MDA-MB-468细胞凋亡的影响Tunel实验显示:各组细胞凋亡率差异有统计学意义(P<0.05);与空白对照组和circHIPK3抑制组比较,circHIPK3过表达组的凋亡率下降(P<0.05);与空白对照组比较,circHIPK3抑制组的凋亡率升高(P<0.05)。Hoechst33342染色显示:相较于空白对照组和circHIPK3抑制组,circHIPK3过表达组的无明显细胞核碎裂,凋亡程度最轻,circHIPK3过表达组、抑制剂组细胞核碎裂浓染,细胞质皱缩高亮荧光更加明显。见表5、图5。

a

表5 CircHIPK3对MDA-MB-468细胞凋亡的影响
3 讨论
据2020年全球癌症数据统计,女性乳腺癌发病率已超过肺癌,成为最常见的癌症之一[9]。2019年约有230万的新发乳腺癌病例,死亡病例超过68.5万,预计到2040年,随着人口的增长和老龄化,乳腺癌负担将增加到每年300多万新发病例和100多万死亡病例,对全球癌症死亡人数产生巨大影响[10]。TNBC占所有乳腺癌病例的10%~15%,占新诊断乳腺癌的1%~2%,作为一种特别侵袭性乳腺癌,与其他亚型相比预后通常较差,其死亡率占所有癌症相关死亡的6%[11]。TNBC目前尚无明确的治疗靶点,对内分泌治疗及靶向治疗无效,且部分患者对目前可选择的化疗方案耐药而出现治疗失败[12],严重影响患者的生命健康,因此寻找TNBC的有效治疗靶点成为临床的研究热点。
多项研究表明,circRNA分子富集含miRNA的结合位点,能调节靶基因上miRNA的活性,解除miRNA对其靶基因的抑制,具有竞争性内源RNA的作用[13-15]。此外circRNA还可规范转录或剪接,与RNA结合蛋白相互作用,参与翻译,调节表观遗传的改变,运输物质和信息,因此成为包括恶性肿瘤在内的多种疾病研究热点。HIPK3基因第2个外显子循环化产生circHIPK3,在心、脑、肺等多种器官和组织的细胞中大量表达[16],其两侧的长内含子中,51个重复序列处于第三外显子下游,28个短散在重复序列处于第2外显子上游,能互补Alu重复序列,促进HIPK3的循环化[17]。Zheng等[18]研究证实,circHIPK3具有18个miRNA的直接结合位点和3个潜在结合位点,说明circHIPK3具能通过海绵作用参与介导细胞的生长、增殖和迁移。本课题组前期的研究中对人TNBC组织和癌旁组织进行RNA测序,以差异倍数>2、P<0.05为筛选标准,筛选出circHIPK3在TNBC中和癌旁组织中差异表达,通过qRT-PCR进一步验证,TNBC患者病灶组织的circHIPK3表达量高于癌旁组织及乳腺良性肿瘤组织,癌旁组织高于乳腺良性肿瘤组织,且体外细胞研究证实TNBC细胞系中circHIPK3的表达量高于正常乳腺上皮细胞,说明circHIPK3的异常高表达与TNBC的发生有关。
在恶性肿瘤的发生、发展过程中,以细胞的异常增殖和转移为主要特点,癌细胞的侵袭是治疗失败和癌症患者死亡的重要原因,因此对癌细胞增殖、迁移、侵袭能力的抑制和促凋亡是衡量抑癌能力的重要标准。Yu等[19]研究发现,circHIPK3能促进细胞的存活和增殖,作为miR-124海绵调节非小细胞肺癌的下游靶标水平。Chen等[20]研究证实沉默circHIPK3能抑制非小细胞肺癌的增殖、迁移、侵袭和诱导自噬能力,circHIPK3和线性HIPK3之间具有自噬拮抗调节作用。此外circHIPK3能通过竞争性内源RNA机制介导癌细胞的增殖、迁移、侵袭和谷氨分解,增加致瘤能力[21]。Liu等[22]研究证实,在胰腺癌细胞中circHIPK3通过促海绵化miRNA-330-5p增加对吉西他滨的耐药性,调节胰腺癌细胞的增殖、侵袭、迁移和细胞凋亡。而在本研究中,通过脂质体转染法对MDA-MB-468细胞转染circHIPK3模拟物和抑制剂,结果显示circHIPK3的过表达能促进MDA-MB-468细胞的增殖、侵袭和迁移,抑制其凋亡,而抑制circHIPK3的表达后MDA-MB-468细胞的增殖、侵袭和迁移下降,凋亡水平增加,这说明TNBC细胞中circHIPK3的高表达能促进肿瘤的发展,与在肺癌及胰腺癌中的作用一致。
综上所述,circHIPK3在TNBC患者中和TNBC细胞中高表达,其异常高表达可促进TNBC细胞的增殖、侵袭和迁移,抑制凋亡,而低表达的作用则相反,在TNBC的诊断、治疗及预后预测中具有较大的潜在价值。本研究证实了circHIPK3的高表达对TNBC的发生发展具有调节作用,具有作为TNBC研究靶点的潜在价值,不足之处在于未进一步验证其对TNBC发生发展的机制影响,后续将进一步使用测序技术及诸多生物学方法验证其具体机制,为TNBC诊疗的研究提供更进一步的参考。

