基于质量源于设计理念的调脂柔脉颗粒制备工艺研究
曹旸 张颖 赵小梅 屈琼 赵佩媛 张新博 杨志宏 段玺
(1.陕西中医药大学附属医院,陕西 咸阳 712000;2.陕西中医药大学,陕西 咸阳 712046)
调脂柔脉颗粒是由杨志宏主任医师根据多年临床经验总结出来的由大黄、苍术、生山楂、黄芪、葛根等十味药组成的一种全中药的心脑科应用药物,现有研究表明其在临床上可应用于脑动脉粥样硬化[1-2]、症状性颈动脉粥样硬化[3]等,药理实验研究表明其通过调节大鼠脂质代谢过程,改善颈部斑块情况,发挥抗动脉粥样硬化作用[4];通过降低高脂血症模型大鼠TC、TG、全血低切黏度、全血高切黏度以及ICAM-1基因的表达发挥抗高血脂的作用[5-6]。由于调脂柔脉颗粒的传统制法中并未过多考虑不同种类辅料及其用量对颗粒剂质量的影响,故本研究将质量源于设计(Quality by Design,QbD)理念应用于调脂柔脉颗粒的制备生产过程中,对所使用的辅料种类及用量进行优化分类,筛选出最优的辅料种类,优化其用量,得到最优的处方工艺,为中药处方颗粒剂的制备工艺设计提供参考。
QbD理念是由美国FDA于21世纪初提出的应用于药品管理的一种新观念,在药品监控系统中发挥着重要的作用,其主要是通过对药品处方的工艺设计来确定影响药品的关键质量属性(Critical quality attributes,CQAs)和关键工艺参数(Critical process parameters,CPPs),并通过CPPs的范围,达到保障药品安全、有效、质量可控的目的[7-8]。
1 仪器与材料
1.1仪器 见表1。

表1 实验所用的主要实验仪器
1.2药品与试剂 苍术饮片(产地:江苏,批号:211103,植物基原为菊科植物茅苍术Atractylodeslancea(Thunb.)DC.或北苍术Atractylodeschinensis(DC.)Koidz.的干燥根茎);山楂饮片(产地:河北,批号:210901048,植物基原为蔷薇科植物山里红CrataeguspinnatifidaBge.var.majorN.E.Br.或山楂CrataeguspinnatifidaBge.的干燥成熟果实);黄芪饮片(产地:甘肃,批号:G03220411-03,植物基原为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao或膜荚黄芪Astragalusmembranaceus(Fisch.)Bge.的干燥根;葛根饮片(产地:湖南,批号:20210301,植物基原为豆科植物野葛Puerarialobata(Willd.)Ohwi的干燥根);制何首乌饮片(产地:广西,批号:220301298,植物基原为蓼科植物何首乌PolygonummultiflorumThunb.的干燥块根);决明子饮片(产地:河北,批号:20220201,植物基原为豆科植物钝叶决明CassiaobtusifoliaL.或小决明CassiatoraL.的干燥成熟种子);丹参饮片(产地:山东,批号:220501,植物基原为唇形科植物丹参SalviamiltiorrhizaBge.的干燥根和根茎);天花粉饮片(产地:陕西,批号:211201,植物基原为葫芦科植物栝楼TrichosantheskirilowiiMaxim.或双边栝楼TrichosanthesrosthorniiHarms的干燥根);槐角饮片(产地:河南,批号:180601,植物基原为豆科植物槐SophorajaponicaL.的干燥成熟果实);大黄饮片(产地:甘肃,批号:S20220501,植物基源为蓼科植物掌叶大黄RheumpalmatumL.;唐古特大黄RheumtanguticumMaxim.ex Balf.或药用大黄RheumofficinaleBaill.的干燥根和根茎),经陕西中医药大学胡本祥教授鉴定均符合《中国药典》2020年版饮片标准[9];糊精(批号 20181101,天津大茂化学试剂厂);微晶纤维素(批号 20190404,国药集团化学试剂有限公司);α-乳糖(批号 20160829,天津市科密欧化学试剂有限公司);无水乙醇(批号 2206073601,安徽安特食品股份有限公司);大黄酚(批号PSO11322,成都普思生物科技有限公司,质量分数>98%);丹酚酸A(批号 PS020493,成都普思生物科技有限公司,质量分数>98%)。
2 方法与结果
2.1风险评估 风险评价包括分析、识别和评价,是质量管理的重要组成部分[10],采用鱼骨图对调脂柔脉制粒工艺的影响因素进行评价和分析,通过预实验的情况分析风险因素主要分为工艺因素、处方因素和环境因素三个方面,其对调脂柔脉颗粒的成型和成型后的颗粒质量有一定的影响[11]。运用失效模式与效应分析(Failure mode and effect analysis,FMEA)对其风险因子进行了深入的分析[12-15],分别从失效后的严重性(S)、发生失效的概率(P)、失效的可探测性(D)三个维度进行评价,每个指标的得分为1~4,并根据评价的结果,计算出风险的优先系数(RPN,RPN= S× P× D),结果见表2。其中RPN不超过8则表明该风险因素的影响低,9~16间影响中等,若其值不低于17则表明影响较高。通过该分析方法,筛选出对调脂柔脉颗粒制备过程中影响比较严重的因素有:所使用辅料中填充剂的类型、原辅料的比例以及润湿剂(无水乙醇)的浓度。

图1 调脂柔脉颗粒影响因素鱼骨图

表2 FMEA法对调脂柔脉颗粒制备风险因素的评估结果
2.2颗粒剂的制备 将调脂柔脉颗粒原处方中的大黄、黄芪、丹参、苍术等十味中药材粉碎,分别取30 g的药材粉末,共计300 g,加10倍量水煎煮两次,每次1 h,合并所得滤液,60 ℃下浓缩至相对密度1.12,向浓缩液中加入无水乙醇使药液中含醇量达60%,冷藏静置20 h,抽滤,回收乙醇,继续干燥成调脂柔脉干浸膏,将其粉碎成粗粉,密封保存备用。
采用湿法制粒法制备[16-17],称取约4 g调脂柔脉干浸膏粗粉,置于研钵中研细,全部过80目筛(5号),通过等量递增法将过80目筛的填充剂加入到调脂柔脉细粉中,继续研磨,使其均匀的混合在一起;加入足够润湿剂手动制备软材,根据“手握成团,触之即散”标准掌握软材质量,用16目的筛网制颗粒,将颗粒及时放于干燥箱中60 ℃下烘干,经14目筛整粒即得调脂柔脉颗粒。
2.3调脂柔脉颗粒处方工艺的筛选
2.3.1填充剂种类与配比的筛选 选择糊精、α-乳糖、微晶纤维素、α-乳糖和糊精混合辅料作为填充剂[18],将浸膏药粉分别与不同的填充剂混合均匀,加入一定量的润湿剂手制软材,用16目筛制粒,60 ℃烘干后用14目筛整粒后称重。考察制粒难易程度、颗粒性状、成型率等指标,筛选出最佳的填充剂,成型率(%)=(过筛后颗粒质量/过筛前颗粒质量)×100%,结果见表3。结果表明α-乳糖与糊精(1∶2)合用时易制粒且颗粒的成型率高,故确定其为最佳稀释剂。

表3 调脂柔脉颗粒填充剂种类与配比考察
2.3.2主药与辅料配比筛选 将浸膏药粉与α-乳糖和糊精的混合辅料按主药∶辅料(1∶1、1∶2、1∶3、1∶4)的比例混合制粒,结果见表4。结果表明当主药∶辅料(1∶3)时制得的颗粒性状最佳,成型率最好,故确定主药与辅料的最佳比例为干膏∶辅料1∶3)。

表4 调脂柔脉颗粒主药与辅料配比考察
2.3.3润湿剂浓度考察 将“2.3.1”和“2.3.2”项下确定的主药和辅料的种类、用量分别与不同浓度的乙醇(65%、70%、75%、80%)混合制粒[19],结果见表5。乙醇的体积分数为70%时制粒情况良好,不粘连且颗粒均匀,成型率最好,因此最终选择70%乙醇作为黏合剂。

表5 调脂柔脉颗粒润湿剂浓度考察
2.4制粒工艺中CQAs与CPPs的确定 基于对调脂柔脉颗粒制备工艺风险评估及分析,并结合上述实验过程中的分析结果,综合考虑当前实验条件下所有可控的且可能对实验结果造成影响的因素,最终以浸膏粉末用量、填充剂用量、润湿剂的用量为CQAs,以调脂柔脉颗粒的成型率、溶化性、有效成分的含量为CPPs。
2.5含量测定
2.5.1色谱条件 十八烷基硅烷键合硅胶色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.1%磷酸水溶液(B),梯度洗脱(0~15 min,40%A;15~30 min,40%~85%A;30~35 min,85%A;35~40 min,85%~40%A);流速:1.0 mL·min-1;柱温:25 ℃;进样体积10 μL,检测波长:274 nm。
2.5.2对照品溶液制备 精密称取大黄酚、丹酚酸A对照品适量,分别置于两个25 mL容量瓶中,加50%甲醇超声溶解后定容至刻度线,轻微震荡摇匀,即得含大黄酚0.0804 mg·mL-1、丹酚酸A 0.0608 mg·mL-1的对照品溶液。
2.5.3供试品溶液制备 精密称取适量调脂柔脉颗粒粉末于锥形瓶中,加入50%的甲醇溶解,采用超声处理(360 W,50 Hz,40 ℃)60 min后取出,冷却至室温,过滤至25 mL量瓶中,用50%的甲醇定容至刻度线,轻度摇匀,即得质量浓度为0.1504 g·mL-1的供试品溶液[20-21]。
2.5.4线性关系考察 分别精密吸取相同体积的大黄酚和丹酚酸A对照品溶液,用50%甲醇将其浓度逐倍稀释后制样,在“2.5.1”项下的色谱条件下注入高效液相色谱仪中进行测定,以峰面积(Y)为纵坐标,对照品溶液的质量浓度(X)为横坐标进行线性回归,得到大黄酚的线性方程为Y1=17.954X-0.0568,r=0.9998,丹酚酸A的线性方程为Y2=15.826X-0.0297,r=0.9992,根据实验结果,大黄酚在0.0004~0.0024 mg、丹酚酸A在0.0003~0.0018 mg范围内其质量浓度与峰面积线性关系良好,高效液相色谱图见图2。
2.6响应面分析
2.6.1Box-Behnken试验设计与结果 根据单因素实验结果,选择填充剂(糊精和α-乳糖合用)用量(A)、70%乙醇的用量(B)以及干燥温度(C)为关键工艺参数,设计三因素三水平试验,选择关键质量属性调脂柔脉颗粒中大黄酚的含量(Y1)、丹酚酸A的含量(Y2)、成型率(Y3)作为评价指标,筛选出最优参数,来研究探讨关键工艺参数与关键质量属性间的相关性[22-23],实验设计与结果见表6。
2.6.2回归模型的建立与分析 利用Design-Expert 10软件对实验数据进行拟合回归分析,得到Y1、Y2、Y3回归方程分别为
Y1=-3.28+0.173A+0.238B+0.0788C-0.00607A2-0.0163B2-0.000564C2-0.00175AB-0.000531AC-0.00075BC;
Y2=-4.56+0.188A+0.187B+0.117C-0.00768A2-0.0260B2-0.000937C2+0.00517AB-0.0.000819AC+0.00095BC;
Y3=-72.91+4.003A+1.746B+4.742C-0.376A2-0.0.055B2-0.0477C2+0.0958AB+0.086AC-0.00283BC。
通过分析,模型Y1、Y2、Y3均为二次多项式关系模型,并且与数据的拟合度好,误差低,可以用于进一步的分析与检测。对上述三个方程进行方差分析,结果见表7、表8、表9。
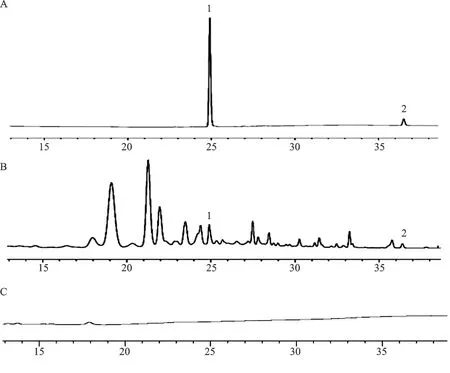
注:A.对照品; B.供试品;C.空白溶剂;1.丹酚酸A;2.大黄酚
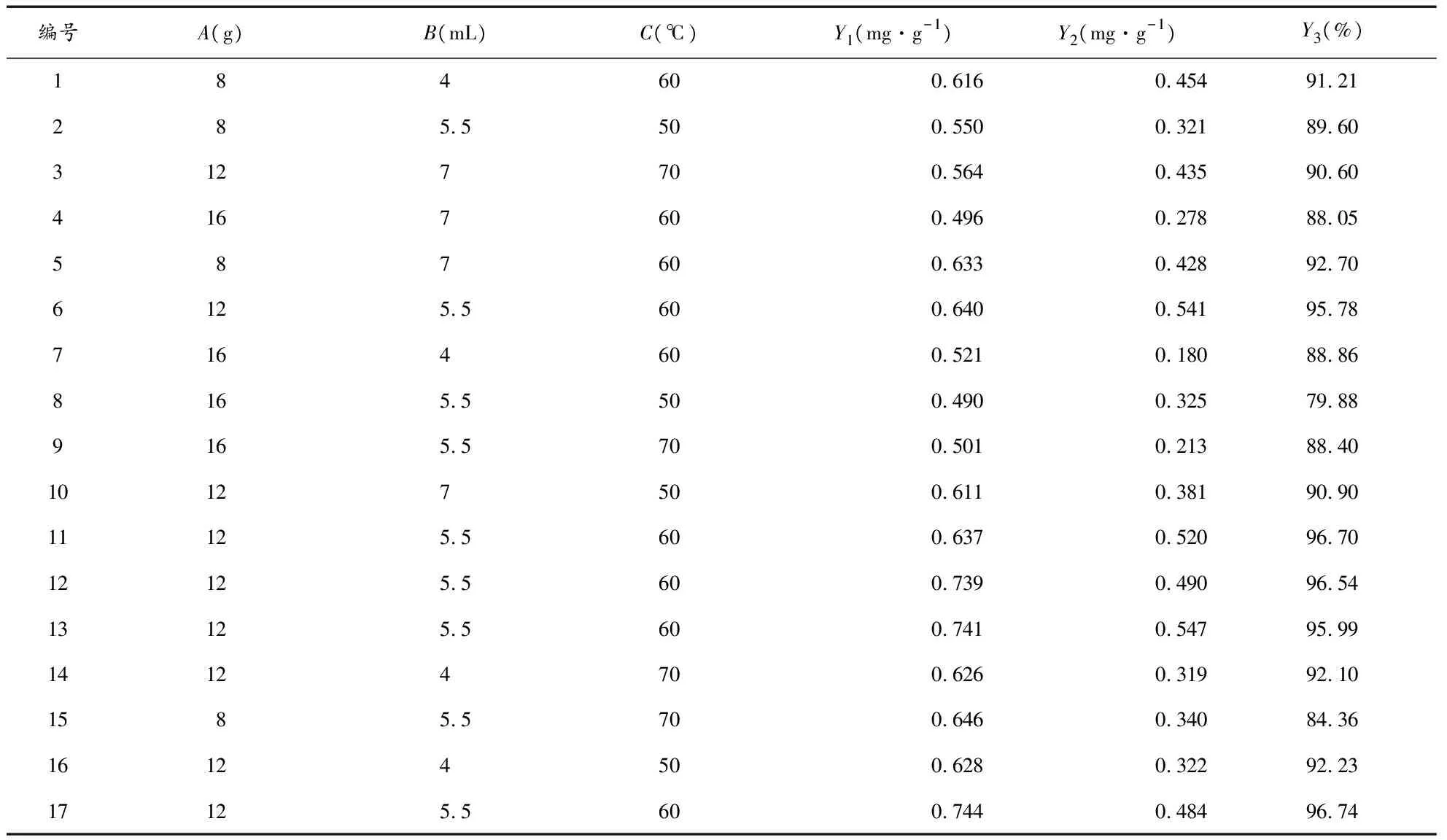
表6 Box-Behnken试验设计与结果

表7 Y1回归方程的方差分析结果

表8 Y2回归方程的方差分析结果

表9 Y3回归方程的方差分析结果
从表7、表8、表9的结果来看,三种模型的预测结果都在0.05以下,失拟值P>0.05,说明该模型的有效性。Y1模型中,A,A2,C2对Y1有显著影响,AB,AC,BC影响不明显,通过对各个F值的对比,发现对Y1的影响为:填充剂(糊精与α-乳糖合用)>70%的乙醇用量>干燥温度。Y2模型中,A,A2,B2,C2对Y2有显著影响,AB,AC,BC影响不显著,通过对各个F值的对比,发现对Y2的影响为:填充剂(糊精和α-乳糖合用)>70%的乙醇用量>干燥温度。Y3模型中,A,A2,C2,AC对Y3有显著影响,AB,BC影响不明显,通过对各个F值的对比,发现对Y3的影响为:填充剂(糊精和α-乳糖合用)>70%的乙醇用量>干燥温度。
2.6.3响应面图的分析与优化 使用 Design-Expert 10软件根据回归方程可以得到对应的响应曲面和等高线,如下图所示,响应曲面的形状可以直接反映各个因子对反应数值的作用,而等高线则可以反映响应值之间的相互作用程度。由图3、图4可知,填充剂与70%乙醇用量、填充剂用量和干燥温度以及70%乙醇用量与干燥温度的交互作用对Y1、Y2的影响较小,调脂柔脉颗粒处方提取物干膏的加入量是定量,加入填充剂和润湿剂(70%乙醇)的质量差异较小,所以对调脂柔脉颗粒中丹酚酸A、大黄酚的含量影响较小。由图5可知,其成型率响应值随填充剂(糊精和α-乳糖合用)用量呈现先升后降的趋势,响应曲面陡峭,说明该因素对成型率的影响显著,符合方差分析结果,可能因为填充剂(糊精和α-乳糖合用)是以固态加入,制粒时用量过大或过小会导致松散不易成型,从而影响成型率。以Y1,Y2和Y3响应值最大为目标,筛选最佳条件为填充剂12 g,70%乙醇5.5 mL,干燥温度60 ℃。
2.6.4设计空间的建立 利用Design-Expert 10软件建立调脂柔脉颗粒的设计空间,使该工艺能够满足期望目标,设定Y1>85%;Y2>85%;Y3>85%,置信水平α = 0.05,优化设计空间。结果用Overlay plot可视化,见图6。由设计空间得出,填充剂(糊精和α-乳糖合用)用量为(8.29~13.75),70%乙醇用量为(4.21~7.35),干燥温度为60 ℃时,调脂柔脉颗粒的工艺能够达到大黄酚含量为0.632~0.744 mg·g-1、丹酚酸A含量为0.462~0.547 mg·g-1,成型率大于82.23%的目标要求。
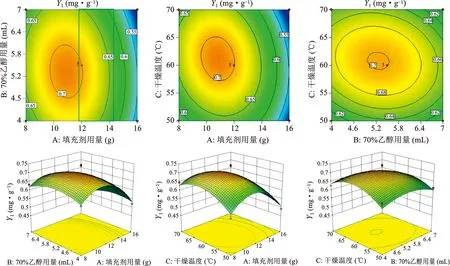
图3 Y1响应面图与等高线图

图4 Y2响应面图与等高线图

图5 Y3响应面图与等高线图
2.6.5最优处方工艺的确定 根据Box-Behnken实验和设计空间的结果确定最优处方组成及调脂柔脉颗粒制备过程的参数为主药∶填充剂∶润湿剂=4∶12∶5.5,使用16目药筛进行制粒,在60 ℃下烘干,使用14目药筛整粒。
2.7工艺验证实验及质量分析 按照“2.6.5”下所确定的最佳处方工艺平行制备3批调脂柔脉颗粒,并对其进行质量分析。
2.7.1大黄酚、丹酚酸A含量测定 随机取制备的调脂柔脉颗粒每批2组进行大黄酚、丹酚酸A含量测定,计算大黄酚含量为(0.715±0.093)mg·g-1,RSD=1.31%(n=6)、丹酚酸A含量为(0.525±0.001)mg·g-1,RSD=0.28%(n=6)。结果表明,批次间大黄酚、丹酚酸A含量均一稳定,调脂柔脉颗粒制备工艺可靠。
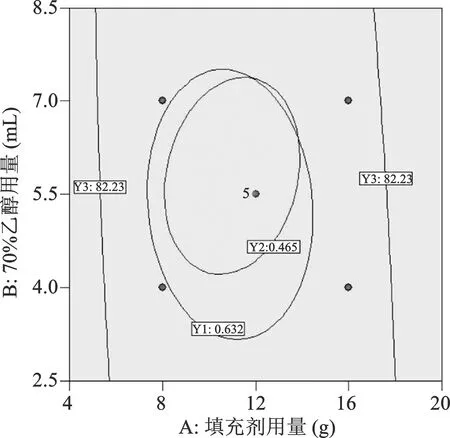
图6 调脂柔脉颗粒的设计空间展示
2.7.2成型率检测 分别统计3批调脂柔脉颗粒的质量M1,并将其按顺序通过10目筛(1号)和80目筛(5号),收集能顺利通过10目筛但不能通过80目筛的颗粒,称定其质量为M2,成型率=(M2/M1)×100%[24]。结果显示每组调脂柔脉颗粒的成型率均大于82.23%,说明该工艺条件下制备的颗粒成型率较好,符合颗粒剂制备的标准。
2.7.3溶化性检测 精密称定3组调脂柔脉颗粒5.0158 g、5.0312 g、4.9997 g,分别加入200 mL热水,搅拌5 min使其充分溶解,观察颗粒的溶化状况并记录时间。结果显示三组颗粒达到可溶性颗粒应全部溶化或轻微浑浊,但不能有异物标准的溶解时间为(83.67±3.05)s,远小于300 s,符合《中国药典》2020版颗粒剂溶化性测定法(附录IC)测定要求[9]。
3 讨论
本文将QbD理论应用于调脂柔脉颗粒配方工艺的研究[25],通过有机结合实验设计、风险评估、关键工艺参数、关键质量属性、设计空间等多种工具从中筛选出对生产工艺有明显影响的主要因素[7],并通过实验数据构建二次多项式回归分析模型,得出最佳配方,明确了调脂柔脉颗粒制备工艺参数与质量属性之间的关系,并对其进行了优化。
已知颗粒剂的配比对制粒的难易程度及颗粒质量有重要的影响[26-27],通过实验结果表明,70%乙醇作为润湿剂可以使颗粒更加致密,成型性良好;糊精与α-乳糖(2∶1)作为填充剂与主药混合后的颗粒成型率可达到96.74%,比单独使用α-乳糖、糊精和微晶纤维素成型性更好。通过Box-Behnken实验和设计空间的结果确定最优处方组成及调脂柔脉颗粒制备过程的参数为主药∶填充剂∶润湿剂=4∶12∶5.5,使用16目药筛进行制粒,在60 ℃下烘干,使用14目药筛整粒,最优工艺下制粒进行工艺验证,结果均符合《中国药典》2020版颗粒剂项下的要求。
综上所述,本实验基于QbD理念优化调脂柔脉颗粒的生产工艺充分体现了研发的主动性和设计的科学性,可以在一定程度上对调脂柔脉颗粒质量进行控制,从而改善工艺的稳定性,为进一步优化配方工艺提供依据。
利益冲突:所有作者均声明不存在利益冲突。

