CT鉴别诊断儿童TFE3重排肾细胞癌与Wilms瘤
纪琼琼,李婷婷,张欢欢,盛 景,杨秀军
(上海市儿童医院 上海市交通大学医学院附属儿童医院放射科,上海 200062)
2022年版WHO肾肿瘤分类将Xp11.2易位/TFE3基因融合相关性肾细胞癌命名为TFE3重排肾细胞癌(TFE3-rearranged renal cell carcinoma, TFE3 RCC)[1],为儿童最常见非Wilms瘤(Wilms tumor, WT)肾肿瘤[2]。WT也称肾母细胞瘤,是儿童常见原发性肾脏肿瘤之一;儿童TFE3 RCC罕见,易被误诊为WT;CT对鉴别诊断及选择治疗决策具有临床价值[3-4]。本研究观察CT鉴别诊断儿童TFE3 RCC与WT的价值。
1 资料与方法
1.1 一般资料 收集2012年8月—2022年4月于上海市儿童医院经手术病理证实的10例单发TFE3 RCC(TFE3 RCC组)及20例单发WT(WT组)患儿。TFE3 RCC组男6例、女4例,年龄4~13岁、中位年龄6.3岁;WT组男11例、女9例,年龄4个月~7岁、中位年龄2.8岁;术前均接受肾CT检查,且图像质量合格。排除CT检查前接受手术、化学治疗、放射治疗等肿瘤相关治疗者。检查前监护人均签署知情同意书。
1.2 仪器与方法 采用GE LightSpeed VCT 64排或Toshiba Aquilion 64层螺旋CT仪行腹盆腔扫描。先行CT平扫,范围自肝上缘平面至耻骨联合,管电压80~100 kV,管电流100~210 mA或自动选择,层厚及层间距均为5 mm,螺距0.984或1.250;之后采用高压注射器、以流率1.0~3.5 ml/s团注对比剂碘佛醇(350 mgI/ml)1.5 ml/kg体质量,延迟20 s及50 s行动脉期及静脉期增强扫描。扫描结束后行薄层重建,层厚0.625 mm或0.500 mm,并行冠状位、矢状位及容积再现重建。
1.3 分析图像 由具有5年及10年泌尿系影像学诊断经验的主治医师各1名独立阅片,观察病灶最大径、平扫CT净值、密度、边界、有无钙化,动脉期及静脉期强化CT值(与平扫CT值的差值)、强化程度、强化方式,包膜是否完整及有无肾盂侵犯、淋巴结转移、远处转移及静脉癌栓。于平扫及增强CT相同层面靠近病灶中心实性区域选取3个不同位置放置面积>50 mm2的ROI以测量病灶CT值,尽可能避开囊变、坏死和钙化区域并包含更多实性区域,取3个ROI的平均值为病灶CT值(CTtumour);测量平扫CT中对侧肾皮质CT值(CTrenal),计算平扫CT净值(CTtumour-CTrenal),并据以评估病灶密度分级:平扫CT净值<10 HU为等密度、10 HU≤平扫CT净值<20 HU为稍高密度、平扫CT净值≥20 HU为高密度[5]。基于病灶增强动脉期与平扫CT值的差值评价其强化程度:差值10~29 HU为轻度强化、30~49 HU为中度强化、≥50 HU为明显强化;根据病灶增强动脉期与静脉期CT值之差评估强化方式:差值≥20 HU为快进快出强化、≤-20 HU为渐进性强化、-19~19 HU为持续性强化[6]。2名医师意见存在分歧时,与另1名影像科主任医师讨论后决定。
1.4 统计学分析 采用SPSS 21.0统计分析软件及R软件(版本4.2.3)。以±s表示符合正态分布的计量资料,行t检验;以中位数(上下四分位数)表示不符合正态分布者,行Mann-WhitneyU检验。采用Fisher精确概率法比较计数资料。针对单因素分析结果显示差异有统计学意义的参数绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评估其鉴别儿童TFE3 RCC与WT的效能。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 TFE3 RCC组患儿年龄大于WT组(P<0.001),组间其余一般资料差异均无统计学意义(P均>0.05)。见表1。

表1 TFE3 RCC与WT患儿一般资料比较
2.2 CT表现 相比WT组,TFE3 RCC组病灶最大径较小,平扫密度较高,边界较清,瘤内钙化占比、增强动脉期和静脉期强化CT值及强化程度均较高(P均<0.01);组间其余CT参数差异均无统计学意义(P均>0.05)。见表2及图1、2。
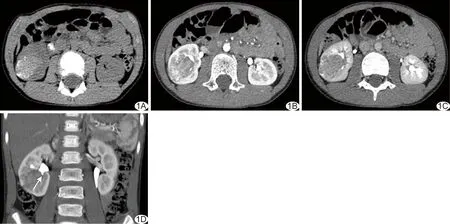
图1 TFE3 RCC组患儿,男,6岁2个月 A.腹部轴位平扫CT图示右肾中极最大径3.20 cm稍高密度病灶,边界较清,CT值73 HU,可见砂砾样钙化灶; B、C.腹部增强轴位动脉期(B)、静脉期(C)CT图示病灶CT值分别为163、128 HU,呈快进快出明显强化,但强化程度低于肾皮质; D.腹部增强静脉期CT冠状位重建图示毗邻右侧肾盂、肾盏受累(箭)
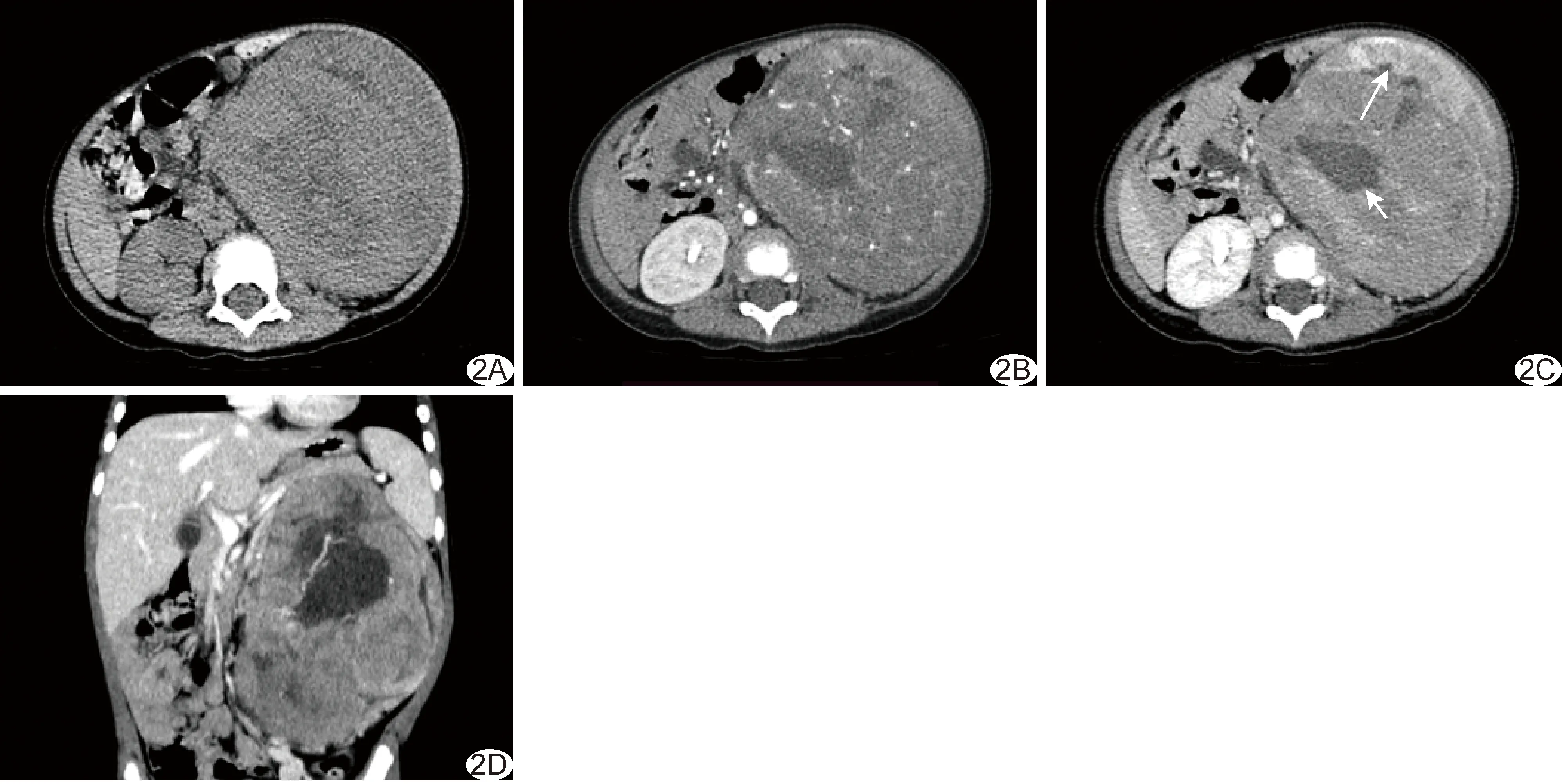
图2 WT组患儿,女,1岁7个月 A.腹部平扫轴位CT图示左肾最大径约14.00 cm等密度影,边界不清、密度不均; B~D.腹部增强CT轴位动脉期(B)、轴位静脉期(C)及冠状位静脉期重建图(D)示左肾分叶状巨大病灶,边界清,呈轻度渐进性强化,内见大小不等的无强化坏死及囊变区(C,短箭),并见“残肾征”(C,长箭)
2.3 ROC曲线分析 以患儿年龄及病灶最大径、平扫CT净值、边界、病灶内钙化、动脉期强化CT值、静脉期强化CT值和强化程度鉴别儿童TFE3 RCC与WT的AUC分别为0.93、0.82、0.97、0.80、0.75、0.91、0.83及0.93。见表3及图3。
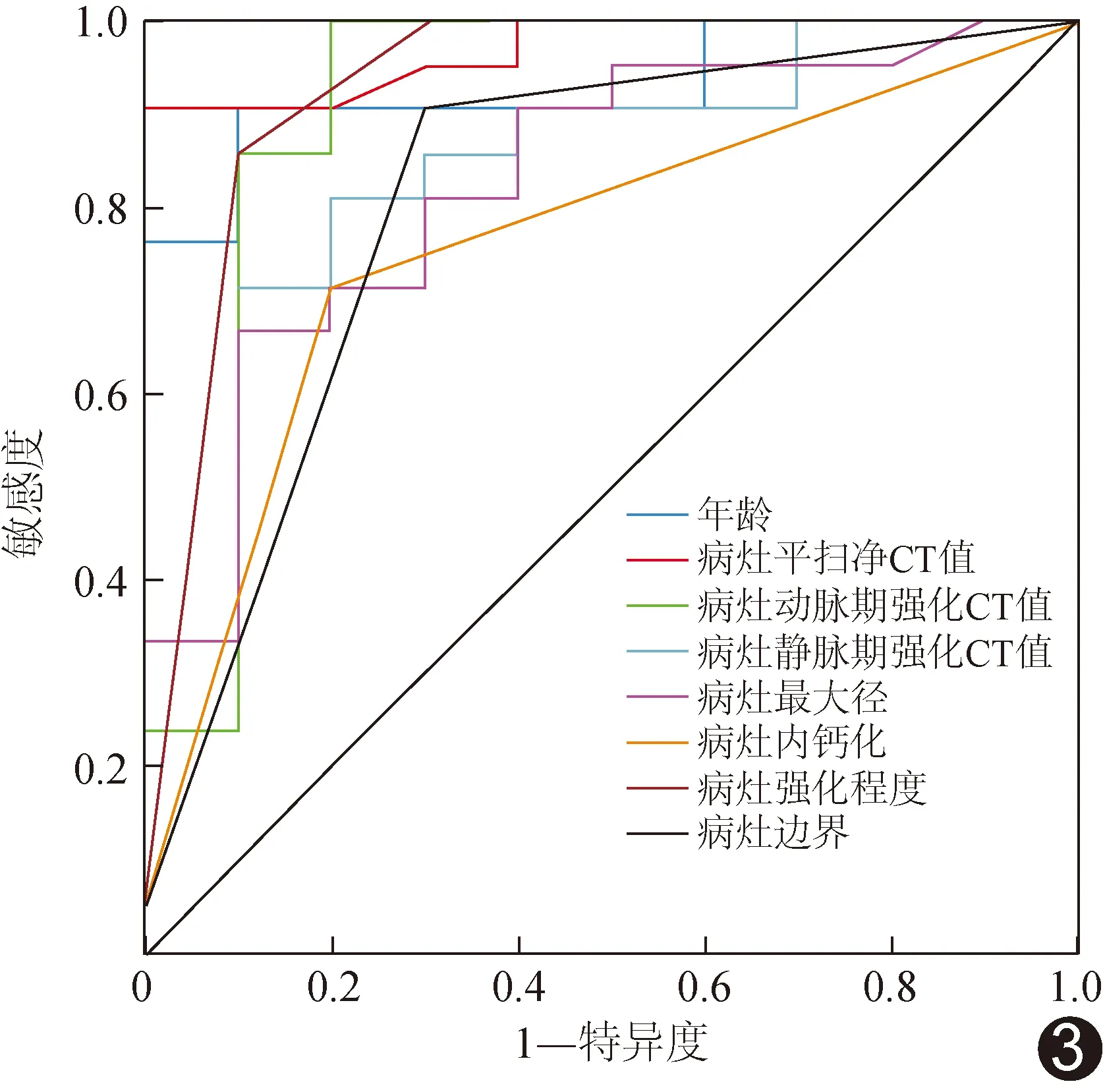
图3 单因素分析有统计学差异的临床及CT特征鉴别儿童TFE3 RCC与WT的ROC曲线
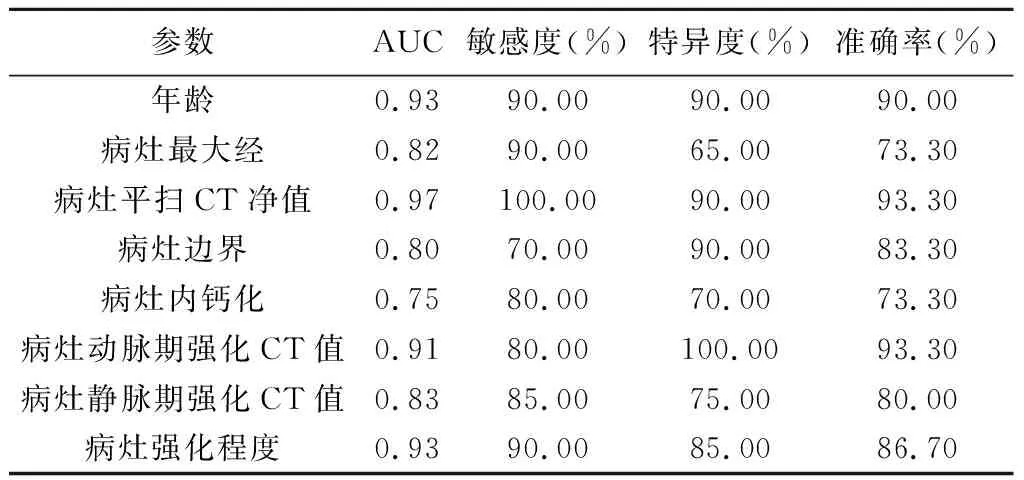
表3 根据临床特征及CT表现鉴别儿童TFE3 RCC与WT的效能
3 讨论
目前主要根据疾病遗传性及诊治成人肾癌经验诊断儿童TFE3 RCC[3,7]。结合组织形态学、免疫组织化学及分子生物学检查结果可确诊TFE3 RCC,治疗则主要采用肿瘤挖除术或肾部分切除术[8],术后患儿预后相对较好;而对WT常需行根治性肾切除术及化学、放射治疗等多学科联合治疗[9],且预后欠佳。术前准确鉴别儿童TFE3 RCC与WT对于改善预后十分重要。
本研究结果显示,相比WT,TFE3 RCC病灶最大径较小、CT平扫密度较高、边界较清、内多见钙化,且增强后病灶强化CT值及强化程度均较高,与既往文献[10-11]报道基本一致。组织病理显示TFE3 RCC瘤内富含砂粒体样钙化,其蛋白含量高、细胞密度大,常伴出血[11],或为其呈现出较高密度表型及边界较清等特征的基础。TFE3 RCC钙化一般呈细点状、小斑片状,主要位于肿瘤边缘[12]。WT也可出现钙化,本组6例WT瘤内钙化均较粗大,且主要位于肿瘤中央区域,可能与肿瘤坏死有关。TFE3 RCC多呈中度及明显强化,但整体强化程度低于肾皮质[12],可能与肿瘤主要由透明细胞和/或嗜酸性粒细胞构成有关[13];WT多呈轻度及中度强化,瘤内囊变、坏死区不强化,与WT亚型,瘤内原始胚芽、上皮、间质3种成分占比及肿瘤内囊变、坏死比例不同等相关[14]。
本组TFE3 RCC多呈持续性强化,而WT主要呈渐进性及持续性强化,其强化方式差异无统计学意义。既往研究[15]表明,TFE3 RCC多有包膜,增强后可见完整包膜,肿瘤边界清晰;WT实性部分强化相对较轻,与正常肾组织形成鲜明对比而形成“假包膜征”。此外,TFE3 RCC源于肾髓质,极易侵犯肾集合系统[6]而较早出现血尿等症状,CT可见明显肾盂侵犯征象;而WT原发于外周肾皮质,肿瘤较小时不累及肾盂,肿瘤较大时肾盂主要呈受压改变。但本研究组间病灶包膜完整及肾盂受侵差异均无统计学意义,或与样本量小有关。
本研究TFE3 RCC组患儿年龄大于WT组;以患儿年龄及病灶最大径、平扫CT净值、边界、病灶内钙化、动脉期强化CT值、静脉期强化CT值及强化程度鉴别儿童TFE3 RCC与WT的AUC分别为0.93、0.82、0.97、0.80、0.75、0.91、0.83及0.93,均大于0.75,提示CT鉴别TFE3 RCC与WT患儿的效能较佳,联合临床因素如患儿年龄有助于鉴别诊断。
综上,CT可有效鉴别诊断儿童TFE3 RCC与WT。但本研究为单中心回顾性分析,样本量小,有待后续开展多中心、大样本量、多模态影像学前瞻性研究进一步观察。