利用OCTA观察肾性高血压患者眼底微循环改变和视功能损伤关系的研究*
任艳凡李新民张瑞玲牛世阳石 岩闫义涛
1.新乡医学院第一附属医院眼科 (河南 卫辉 453000)
2.新乡医学院第一附属医院肾病科(河南 卫辉 453000)
肾性高血压(renal hypertension,RH)是由原发性肾实质或肾血管病变所导致的高血压,是最常见的继发性高血压,占成人高血压的5%。在临床上30岁以下或50岁以上发生高血压,突然发作,降压药治疗无效,同时伴有血清肌酐升高至少50%及视功能损伤的患者应考虑肾性高血压[1-2]。肾性高血压其恶性程度通常比原发性高血压高,更易导致眼底靶器官的损害[3]。肾性高血压可显著影响视网膜、脉络膜和视神经功能。视网膜病变是高血压最常见的表现眼底血管微循环改变,从而导致严重的视功能损伤。非侵入性光学相干光断层血管成像技术(optical coherence tomography angiography,OCTA)可用于可视化视网膜血管中的血液循环,甚至是微小的毛细血管,能对眼底微血管系统结构及血流密度进行准确、定量分析[4-5]。因此,本研究就拟通过OCTA检测肾性高血压患者黄斑区及视盘周围血管和结构变化,探索肾性高血压患者眼底微循环改变与视功能损伤之间的关系,预测肾性高血患者眼底视网膜结构改变无创的监测指标。
1 资料与方法
1.1 研究对象收集2020年7月至2022年12月期间我院收治的肾性高血压患者50例(50眼)作为研究对象,收集同期年龄匹配的健康体检者50例(50眼)作为对照组。病例组男性为28例,女性为22例;年龄40~70岁,平均(57.75±6.53)岁;高血压病程1~13年,平均(6.03±1.34)年。健康对照组男性为27例,女性为23例;年龄18~70岁,平均(56.54±7.33)岁;高血压病程1~13年,平均(6.12±1.28)年。两组一般资料比较无明显差异(P>0.05)。
纳入标准:肾性高血压患者和健康志愿者年龄在18-70岁;已被确诊为肾性高血压并接受相关治疗,高血压持续时间≥1年以上[6];患者无其他严重视网膜疾病或者系统性疾病干扰视功能的评定。排除标准:屈光介质不清楚(严重玻璃体混浊或白内障);合并其他视网膜疾病、青光眼或高眼压、葡萄膜炎等;眼部外伤史或眼科手术病史。有其他严重的肺部、心脏、肝脏等严重器质性病变者。
1.2 一般及临床资料所有参加本研究的对象均自愿参加,并完成以下眼部检查,包括视力检查(LogMAR)、最佳矫正视力(BCVA)、眼压、裂隙灯检查、免散瞳眼底彩照、OCTA检查。记录所有肾性高血压患者的临床资料,包括性别、年龄、高血压病程、吸烟史、体质指数、收缩压、舒张压、血常规、尿常规、肾功能(尿素、肌酐、尿酸、胱抑素C)、肾脏超声。
1.3 OCTA测量方法肾性高血压的诊断标准参考中国肾性高血压管理指南2016及《ISH2020全球高血压实践指南》。高血压定义:在未使用降压药物的情况下非同日测量血压3次,18岁以上的成年人收缩压≥140 mmHg和(或)舒张压≥90 mmHg诊断为高血压。收缩压≥140 mmHg且舒张压<90 mmHg为单纯收缩期高血压。
采用OCTA对所有参与者进行OCTA检查。所有的操作过程及分析过程都由同一名经验丰富的检查者进行。具体操作步骤:对所有研究对象视盘及黄斑区行OCTA模式扫描,获得视盘旁血管密度(Peripapillary-VD,PVD)、黄斑区浅层血管密度(MSVD)、视网膜神经纤维层(RNFL)、神经节细胞复合体厚度(GCC)。以BCVA为因变量构建回归模型,利用受试者工作特征曲线(ROC)评估PVD、GCC衡量视功能损伤严重情况。
1.4 观察指标
1.4.1对比两组患者RNFL、PVD、MSVD、GCC、BCVA[7]。1.4.2 以BCVA为因变量构建回归模型。1.4.3 利用受试者工作特征曲线(ROC)评估PVD、GCC厚度衡量视功能损伤严重情况。
1.5 统计学方法所有数据均采用SPSS 26.0软件进行统计学分析,采用(±s)表示,两组间计量资料比较采用独立样本t检验,计数资料比较采用χ2检验。P<0.05差异有统计学意义。
2 结 果
2.1 对比两组患者眼底微循环变化及视力变化病例组RNFL厚度、GCC薄于对照组,PVD、MSVD低于对照组,BCVA劣于对照组,(P<0.05),详见表1。

表1 对比两组患者眼底微循环变化及视力变化
2.2 以BCVA为因变量构建回归模型RNFL、PVD、MSVD、GCC与BCVA呈负相关(P<0.05),RNFL厚度、GCC越薄,PVD、MSVD越低,视力越差,视功能损伤越严重(P<0.05),详见表2。
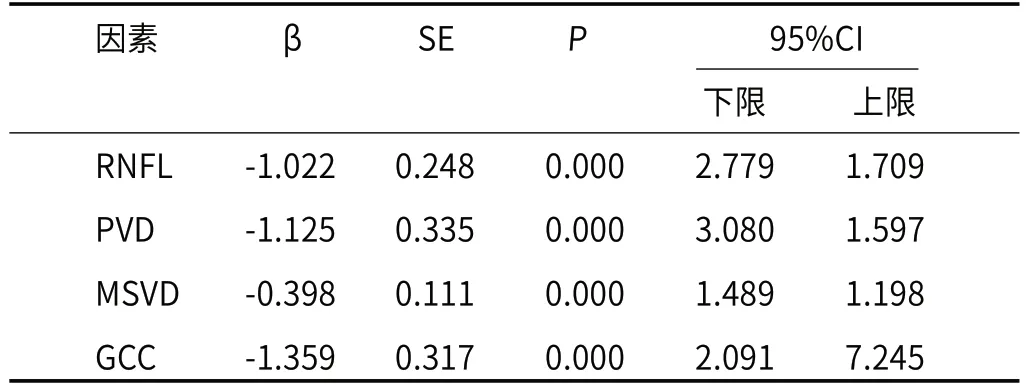
表2 以BCVA为因变量构建回归模型
2.3 采用ROC曲线分析PVD、GCC厚度预测视功能损伤PVD联合GCC厚度预测视功能损伤的灵敏度、特异度、准确度分别为97.96%、93.88%、95.92%,显著高于单一PVD、单一GCC厚度指标预测效能(P<0.05),详见表3。
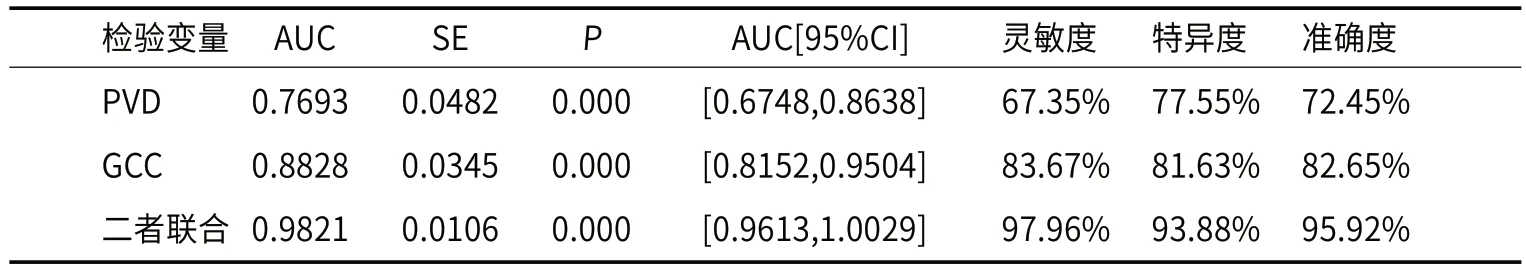
表3 分析PVD、GCC厚度预测视功能损伤价值
3 讨 论
肾性高血压眼底视网膜病变有多种机制参与,其中血-视网膜内屏障破坏常见,引起血管内物质渗出,引起视网膜出血、棉絮斑、视网膜内脂质、黄斑星芒状脂质沉积,严重者眼底甚至可见到视网膜毛细血管闭锁或脉络膜小动脉纤维素性坏死,引起脉络膜毛细血管阻塞,并进一步导致血-视网膜外屏障破坏,甚至出现视盘水肿,引起严重视功能障碍[3]。此外,肾性高血压患者视网膜血管结构改变视网膜静脉扩张和视网膜毛细血管通透性增加也是重要原因之一,血流速度减慢,血管壁变薄,容易发生出血和渗出,导致视网膜水肿和视力损伤[8-9]。
光学相干光断层血管成像技术(o pt i c a l co h e r e n ce tomography angiography,OCTA)是一种非侵入性技术,能对眼底微血管系统结构进行准确、定量分析[4-5],对眼底结构改变有很好的分辨率,可实现视网膜及视盘旁毛细血管丛灌注密度及血流密度的量化[10]。因OCTA无创简便的操作以及独特的成像特点,目前OCTA已广泛应用于眼科疾病[11-18]以及全身相关性眼底疾病的研究等[19-21]。2020年Aida Kasumovic等利用OCTA研究慢性肾脏疾病眼底微循环病变,结论提示OCTA检测视网膜不同层的微血管变化可评估全身灌注状况[22]。
本次研究中,RH组RNFL厚度、GCC薄于对照组,PVD、MSVD低于对照组,BCVA劣于对照组,(P<0.05)。RNFL、PVD、MSVD、GCC与BCVA呈负相关(P<0.05),RNFL厚度、GCC越薄,PVD、MSVD越低,视功能损伤越严重(P<0.05)。本研究中肾性高血压患者RNFL厚度、GCC薄于对照组,PVD、MSVD低于正常对照组,推测眼底血流密度降低与肾性高血压造成的全身血管灌注压力改变有关。肾性高血压患者的眼底微循环异常可以导致眼内压力升高、视水肿和旁视网膜神经纤维层受损等眼部病理变化,从而影响其视功能[23],证实本研究RNFL薄变的原因应该是眼内压升高所致。此外,有研究发现,早期肾性高血压患者的RNFL减少比晚期患者更为显著[24]。RNFL变化与肾性高血压病程和治疗情况也密切相关,控制血压和及时治疗视功能损伤,RNFL减少的速度可以得到缓解和延缓,眼底微循环改善情况也较好。本次研究结果提示PVD联合GCC厚度预测视功能损伤的灵敏度、特异度、准确度分别为97.96%、93.88%、95.92%,显著高于单一PVDD、单一GCC厚度指标预测效能(P<0.05),因此RNFL可以作为评估肾性高血压患者视功能损伤情况的重要指标之一。
本研究结果表明OCTA为肾性高血压患者提供一种无创、快速检测眼底微循环结构改变的一种方法,肾性高血压患者PVD、MSVD降低,RNFL薄变,其中PVD联合GCC厚度能较好的预测视功能损伤程度。肾性高血压患者黄斑区和视盘周围血流密度降低,提示视网膜血管密度或许可以作为肾性高血压早期诊断、预测严重程度的一项无创、有效监测指标。

