DSA对动脉粥样硬化相关性缺血性脑血管病的诊断价值分析
冯飞阳* 许家华 林庆兰 伍能生
厦门市海沧医院神经内科 (福建 厦门 361026)
缺血性脑血管病(Ischemic cerebrovascular disease,ICVD)是指供应脑的血管血管壁病变或血流动力学障碍基础上发生的脑部血液供应障碍引起相应供应区脑组织出现缺血、缺氧、坏死,甚至引起短暂性或持久性的局部损害或弥漫性脑损害,进而造成神经功能缺损的病症[1]。中老年人群是ICVD的高发群体,动脉粥样硬化是导致ICVD发生的主要病因之一,严重影响中老年群体的身心健康和生活质量[2]。动脉粥样硬化相关性ICVD具有较高的致残率和致死率,故早期诊治成为改善该疾病预后的重要手段。目前,DSA仍被视为临床诊断ICVD的“金标准”[3]。鉴于此,本研究以86例动脉粥样硬化相关性ICVD患者为例,均予以颈动脉超声、DSA检查,通过对比其诊断结果,进一步分析DSA在动脉粥样硬化相关性ICVD临床诊断中的应用优势。现报告如下。
1 资料与方法
1.1 一般资料选取2021年5月至2023年3月期间医院收治的86例动脉粥样硬化相关性ICVD患者为研究对象,均与相符。86例患者中包含61例男(70.93%)、25例女(29.07%);年龄45~80岁,平均年龄为(61.22±3.29)岁;按年龄段分为38例中年(45~59岁)、48例老年(60~80岁);按基础疾病分为65例高血压(75.58%)、13例糖尿病(15.12%)、8例冠心病(9.30%);依据《中国脑血管病防治指南》[4]中的相关诊断标准,将其分50例脑梗死(58.14%)、36例短暂性脑缺血发作(transient ischemic attack,TIA)(41.86%)。
纳入标准:均可耐受颈动脉超声、DSA检查方式,且依从性良好;精神正常,无沟通障碍;均为自愿参与者。排除标准:非ICVD患者;经多种检查方式联合确定为非动脉粥样硬化相关性ICVD患者;肾脏、肝脏等重要脏器严重损害的患者;合并严重的精神疾病患者;无法耐受颈动脉超声、DSA的患者。
1.2 方法
1.2.1 颈动脉超声 选择美国GE Voluson E8彩色多普勒超声诊断系统,探头频率设置为8~10MHz。患者呈侧仰卧位,头部低枕,利用超声诊断系统探查患者双侧颈动脉的血流动力学及形态学参数,血管参数包括内膜厚度、斑块情况、狭窄段原始管径与残余管径等,评估左右椎动脉、左右颈总动脉、左右颈内动脉的狭窄程度。评估血管的狭窄程度,共分轻度、中度、重度、闭塞四个标准,狭窄率<50%,为轻;狭窄率在50%~69%之间,为中;狭窄率在70%~99%之间,为重;血流信号消失,为闭塞。
1.2.2 DSA 选择德国西门子数字血管造影系统 ,患者呈正侧位,行常规消毒铺巾和麻醉后,经股动脉穿刺插管,建立动脉通道后注入造影剂。造影起始点为主动脉弓,造影过程涉及完整动脉期、实质期、静脉期。借助DSA造影机,动态、全面地掌握血管的起始情况、走行及变异,多角度投照大脑前动脉、中动脉及后动脉的一级分支狭窄情况,充分了解血管病变程度、长度、侧支开放的代偿情况以及Willis环的完整情况等。血管狭窄程度评估标准同上。
1.3 观察指标比较颈动脉超声、DSA分别对86例动脉粥样硬化相关性ICVD患者颈动脉、椎动脉的血管狭窄情况的检出情况;分析颈动脉超声、DSA诊断颈动脉斑块性质的准确性;比较DSA对脑梗死、TIA患者血管狭窄或闭塞的分布特点。
1.4 统计学方法数据采用SPSS22.0进行分析,计量资料(如平均年龄等)均符合正态分布,用(±s)表示,数据比较用t检验;计数资料(如性别占比、血管狭窄检出率等)用率(%)表示,数据比较用χ2检验;检验标准P<0.05。
2 结 果
2.1 颈动脉及椎动脉血管狭窄的诊断结果比较颈动脉超声检出29例轻度狭窄、15例中度狭窄、14例重度狭窄、11例闭塞;DSA检出38例轻度狭窄、18例中度狭窄、15例重度狭窄、15例闭塞;DSA检出86例患者均存在不同严重程度的血管狭窄病变,其血管狭窄检出率(100.00%)显著高于颈动脉超声(80.23%),P<0.05。(见表1)。

表1 颈动脉及椎动脉血管狭窄的诊断结果比较[n(%)]
2.2 颈动脉超声、DSA诊断颈动脉斑块性质的准确性分析颈动脉超声检出66例斑块、20例无斑块,以该结果为参考标准,使用McNemar检验评估DSA检出颈动脉斑块的准确性。DSA检出颈动脉斑块的灵敏度为71.2%、特异度为95%、准确度为76.7%、误诊率为5%、漏诊率为28.7%、约登指数为0.687、阳性似然比为47.5、阴性似然比为0.287、K为0.522、χ2为103.1、P为0.000。颈动脉超声、DSA比较,差异显著,有统计学意义(P<0.01),二者在检出斑块方面的一致性中等(K=0.522)。(见表2)
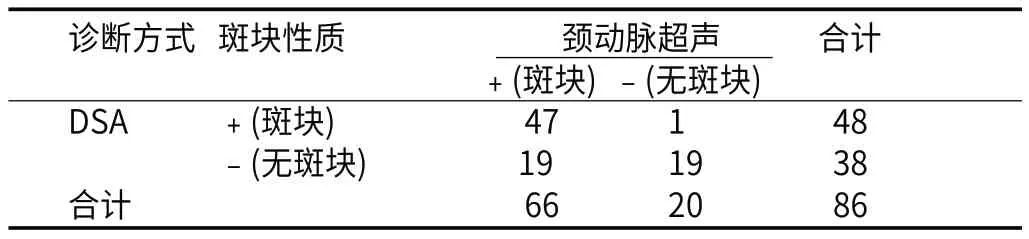
表2 颈动脉超声、DSA诊断颈动脉斑块性质的准确性分析
2.3 DSA对血管狭窄或闭塞的分布特点的检出情况分析脑梗死患者与TIA患者的血管狭窄或闭塞在颅内外动脉、前后循环动脉的具体分布情况比较,无显著差异,P>0.05。(见表3)
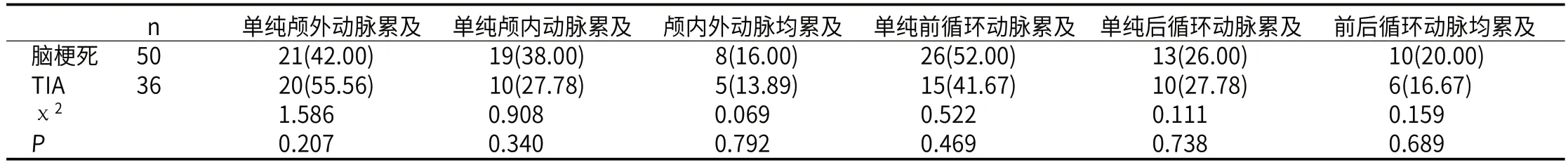
表3 对血管狭窄或闭塞的分布特点的检出情况比较[n(%)]
3 讨 论
ICVD为临床常见疾病,好发于中老年群体。动脉粥样硬化是该疾病的一大主因,颅内血管狭窄或闭塞会导致血流动力学异常改变,使得动脉血流速度变慢,进而导致脑组织发生局部缺氧、缺血、坏死现象[5-6]。研究证实[7],ICVD患者中有30%的患者因颈动脉狭窄诱发此病。临床上诊断动脉粥样硬化相关性ICVD的方法较多,包括MRI、CT、颈动脉超声、DSA等。诊断方法虽多,但容易受检查费用昂贵、禁忌证多、有创伤性等多种因素的影响,导致以上诊断方法的临床应用受限[8-9]。
本研究主要对比了颈动脉超声和DSA诊断动脉粥样硬化相关性ICVD的诊断效果,结果显示:DSA检出86例患者均存在不同严重程度的血管狭窄病变,其血管狭窄检出率(100.00%)显著高于颈动脉超声(80.23%)。从此结果可以看出,与颈动脉超声相比,DSA在诊断血管狭窄程度或闭塞方面有着绝对的优势,其检出率可达100%,是临床诊断动脉粥样硬化相关性ICVD的“金标准”。李新的研究指出[10],颈动脉超声作为脑血管疾病的常规筛查手段,具有无创、可重复性强、安全的特点,被多数患者所接受,但对颈动脉狭窄程度的评估存在一定的误差。比如有时在彩超上发现颈动脉狭窄程度比较严重,甚至闭塞,但血管造影结果缺显示血管并未闭塞,且血流正常,说明该方法存在高估血管狭窄结果的问题,建议与其他检查项目联合诊断。但临床对DSA识别斑块的准确性存在较多的争议。临床实践证实,颈动脉超声在识别颈动脉斑块性质方面与多层螺旋CT诊断有着较高的一致性,识别颈动脉斑块性质的准确性高达90%以上,DSA对斑块识别的准确性则相对较低。因此,本研究在分析斑块识别准确性时,以颈动脉超声结果为参考,用McNemar检验评估DSA检出颈动脉斑块的准确性,结果显示,颈动脉超声、DSA比较,差异显著,有统计学意义(P<0.01),二者在检出斑块方面的一致性中等(K=0.522),DSA检测斑块的准确性为76.7%,提示DSA在识别斑块的准确性较颈动脉超声稍低。颈动脉超声是常见的脑血管疾病筛查手段,由于颈动脉的位置比较浅,利用超声波特性可直观观测到患者的血管血流动力学情况,同时可以测量出患者的血管管壁厚度与管腔直径,便于诊断医师以此为依据进一步评估血管的狭窄程度和判断斑块是否形成[11]。Gao P等学者的研究证实[12],溃疡是斑块容易破裂的主要特征,而DSA在发现溃疡斑块方面的能力不及颈动脉超声可靠。此外,斑块内出血同缺血性事件相关,需要在组织病理诊出易损斑块前尽早识别易损斑块对预防和降低缺血性脑血管事件的危险有着重要意义。本研究结果显示:脑梗死患者与TIA患者的血管狭窄或闭塞在颅内外动脉、前后循环动脉的具体分布情况比较,无显著差异,提示DSA可检出脑梗死、TIA患者的血管狭窄或闭塞在颅内外动脉、前后循环动脉的分布特点,且主要分布在颈内动脉起始段、大脑中动脉M1段和椎动脉V1段。本研究认为,DSA在动脉粥样硬化相关性ICVD的诊断效果毋庸置疑,但该方法具有一定的创伤性,在检查过程中可能会对一些较小的血管造成损害,需要外科手术干预[13-14]。DSA检查前需对患者说明其诊断优势和可能存在的风险,并且在检查过程中注意观察患者的反应,尤其是老年患者,需在其耐受的前提下完成[15]。
综上所述,DSA可高效检出动脉粥样硬化相关性缺血性脑血管病患者的血管狭窄情况,但在识别斑块方面的能力稍差于颈动脉超声,临床建议根据实际情况合理选择诊断方式。

