安徽某焦化污染场地生物泥浆反应器中试研究案例
李霏,丁浩然,杨乐巍*,刘渊文,王恒,张岳,李书鹏,陈成,田德金
1.北京建工环境修复股份有限公司
2.污染场地安全修复技术国家工程实验室
3.合肥东部新中心建设管理办公室
我国是一个焦炭生产大国,焦炭生产量长期位居世界前列。随着我国对城市布局中“退二进三”政策的实施,大量的焦化企业因产业结构调整搬迁,退役焦化厂存在的不同程度的土壤污染,如不经修复会污染环境,存在生态风险。多环芳烃类(polycyclic aromatic hydrocarbons,PAHs)、氰化物、氟化物、总石油烃(TPH)、重金属等有毒有害物质是焦炭生产过程中的主要污染物,若非法处置或处理不当会造成焦化场地污染。其中PAHs 具有毒性、遗传毒性、致突变性和致癌性的特点,损伤人体呼吸系统、循环系统、神经系统,并对肝脏、肾脏造成损害,是场地修复中需要重视的一种污染物[1]。
针对焦化污染场地的有机污染物,常用的修复方法包括热脱附、化学氧化及生物修复等。热脱附技术可以有效降低污染物浓度,但能耗大、碳足迹高,不利于“双碳”目标的实现;化学氧化可以有效去除大部分低环PAHs,但对高环PAHs 去除效果有限,同时存在二次污染的风险和成本高的缺点;生物修复是通过植物、动物、微生物的代谢活性将环境中的污染物减毒或完全无害化,具有低成本、无二次污染、低环境扰动等优势。生物泥浆反应器是一种易于调节反应参数,均质性好的处理方式。Tuhuloula等[2]在含固率为20%的泥浆中接种10%~15%的Bacillus cereus和Pseudomonas putida菌 液,7 周 时间内,低环PAHs 降解率可达90%左右。同时,研究发现高环PAHs 具有低水溶性、低生物有效性等特点,加之生物积累、生物放大等效应,对微生物产生持续毒害,因而对生物修复有不利影响[3-4]。生物泥浆反应器通过在泥浆中添加表面活性剂和微生物,将吸附在土壤的PAHs 溶解到水相中,提高污染物的传质效率和生物有效性,是一种具有开发前景的修复技术[5]。Forján 等[6]采用20 L 的生物泥浆罐,添加Rhodocccus erythropolis和Pseudomonas stuzeri菌剂处理污染土壤,结果显示初始浓度在332 mg/kg 左右的PAHs 经过15 d 的处理,低环PAHs 降解率达到80%,高环PAHs 也可以降解70%。前人研究多是在实验室规模下进行的试验,但由于现场条件复杂,与实验室结果差别较大。Pelaez 等[7]进行了1 kg(约0.000 5 m3)、15 m3、900 m3一系列的生物堆放大试验,结果显示处理周期为21、60、161 d 不等,说明放大过程存在诸多变化和不确定因素。
美国的生物泥浆反应器已发展多年,美国国家环境保护局报道已有超过2%的超级基金项目使用生物泥浆反应器处理PAHs 。多家供应商(如Environmental Remediation,Inc.,Environmental Solution,Inc.,Groundwater Technology,Inc.等)已开发了四代生物泥浆反应器并将其应用到工程中[8]。但国内研究仍停留在实验室小试规模,少数放大规模试验也仅针对萘、菲等低环PAHs,缺少高环PAHs 的场地修复中试案例研究。笔者采用Micro-Blaze®菌剂,在2 组1 m3的泥浆反应罐中对合肥某焦化污染场地的土壤进行中试修复,对溶解氧浓度、温度、微生物丰度及多样性等参数进行监测,以期获得泥浆反应器在处理PAHs 过程中的参数变化,为工程化装备设计和运行提供可靠的数据支撑。
1 材料与方法
1.1 研究区域污染特征
研究区域为合肥某退役钢铁厂,该污染场地有近60 年的生产历史,未来规划为一类及二类建设用地。污染场地包括带钢车间、炼钢车间、连轧辅助车间、石灰厂、制氧车间、焦化厂、烧结厂、炼铁厂、炼钢厂、热轧厂、冷轧厂和非生产区等,原钢厂通过高炉炼铁→炼钢→轧钢等加工步骤,出厂产品为成品钢材,包括型材、板材、热轧薄板等。修复地块污染因子包括PAHs、重金属、TPH 等,符合典型的焦化污染场地特征,场地土壤以杂填土、黏土为主。修复地块土壤的pH 平均为8.78±1.19,呈弱碱性;含水率为17.9%±5.66%;土壤呈灰黄/黑色,质地由松散到稍密,局部夹杂淤泥质土壤。颗粒组成为:0.5~2 mm,占0.0%~8.9%;0.25~0.5 mm,占0.0%~14.5%;0.075~0.25 mm,占15.1%~33.2%;0.005~0.075 mm占43.6%~69.2%。土壤中有机质含量为1%~3%。
1.2 试验设计
对微生物毒性大且难降解的PAHs 多为高环物质,因此选取单一有机物污染的土壤,其中苯并[a]芘、苯并[b]荧蒽、二苯并[a,h]蒽、茚并[1,2,3-cd]芘等高环PAHs 浓度超过GB 36600—2018《土壤环境质量 建设用地土壤污染风险管控标准(试行)》一类建设用地标准(表1)。土壤粉碎后过40 目(0.425 mm)筛,筛下土壤以砂土和少量黏土为主,是该场地代表性的污染土壤。设计2 组泥浆反应器,最大容量1 m3,最大曝气量6 L/min,最大搅拌转速60 r/min。反应器配备有溶解氧、氧化还原电位、负压、温度监测传感器,可以在线监测泥浆的反应参数。在1#和2#反应罐分别配制约650 L 含固率为28%和18%的泥浆进行中试研究。菌剂采用美国Verde Environmental 公司的Micro-Blaze®菌剂,根据其使用说明并出于成本考虑,每个反应罐添加约10%(6 L)浓缩菌液。同时为了验证菌剂的降解能力及其菌群结构,在实验室通过灭菌石英砂配制500 mL 含固率30%的模拟泥浆,投加1%(5 mL)浓缩菌液分别处理0(空白对照)、50(T50)、100(T100)和200(T200)mg/kg 苯并[a]芘。按照以往研究[9]经验并结合实际监测数据,泥浆反应器运行期间采用6 L/min 的曝气量和50 r/min 的搅拌桨转速,保持溶解氧浓度为6~9 mg/L,处理过程持续8 周。
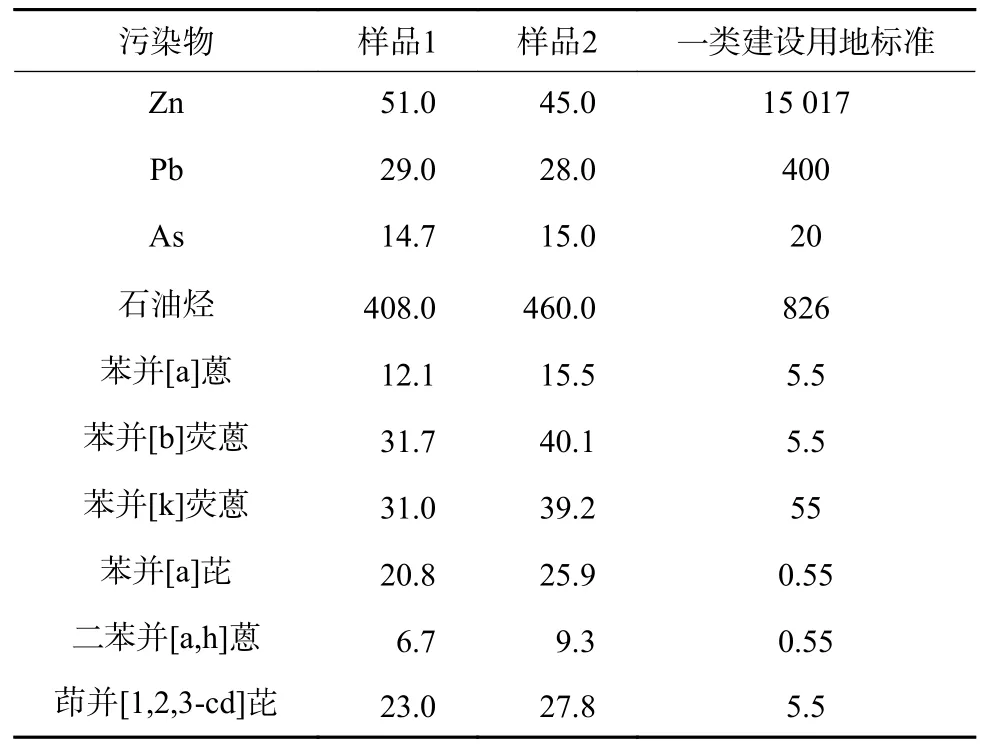
表1 试验土壤污染情况Table 1 Contamination level of sampling soil mg/kg
1.3 采样周期及检测方法
为保证数据的准确性和连续性,每周采集混合均匀的泥浆,将其沉淀后取一定量的固相和水相,固相样品中干物质及含水量采用HJ 613—2011《土壤干物质和水分的测定 重量法》中的方法进行检测,土壤中PAHs 浓度采用HJ 834—2017《土壤和沉积物半挥发性有机物的测定 气相色谱-质谱法》中的方法进行检测,水中PAHs 浓度采用HJ 478—2009 《水质多环芳烃的测定 液液萃取和固相萃取高效液相色谱法》中的方法进行检测。土壤微生物多样性绝对定量测序基于Illumina Novaseq 测序平台,利用双末端测序(Paired-End)的方法,扩增前在DNA 模板中加入一定比例内参序列(spike-in 序列),构建小片段文库进行测序。扩增区域选择的是16S rRNA v3~v4区。数据分析采用标准流程,包括Trimmomatic(v0.33)、cutadapt(1.9.1)、Usearch(v10)、QIIME2(v2020.6)的dada2 功能[10-11]。
2 结果与讨论
2.1 菌剂的菌群结构
实验室采用Micro-Blaze®菌剂处理灭菌石英砂混合梯度浓度的苯并[a]芘,发现在4 周时间内,苯并[a]芘浓度从50~200 mg/kg 降解到0.55 mg/kg,说明该菌剂具有良好的降解性能。16S rRNA 分析可知,菌剂主要以Burkholderia-Caballeronia-Paraburkholderia(相对丰度约70%)为主,Bacillus(约10%)和Acitmomyces(约1%)次之(图1)。在有苯并[a]芘的环境压力下,Burkholderia-Caballeronia-Paraburkholderia属的相对丰度增加超过90%,但反映生物多样性的参数[12](ACE、Chao1、Simpson、Shannon 指数)均呈下降趋势(表2),生物多样性降低。这可能由于Burkholderia-Caballeronia-Paraburkholderia菌属作为主要降解菌而大量繁殖,也可能由于苯并[a]芘的生物毒性效应抑制了部分微生物的生长,导致生物多样性降低。也有研究发现Burkholderia-Caballeronia-Paraburkholderia菌中含有单加氧酶[13],可以降解石油烃及一些环类污染物,如二甲苯、苯酸盐、氯基环己烷、氯苯等[14-15]。
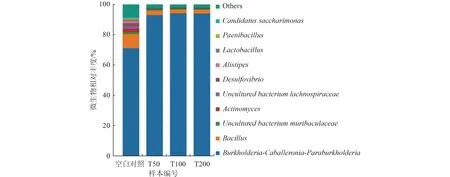
图1 菌剂群落结构Fig.1 Microbial community structure
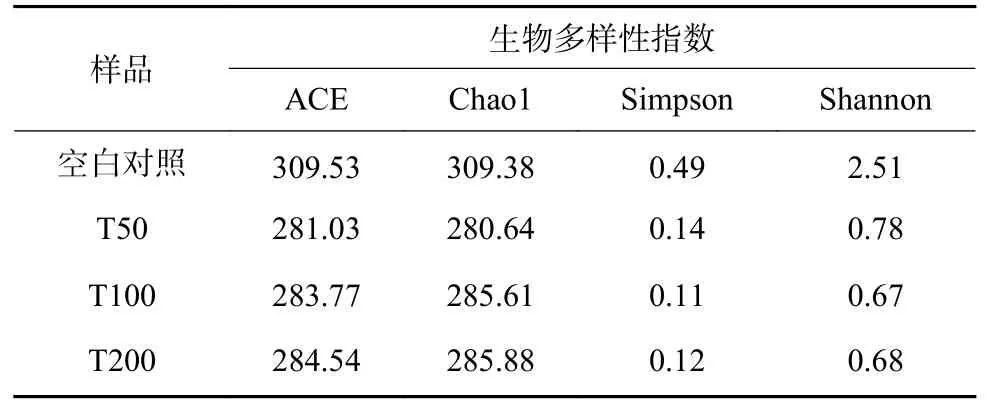
表2 菌剂多样性分析Table 2 Analysis of microbial diversity
2.2 泥浆反应罐中污染物浓度监测
中试过程监测了苯并[a]蒽、苯并[b]荧蒽、苯并[a]芘、二苯并[a,h]蒽、茚并[1,2,3-cd]芘5 种初始浓度超标的高环PAHs,结果见图2。从图2 可以看出,前3 周污染物浓度快速下降至较低浓度,1#反应罐中5 种污染物在第4 周均降低到5 mg/kg 以下,但在第4 周后略有反弹。这可能由于1#反应罐中含固率为28%,高于2#反应罐的18%,1#反应罐的传质效率低于2#反应罐;同时,在第3 周添加的表面活性剂增加了固液萃取时的分配比例,影响了污染物浓度。1#反应罐在8 周后只有苯并[a]芘的浓度(3.03 mg/kg)高于一类用地的修复目标(0.55 mg/kg),其他污染物均达标,2#反应罐在第8 周所有污染物浓度均达到一类用地的修复目标。说明该菌剂具有良好的降解效果,可以在8 周的时间内将污染土壤修复到目标值。其中苯并[a]芘、二苯并[a,h]蒽由于修复目标较低(0.55 mg/kg),需要比较长的时间(8 周),而苯并[b]荧蒽初始污染浓度较高且相对难降解,也需要8 周时间达到修复目标(5.5 mg/kg)。苯并[a]蒽、茚并[1,2,3-cd]芘相对容易降解,在第4~5 周已达到修复目标(5.5 mg/kg)。生物泥浆反应器适合处理几到几百mg/kg的PAHs 污染,也有研究称可以处理上千至万mg/kg 的PAHs,这与低环PAHs的比例[16]、反应条件及菌种的耐受程度等均有关[17]。
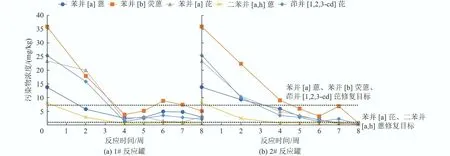
图2 反应罐中污染物浓度监测Fig.2 Contaminants monitoring in bioreactor tanks
虽然石油烃(C10~C40)初始浓度(434 mg/kg)远低于一类用地修复标准(826 mg/kg),但石油烃属于微生物易利用的底物,可以作为微生物底物促进其生长。Smith 等[18]研究发现,2 400 mg/kg 的石油烃可以在10 d 内降解至400 mg/kg 以下。从图3 可以看出,2 个反应罐中的石油烃均明显降解,1#反应罐降解率达67%,2#反应罐降解率达到45%。前人研究也表明,很大一部分原油中的低碳链石油烃都可以被微生物降解,降解率为40%~93%[19]。这也说明该菌剂在利用石油烃的同时仍然会降解其他PAHs,没有或仅有很弱的竞争抑制。
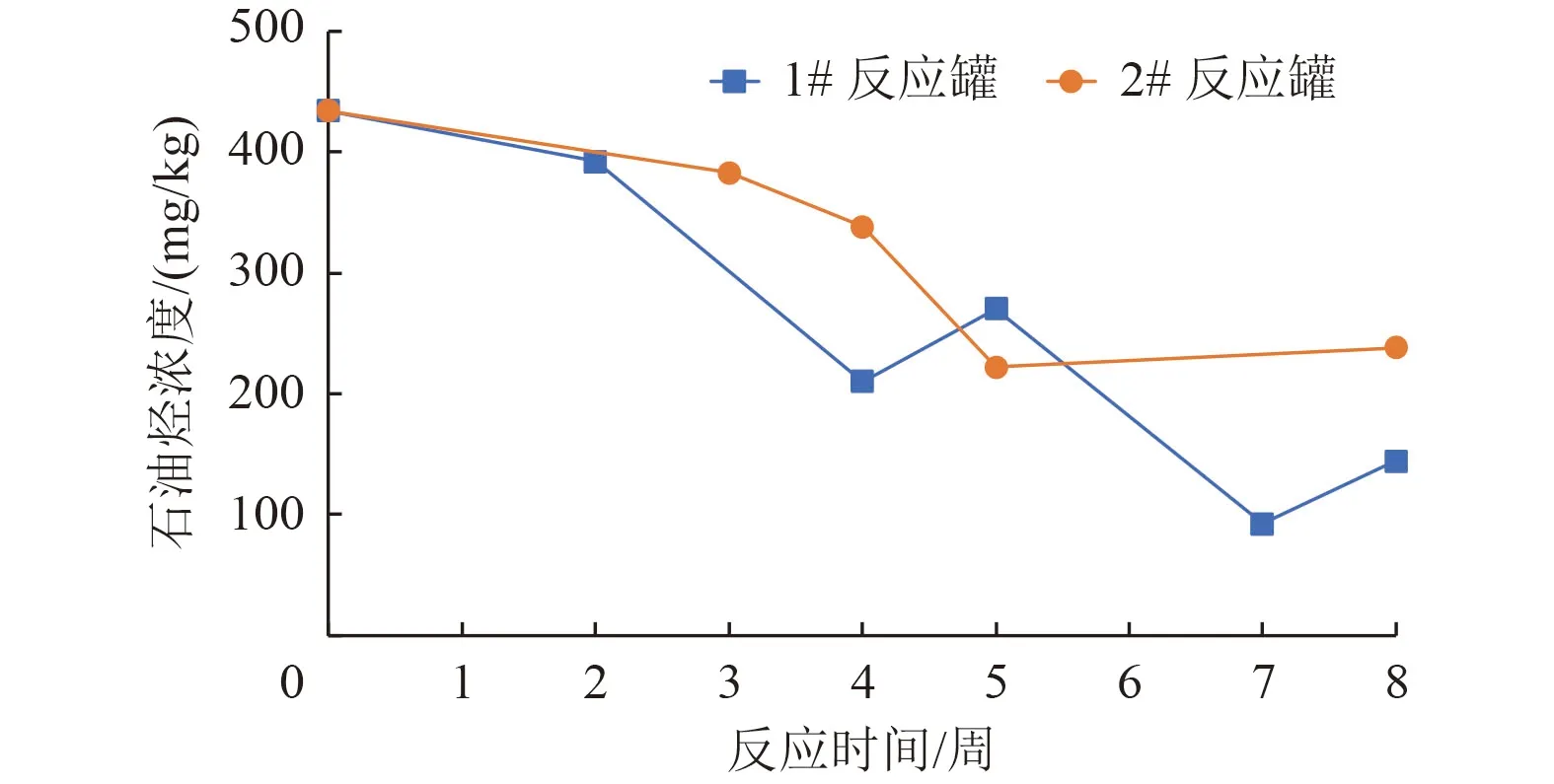
图3 反应罐中石油烃降解Fig.3 Degradation of petroleum hydrocarbons in bioreactor tanks
2.3 泥浆反应罐中菌群结构变化
根据泥浆罐中微生物的绝对丰度(图4)可知,原始的土著微生物含量较低,受到提取DNA 效率限制,无法测定其微生物丰度。从加入微生物菌剂后可以观察到有一定数量的微生物,并且在第2 周开始有增加的趋势,在第3~4 周快速生长,每g 土壤中达到2×109~3×109拷贝数的微生物,然而在第5 周可能由于营养匮乏开始下降。当在第5~6 周添加酵母浸膏等营养物质之后,微生物丰度又开始快速增长,尤其在2#反应罐中,第6 周微生物超过了6×109拷贝数/g。微生物总体数量的增加意味着降解菌可能快速生长,在此过程中达到降解污染物的目的。结合图2 可以看出,1#和2#反应罐污染物浓度均在前4 周内显著下降,2#反应罐所有污染物浓度均达到一类建设用地修复标准。
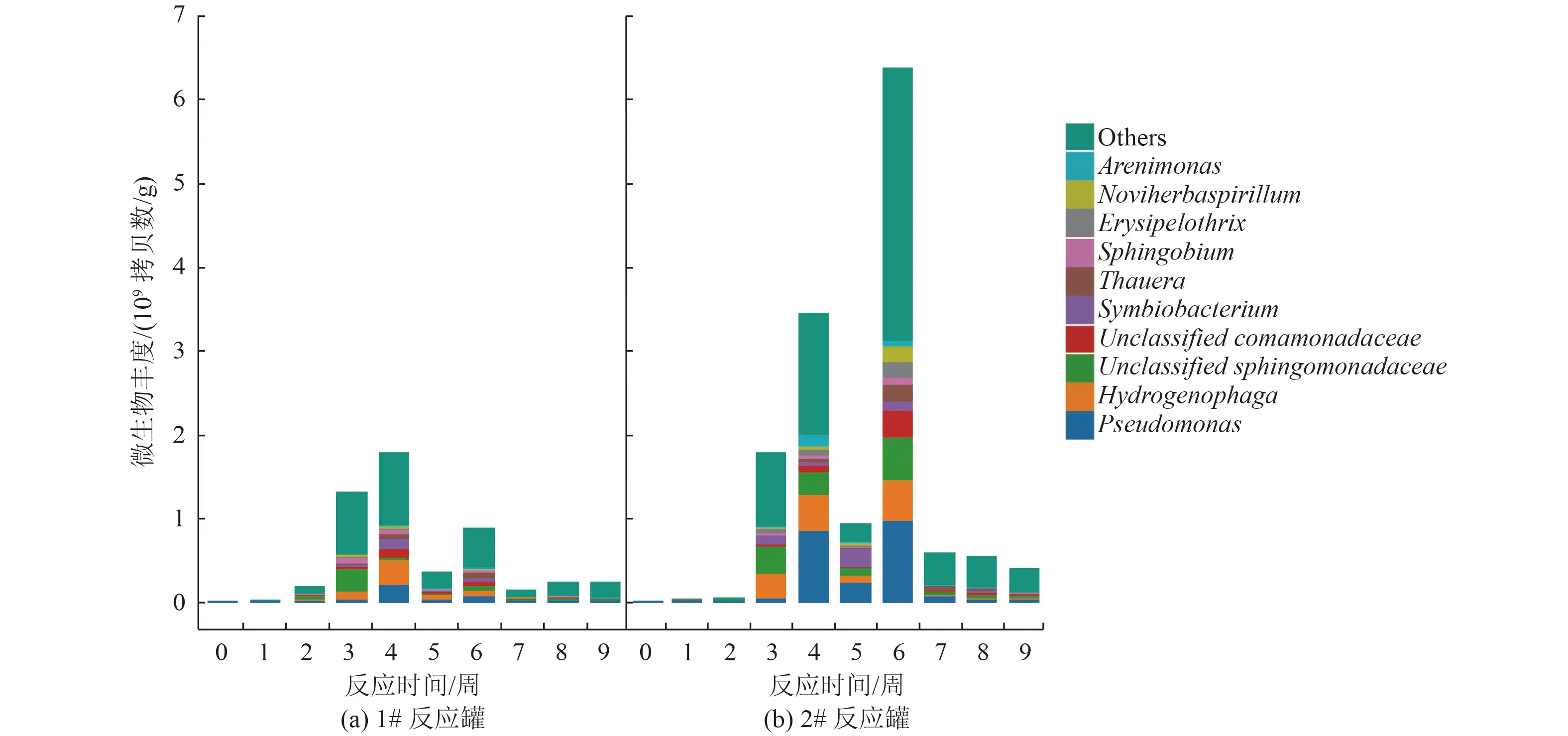
图4 反应罐中微生物多样性监测Fig.4 Microbial diversity monitoring in bioreactor tanks
菌群多样性分析也发现,微生物的群落结构发生了显著变化,与在实验室无菌环境下接种的情况有很大差别。反应第3 周,Hydrogenophaga和Sphingomonadaceae2 个属的菌增殖明显;而第4 周,Pseudomonas属丰度明显上升,并且无法鉴定的其他菌属也开始显著增加,这可能是微生物群落之间的协同降解作用。Hydrogenophaga属的部分菌种在厌氧条件下可以产生表面活性剂从而起到增加PAHs 生物有效性的功能,具有促进降解PAHs 的能力,如研究发现Hydrogenophagasp.PYR1 可以降解苯并[a]芘[20]。Pseudomonas属是常见的PAHs 降解菌[6,21],主要依赖于其产生物表活的能力[22-23]及群体效应基因(如Pseudomonas aeruginosaN6P6 的lasI和rhlI)[24]的表达,而Sphingomonadaceae属有含有多种可降解PAHs 基因的质粒[24-25],但对低环PAHs如萘和菲有更好的表现[26-29]。Comamonadaceae属也是PAHs 降解菌重要的菌属之一。因此中试研究可以发现,在开放的试验条件下,土著微生物、反应条件、复杂的成分影响了菌群结构,与实验室灭菌环境的群落结构差异显著。
2.4 泥浆反应罐重要参数监测
泥浆反应罐中重要参数变化如图5 所示。由于本试验采用的菌剂主要依靠好氧微生物中加氧酶的作用,因此溶解氧浓度是决定降解速率的关键参数。该设备通过底部曝气通入过滤的无菌空气和机械搅拌的方式对反应罐中的泥浆进行增氧,使泥浆溶解氧浓度维持在6~9 mg/L,同时保证固相不沉底且传质均匀。1#和2#反应罐中的溶氧浓度在第3~4 周有下降趋势,这可能与微生物在3~4 周快速生长有关,微生物的快速生长导致溶解氧浓度略微降低。反应结束停止搅拌24 h 后,泥浆出现分层现象,这与试验土壤中的粉土比例高有关,黏土比例高则更容易保持泥浆状态,但搅拌阻力增大。温度也是微生物生长的另一个重要指标,该反应器固定在配备有空调的集装箱中,同时罐体有可加热保温层。由于中试运行在夏季,因此在试验过程中只在温度过高的时间段开启空调,保持反应罐温度在25~40 ℃。在第3~4 周,温度接近最低温度25 ℃,但微生物生长没有受到影响,依然快速增殖,说明该菌剂中微生物温度耐受范围较高。这与已有研究结论相符,反应器在30 ℃左右有利于细菌的增殖[30]。
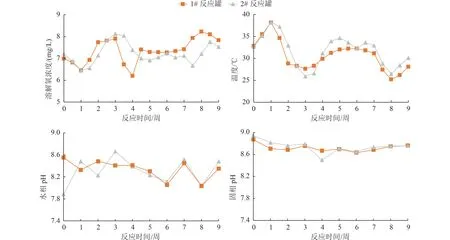
图5 反应罐中的重要参数Fig.5 Key parameters of the reactor tanks
液相和固相的pH 均偏碱性,在8~9 的范围内波动,说明该条件下微生物的活性没有受到影响。微生物在过酸或过碱的环境中都会影响其降解活性,因此在泥浆处理过程中,需保持泥浆搅拌以避免局部厌氧或产生小分子酸积累,造成泥浆pH 降低,持续监测和预警可以保障微生物在泥浆反应器中的持久活性。Forján 等[6]的小试试验显示,泥浆中溶解氧浓度保持5 mg/L 时,仍可以维持微生物的活性,同时发现,pH 在7.0 左右适合微生物生长。这2 个参数是微生物保持活性的重要参数,与微生物种类相关,因此工程应用前需要通过小试和中试试验确定该参数。
3 结论
(1)微生物菌剂中的群落结构在开放环境下与实验室无菌环境下有显著差异,外源强化菌与土著菌的竞争能力、对环境的适应能力有必要通过中试试验进行验证。
(2)本次中试所用商业化菌剂对PAHs 浓度在几十mg/kg 具有良好的降解效果,生物泥浆反应器适合修复中低浓度PAHs 污染土壤。
(3)微生物适宜的pH 接近中性或略偏碱性,适宜温度为25~35 ℃,此时可以较好地降解目标污染物。

