功能菌接种对石油污染土壤修复效果及微生物群落的影响
左一琳,陈文杰,孙慧杰,丁晓艳,詹亚斌,张昊,丁国春,李季,魏雨泉*,刘蕊
1.中国农业大学资源与环境学院
2.中国农业大学有机循环研究院(苏州)
3.北京林业大学水土保持学院
4.生态环境部土壤与农业农村生态环境监管技术中心
随着人们对石油资源需求的增大,土壤的石油污染已成为世界性的环境问题之一[1],而杂环芳烃是石油成分中最为典型的具有三致效应(致畸、致癌、致突变)的有机污染物[2-3],尤其是含硫杂环芳烃,既是原油中硫的主要存在形态,也较传统石油污染土壤中常关注的多环芳烃具有更强的致癌性、生物富集性和稳定性[4],如何高效安全地治理石油污染场地中的含硫杂环芳烃一直是土壤修复中的难点与热点。
针对石油污染土壤的常规处理方法主要有化学法、物理法和生物法[5],其中微生物修复法是利用土壤-微生物-污染物自身的理化性质,基于微生物的新陈代谢,以石油污染物作为培养基,在微生物生长过程中消耗和分解掉污染物,是二次污染最小、最经济、最有效的修复方法[6]。王欣等[7]发现了可以脱除含硫有机化合物中硫的高效Thiobacillus thioparus菌株,最适条件下脱硫率高达94.3%。也有研究证实,通过富集培养石油污染场地土壤中的降解菌,可以从土著微生物中分离纯化,筛选得到石油烃降解细菌琼式不动杆菌,其对石油烃降解率达60.2%[8]。目前很多具有杂环芳烃降解能力的细菌和真菌相继被筛选出来,但对于含硫杂环芳烃的降解微生物要求更高,以典型的含硫杂环芳烃污染物二苯并噻吩(dibenzothiophene,DBT)为例,需要专一性地断开DBT 分子中的C—S 键和C—C 键,因此,相关功能微生物筛选难度大,且多停留于实验室研究阶段。
一直以来,微生物菌种在污染土壤修复过程中应用效果较实验室培养过程弱、稳定性差,是生产实践中面临的最大难题[9]。这是由于接种的微生物要与大量的土著微生物进行竞争,因此较难发挥其在纯培养条件下的污染物分解潜力,且分解效果和接种微生物与土壤中土著微生物的群落关系密切相关[10]。研究表明,接种土著菌和外源菌后,外源菌的生物量随处理时间的延长而降低,而土著菌生物量则随处理时间的延长而增加[11];也有研究证明,外源菌群激活了土著菌群的降解功能,促进了微生物之间的协同合作,进而达到生物修复的效果[12-13]。但微生物接种是否可以强化土著微生物功能,结合其自身降解能力提升石油污染土壤净化能力尚需进一步研究。
前期研究表明,从石油污染土壤中筛选的DBT 降解菌Rhodococcussp.ZYL-1 在培养基中具有较好的DBT 去除率。为进一步探讨该菌株(红球菌)在石油污染土壤中的应用效果,分析功能菌(红球菌)接种对土壤培养过程中DBT 的降解水平,结合16S rDNA 高通量测序及生物信息学分析,解析功能菌接种对土壤细菌群落演替和多样性动态变化的影响,系统阐述生物强化对土壤DBT 降解功能种群的影响,以期为微生物修复石油污染土壤提供理论与技术支撑。
1 材料与方法
1.1 试验材料
试验菌株分离于山西某石油污染土壤,所在区域属温带大陆性季风气候,年平均气温为11 ℃,年降水量约为400 mm。石油污染土壤为砂质壤土,DBT 浓度为2.87 mg/kg,有机碳浓度为23.87 g/kg,全氮浓度为1.30 g/kg,速效磷浓度为69.26 mg/kg,含水率为8.70%。菌株经生理生化鉴定和16S rDNA 鉴定为红球菌属,革兰氏反应阳性,命名为Rhodococcussp.ZYL-1,已于2022 年5 月18 日保藏于中国普通微生物菌种保藏与管理中心(CGMCC),保藏编号为CGMCC 24903[7]。
功能菌剂制备:利用溶菌肉汤固体培养基活化菌种Rhodococcussp.ZYL-1,挑取单菌落接种于溶菌肉汤液体培养基扩培,至对数生长期,活化好的菌液(菌浓度为1×108CFU/mL)可作为功能菌剂备用。
1.2 试验设计与方法
1.2.1 试验设计
试验分为2 组,石油污染土壤为自然降解组,编号NAT;石油污染土壤+功能菌为生物强化组,编号BIOEIF,菌株Rhodococcussp.ZYL-1 接种浓度为1×108CFU/mL。将土壤样品去除砂粒、植物残体等杂物,过18 目筛备用。试验于1 000 mL 锥形瓶中进行,向每个锥形瓶中加入1 kg 前期所取的石油污染土壤,向土壤中添加浓度为100 mg/L 的二苯并噻吩-乙酸乙酯溶液,每个处理设3 个平行样。取100 µL于-20 ℃保存的菌液Rhodococcussp.ZYL-1,接种于5 mL 灭菌LB 液体培养基,摇床30 ℃、150 r/min活化12 h,转接1 mL 活化的菌种至100 mL 灭菌的液体LB 培养基,培养12 h。离心收集菌体,用无菌蒸馏水稀释至108CFU/mL。添加10%(v/w)的菌悬液至BIOEIF 组,搅拌混匀。试验在25 ℃的暗箱中进行,保持土壤含水率为15%~20%。培养周期为40 d,每隔10 d 取样50 g,存放于-20 ℃冰箱中,用于后续DBT 和DNA 提取,每个样品3 次重复。
1.2.2 二苯并噻吩测定方法
(1)土壤中DBT 的提取。将土样移入250 mL锥形瓶中,用100 mL 超纯水将土壤打散;加入20 mL 乙酸乙酯振荡20 min,经超声萃取20 min 后,重复振荡20 min,静置分层;将上层清液移至离心管中离心,回收上层透明清液,过0.22 µm 有机滤膜。
(2)仪器分析条件。色谱条件为TG-5SILMS 色谱柱(30 m×0.25 mm,0.25 µm)。色谱柱温度程序:50 ℃保持2 min,然后以15 ℃/min 程序升温至250 ℃,保持2 min,总时长19.333 min。载气为氦气,纯度≥99.999%;氦气流速为1 mL/min;进样口温度为250 ℃;不分流进样,进样量为1 µL。质谱条件:电子轰击离子源(EI 源);电离能量为70 eV;离子源温度为280 ℃;传输线温度为280 ℃;选择离子监测(SIM)模式,保留时间为13.41 min,定量离子为152(m/z),定性离子为184、139(m/z)。
1.2.3 土壤DNA 抽提、PCR 扩增及高通量测序
土壤DNA 的提取按照Fast DNA TM Spin kit for soil 试剂盒进行,使用1%的琼脂糖凝胶电泳检测DNA 的提取质量,使用NanoDrop2000 测定DNA 浓度和纯度;使用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和 806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA 基因V3~V4 可变区进行PCR(ABI GeneAmp® 9700 型)扩增。扩增程序如下:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s,72℃延伸30 s);72 ℃稳定延伸10 min,在4 ℃进行保存。PCR 反应体系为5×TransStart FastPfu 缓冲液4 µL,2.5 mmol/L dNTPs 2 µL,上游引物(5 µmol/L)0.8 µL,下游引物(5µmol/L)0.8 µL,TransStart FastPfu DNA 聚合酶0.4 µL,模板DNA 10 ng,用H2O 补足至20 µL。每个样本重复3 次。PCR 产物采用Illumina 公司MiSeq PE300 平台进行高通量测序,测序和数据分析工作均由上海美吉生物医药科技有限公司完成。
1.3 统计分析
使用fastp 软件[14]对原始测序序列进行质控,FLASH 软件[15]进行拼接,应用UPARSE 软件[14]根据97%[16-17]的相似度对序列进行OTU 聚类并且去除嵌合体。利用RDP classifier[18]对每条序列进行物种分类注释,比对Silva 16S rRNA 数据库(version 138),设置比对阈值为70%。使用vegan 包[19]和picante包[20]计算样品的α多样性,包括香农多样性、Chao1 丰富度、辛普森均匀度和系统发育多样性。使用vegan包进行基于Bray-Curtis 距离的主坐标分析(PCoA),用来评估所有样品的β多样性。使用pheatmap包绘制带有聚类树的热图,venn 包绘制韦恩图。应用分子生态学网络分析(MENA)构建OTU 水平的共现网络[21],并用Gephi 0.9.2 软件进行可视化。
2 结果与讨论
2.1 功能菌接种对石油污染土壤DBT 降解的影响
对比NAT 和BIOEIF 2 组处理土壤中DBT 的降解情况,结果如图1 所示。基于气相色谱分析发现,培养40 d 后,接种Rhodococcussp.ZYL-1 的土壤DBT 降解率达到59.46%,显著高于仅通过土壤土著微生物的自然降解效果(49.99%)(P<0.001)。通过进一步分析培养过程中DBT 的降解率可以看出,石油污染土壤培养过程中,不论是否接种功能菌,随培养时间的增加DBT 降解率均呈现稳定升高的趋势,但培养30 d后,土壤微生物对于DBT 的降解减缓,进入稳定期。DBT 的降解主要发生在前10 d,在培养第10 天,NAT 组和BIOEIF 组的DBT 降解率分别达34.57%和51.04%,BIOEIF 组相比NAT 组降解率提升了16.47%,说明接种Rhodococcussp.ZYL-1 可以显著提高DBT 的快速降解能力,但功能菌对土壤DBT 快速降解的持续效果有待提升。整个土壤培养过程中,BIOEIF 组的DBT 降解率显著高于NAT 组,说明向土壤中接种DBT 降解菌显著促进了土壤中DBT 的生物降解。这与郭志国等[22]在纯培养的条件下,DBT 降解菌对于DBT 的降解率在72 h 就达到59.83%的结果相类似。
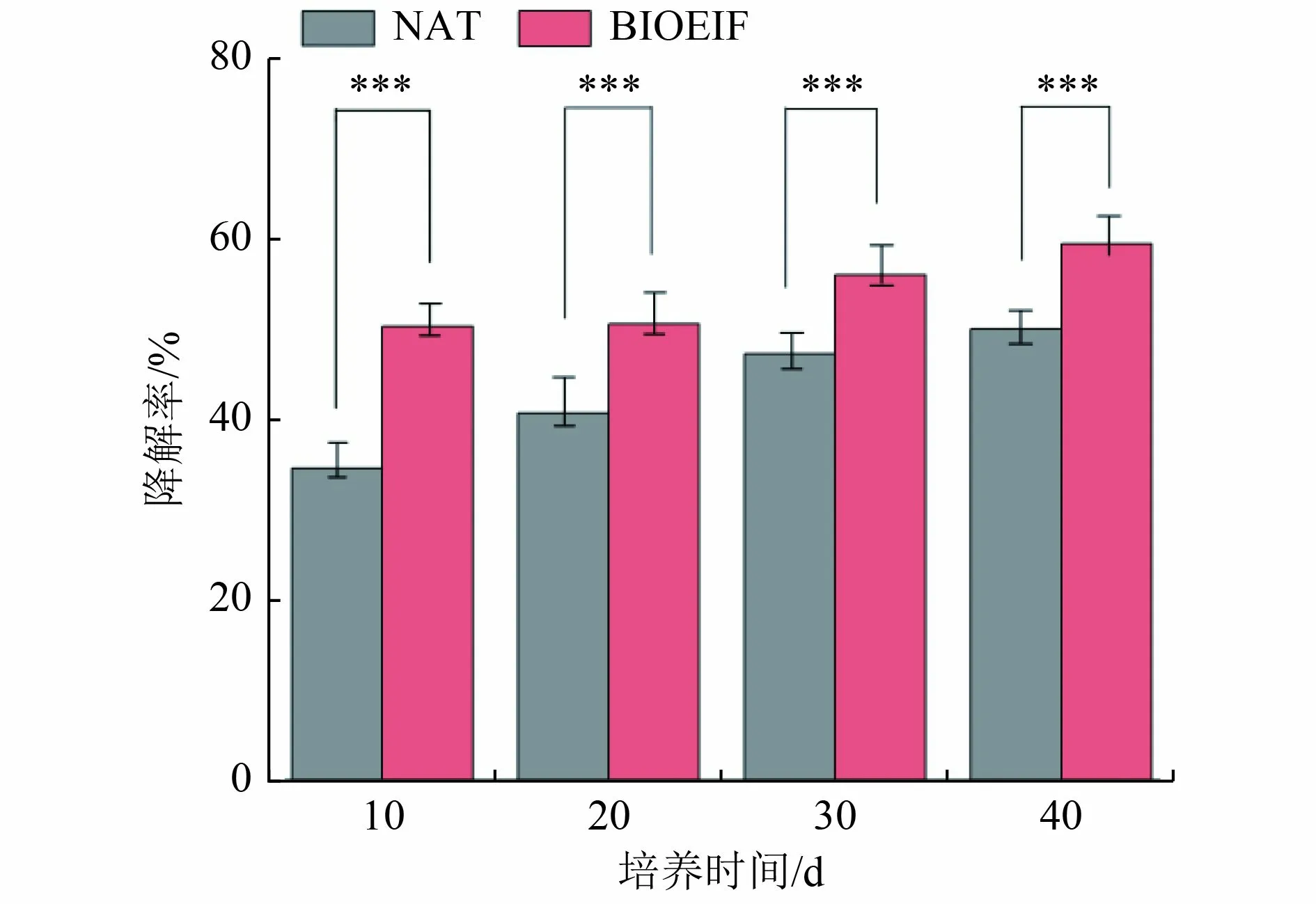
图1 二苯并噻吩在土壤系统中的降解情况Fig.1 Degradation profile of dibenzothiophene in the soil system
2.2 污染土壤培养过程中细菌群落演替特征
根据97%的序列相似性,在所有样本中检测到1 318 个OTUs,其中1 238 个OTUs 在2 个处理组中共同出现(图2)。这表明接种功能菌Rhodococcussp.ZYL-1 不会对污染土壤的土著微生物群落种类造成明显影响。在门水平上分析结果表明(图3),Firmicutes、Actinobacteria 和Proteobacteria 是污染土壤培养过程中的主要优势类群,这与祁燕云等[23-24]的研究结果相似。在所有样品中,三者的相对丰度之和均在90%以上。在土壤培养初期Firmicutes丰度最高,随着土壤培养到第40 天,Actinobacteria和Proteobacteria 的丰度均有不同程度的提升。层次聚类热图(图4)显示,2 个处理组中属水平丰度前25 的细菌可聚类为4 组,其中Micromonospora、Bacillus、unclassified_f_Planococcaceae聚为1 组,为污染土壤培养过程中的优势菌属,Micromonospora被认为是常见的可降解污染土壤中石油烃的微生物[25],Bacillus已被多次报道对DBT有很高的降解能力,可通过“4S”脱硫途径代谢DBT[26]。在BIOEIF 组中,接种的功能菌Rhodococcussp.ZYL-1虽未出现在基于丰度前25 物种的热图中,但在种水平分析中仍可检测到该物种的存在,间接证明接种功能菌在石油污染土壤中存在定殖,结合图1 的降解结果,说明接种的Rhodococcussp.ZYL-1 不仅自身对DBT 起降解作用,同时协同促进了其他DBT 降解菌的降解作用。
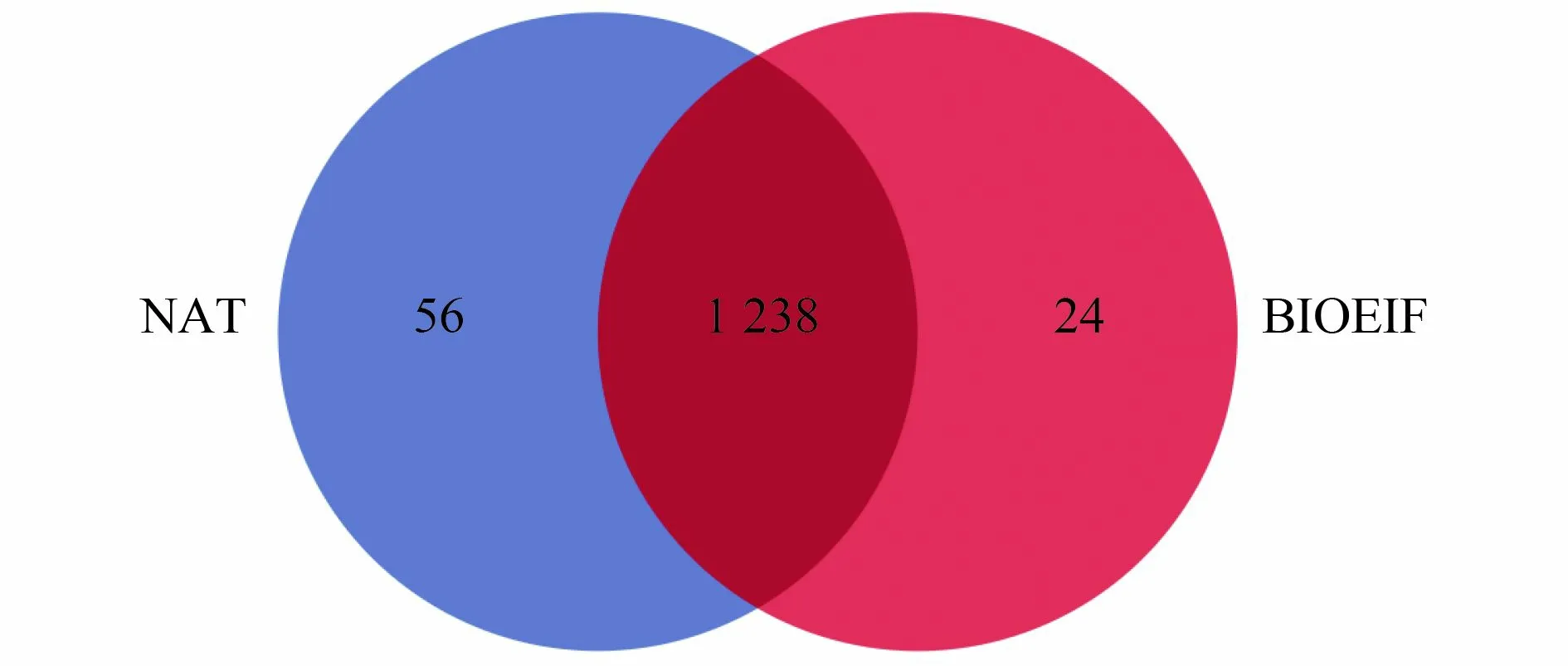
图2 不同处理中OTUs 的数量差异Fig.2 Quantitative differences of OTUs in different treatments
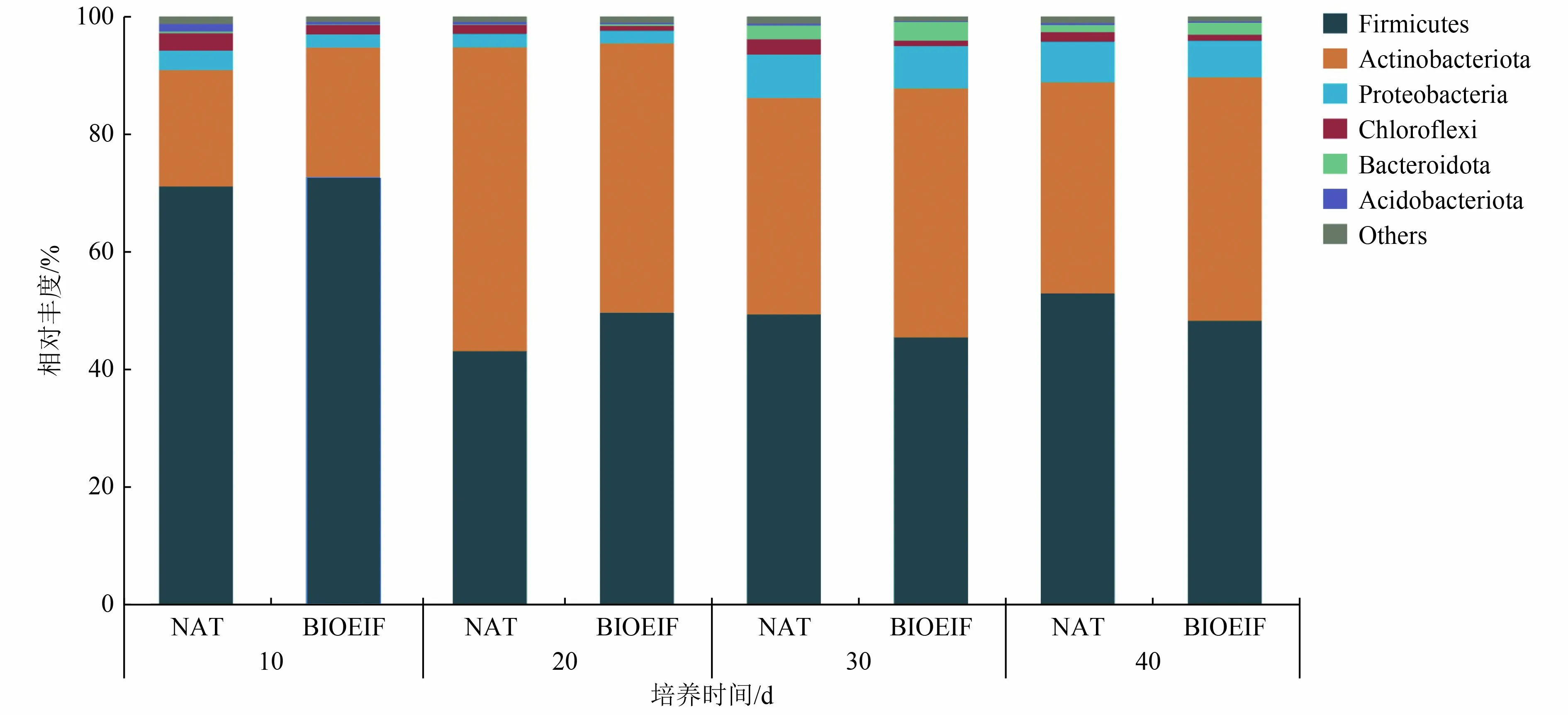
图3 门水平的相对丰度Fig.3 Relative abundance at the phylum level
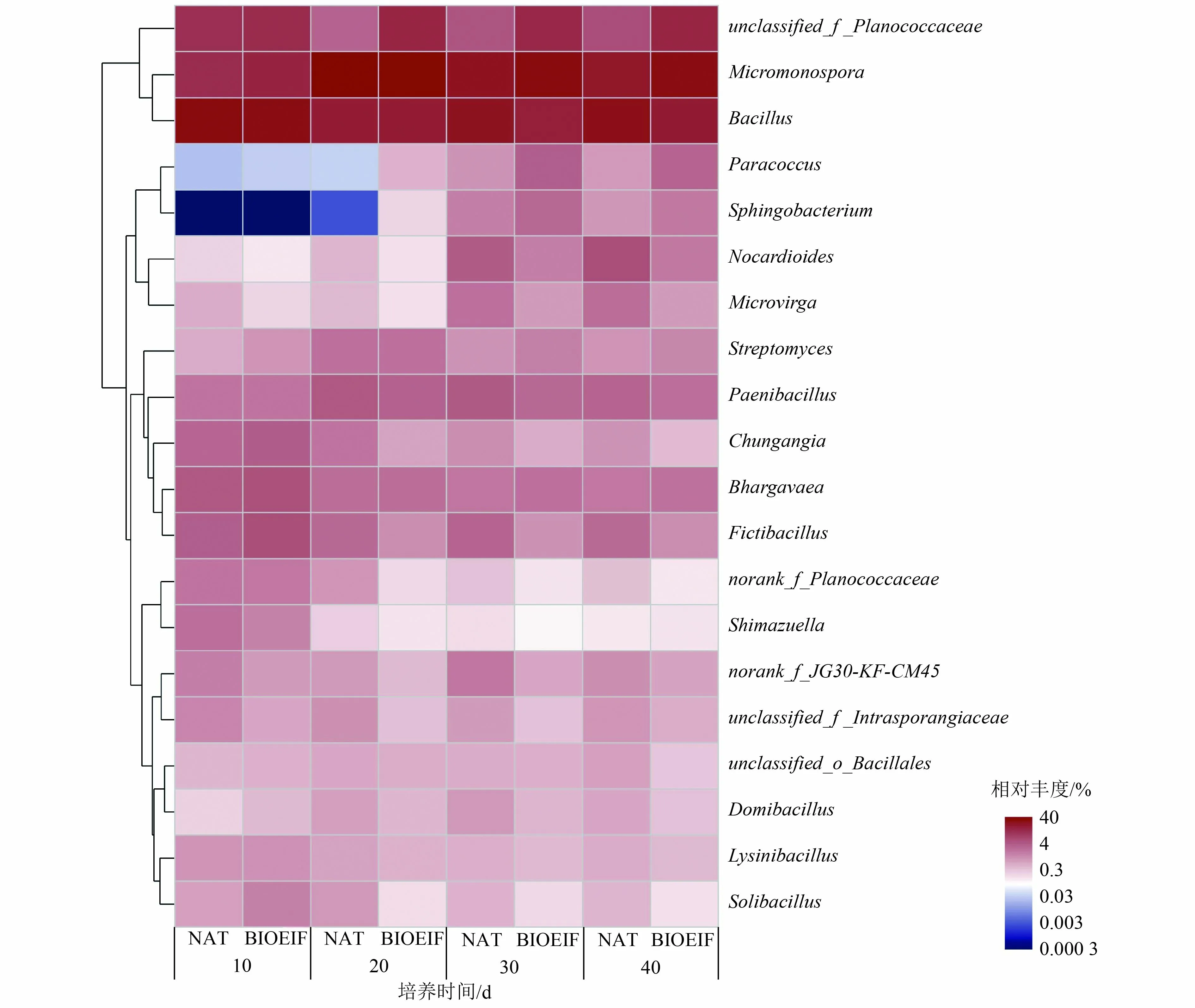
图4 属水平的相对丰度Fig.4 Relative abundance at the genus level
通过α 多样性计算方法分析石油污染土壤培养期间的细菌群落香农多样性指数、Chao1 丰富度指数、辛普森均匀度指数以及系统发育指数(图5)。从图5 可以看出,培养40 d 过程中,不同处理组细菌多样性均呈现先降低后升高并趋于稳定的规律,这可能是造成DBT 降解率前期高,而后期减缓的原因。BIOEIF 组的香农多样性指数和系统发育指数低于NAT 组,尤其在培养30 d 以后显著低于NAT 组(P<0.05)。培养后期,BIOEIF 组的辛普森均匀度指数和Chao1 丰富度指数也低于NAT 组,但未达到统计学的显著性。基于Bray-Curtis 异质性矩阵的主坐标分析(PCoA)被用来显示所有样品之间的差异(图6)。根据PCoA 以及置换次数999 次的ANOSIM 分析表明,所有样品在土壤培养过程中的细菌群落分为2 类(R=0.261 7,P<0.05)。以上结果表明,接种Rhodococcussp.ZYL-1 会显著影响DBT污染土壤的α多样性和β多样性。
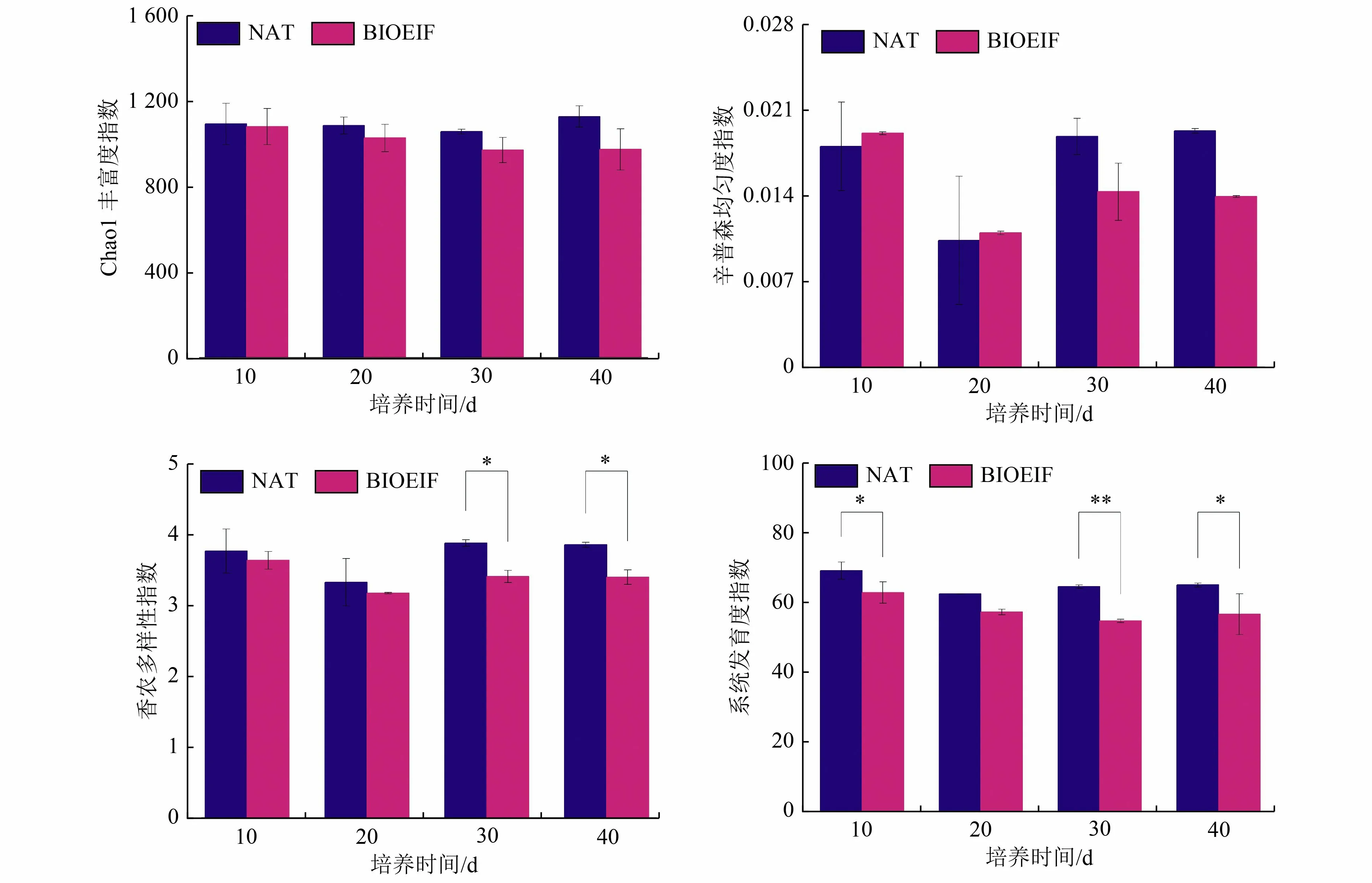
图5 不同处理污染土壤培养过程中的细菌多样性Fig.5 Bacterial diversity during the incubation of contaminated soil with different treatments
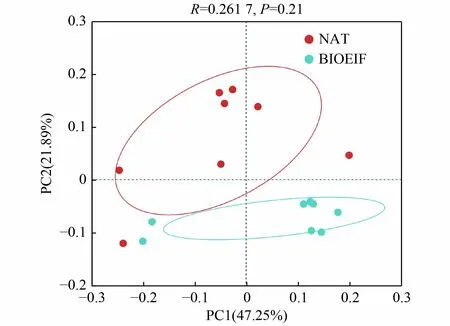
图6 不同处理污染土壤培养过程中基于OTUs 水平的PCoA 细菌群落结构Fig.6 PCoA on OTU level during the incubation of contaminated soil with different treatments
2.3 降解DBT 的关键微生物分析
在石油污染土壤培养过程中细菌群落组成和功能的变化必然会影响DBT 的降解。因此,利用网络分析挖掘在土壤培养过程中与DBT 降解相关的关键细菌,有助于进一步理解接种Rhodococcussp.ZYL-1 对土壤微生物功能变化的影响。本研究通过细菌属水平数据进一步筛选了不同处理的DBT 降解关键微生物(P<0.05,R>0.9)(图7)。在NAT 组以及BIOEIF 组中分别有24、29 个节点与DBT 降解显著相关,即视为DBT 降解的关键物种。在NAT 组中,与DBT 降解相关的关键细菌主要属于Firmicutes 和Bacteroidota,而BIOEIF 组中的关键降解菌主要属于Firmicutes 和Actinobacteriota,这与此前报道的Firmicutes、Bacteroidota 和Actinobacteriota等优势门对石油烃的降解有显著响应的结论相符[23-24,27]。从属水平看,Shimazuella、Gracilibacillus以及g_unclassified_o_Chitinophagales在2 个处理中均作为关键潜在降解菌出现,是NAT 组和BIOEIF 组中与DBT 降解相关的共有菌属,基于2.2 节对不同处理组细菌相对丰度分析的结果,发现Shimazuella同时是石油污染土壤培养过程中丰度前25 的主要优势属。根据以上结果推断,Shimazuella更可能是潜在的具有DBT 降解能力或者参与DBT 代谢的关键菌属。另外,从图4 还可以发现,在对BIOEIF 组和NAT 组的网络分析中筛选出的关键物种大多数与DBT 降解率呈显著正相关,说明这些关键菌可以促进土壤中DBT 的降解,但Micromonospora与DBT 降解呈显著负相关,说明Micromonospora可能会与其他降解菌存在竞争或抑制作用,不利于DBT 的降解。
为进一步探究接种功能菌对土壤细菌群落物种间互作关系的影响,基于随机矩阵理论在OTUs 水平上构建了土壤细菌群落的分子生态网络(图8),并计算了网络拓扑特征参数。从图8 可以看出,BIOEIF 组的核心微生物网络节点数(673)低于NAT 组(779),边的数目(1 639)也明显低于NAT 组(1 721),与细菌群落多样性结果相似,说明接种功能菌淘汰了没有降解能力的土著微生物,从而提高降解效果。基于网络连接度和模块化指数指标(如avgK、avgCC 等)分析发现,接种Rhodococcussp.ZYL-1 显著提升了核心微生物网络聚类系数和图密度,使核心物种间联系更紧密。在网络分析中,通常认为正相关连接反映物种之间的合作关系,负相关连接代表物种之间的竞争关系,对比BIOEIF 组和NAT 组可以看出,BIOEIF 组中正相关关系比例(57%)明显高于NAT 组(44%),说明接种Rhodococcussp.ZYL-1 提高了核心物种间的协同合作关系,这也可能是接种功能菌虽然降低土壤物种多样性但却提升了生物修复效果的原因。
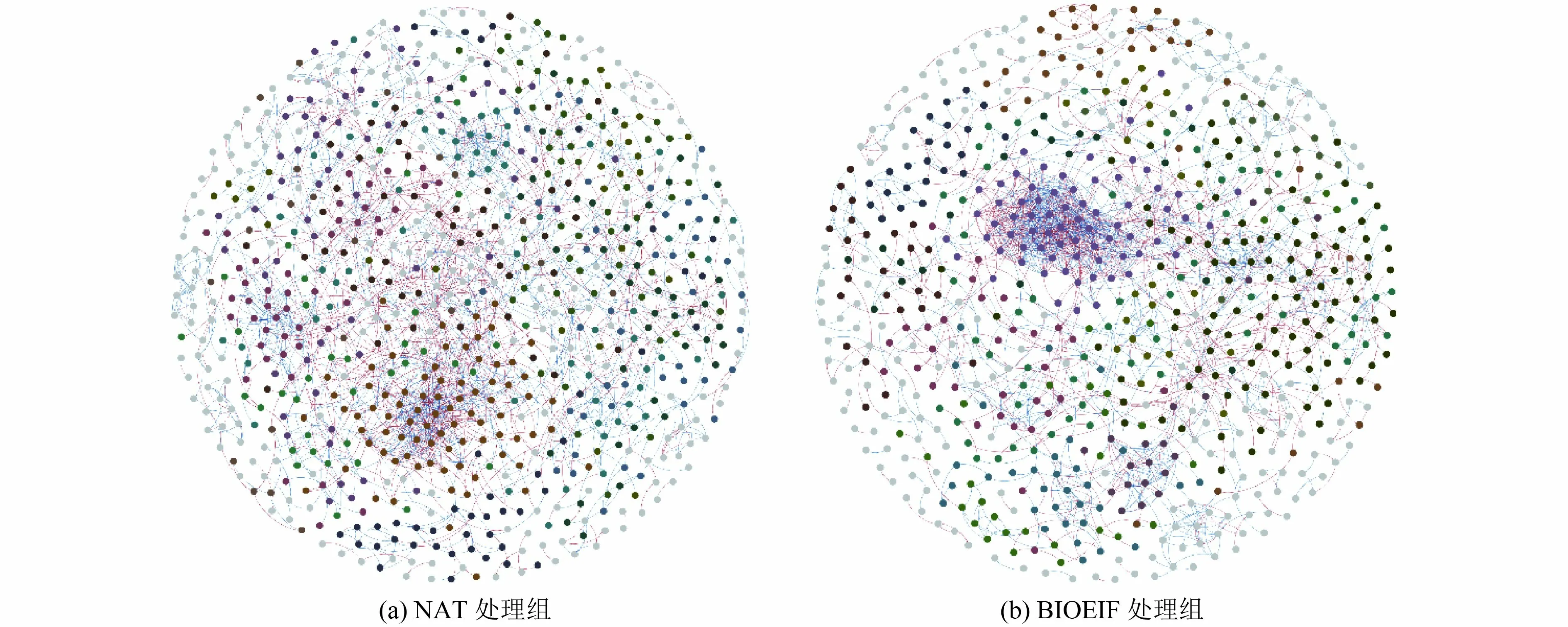
图8 不同处理中细菌 OTUs 分子生态网络分析Fig.8 Network association of bacterial OTUs in different treatments
3 结论
(1)接种Rhodococcussp.ZYL-1 显著提高了石油污染土壤的DBT 降解率,培养40 d 后降解率达到60%,其提升效果在土壤培养前10 d 最强。
(2)Micromonospora、Bacillus、unclassified_f_Planococcaceae为石油污染土壤培养过程中的优势菌属,接种Rhodococcussp.ZYL-1 未对DBT 污染土壤的细菌群落组成造成显著影响,但是却降低了DBT 污染土壤的细菌群落的α多样性,Rhodococcussp.ZYL-1 并未成为BIOEIF 组中的优势物种。
(3)接种Rhodococcussp.ZYL-1 提 升了土壤DBT 降解关键菌种类和数量,尤其是Shimazuella可能是参与DBT 的分解代谢的关键微生物,接种Rhodococcussp.ZYL-1 显著提高了核心物种间的协同合作关系,这可能是功能菌强化土壤DBT 降解的主要原因。

