多环芳烃降解菌及其应用研究进展
李花,赵立坤,包仕钰,余晓龙,毛旭辉,陈超琪*
1.武汉大学资源与环境科学学院
2.南方科技大学环境科学与工程学院
多环芳烃(PAHs)是一类由2 个或2 个以上苯环组成的线性、角状或簇状排列的芳香族化合物。环境中的PAHs 既有自然来源,如火山活动、森林植被和火灾等,也有人为来源,如化石燃料、木材和垃圾燃烧及煤矿开采等[1]。PAHs 是一类环境持久性污染物,广泛存在于土壤、水和空气中[2]。PAHs 具有生物富集性和“三致”(即致突变性、致畸性和致癌性)效应,对生态和人体健康产生潜在的危害[3]。PAHs 存在多种人体暴露途径:1)大气中的PAHs 极易被细小颗粒吸附,通过大气粉尘被人体吸入,如果长期暴露,PAHs 也可以通过皮肤接触进入人体[4];2)PAHs 还可通过干湿沉降和气-液-固界面交换过程进入水体或土壤,并扩散到地表水和地下水,从而污染饮用水水源[5];3)土壤中的PAHs 也可被植物根系吸收,通过累积、代谢、迁移和转化等过程,最终经由食物链进入人体[6]。因此,亟须开发高效的PAHs污染场地的治理和修复技术。
为了去除污染场地中的PAHs,国内外学者开发了多种技术[7]。其中,光催化氧化、化学氧化、电动和热技术及土壤淋洗等物理和化学技术存在技术复杂、成本高和二次污染严重等缺点[8]。与物理和化学技术相比,生物降解技术具有成本效益高和环境友好的特点[2]。以“biodegradation of polycyclic aromatic hydrocarbons” 为主题词通过 Web of Science 核心数据库进行检索,并使用文献计量在线平台分析1989—2022 年的相关研究论文。结果表明,1989—2022 年PAHs 生物降解领域的发文量呈逐年上升趋势〔图1(a)〕。2021 年发文量达到344 篇,为2000 年的4.2 倍,中国是发文量最多的国家,其次是美国和印度。菲和芘是PAHs 生物降解领域排名靠前的关键词〔图1(b)〕,说明这2 类典型PAHs 的生物降解受到重点关注。PAHs 的生物降解可分为好氧降解和缺氧降解。除特定环境条件下(如河湖底泥等缺氧/厌氧环境),好氧降解被认为是高效的生物降解方式[9]。然而,目前对PAHs 降解菌好氧降解机制仍缺少系统性的综述,此外,PAHs 降解菌在实际污染场地中的应用往往受环境条件等多因素制约[10]。本文重点阐述PAHs 降解菌、降解机制及其在实际污染场地应用方面的研究进展与存在的不足,并对未来的研究进行展望,以期为PAHs 污染防治提供参考。
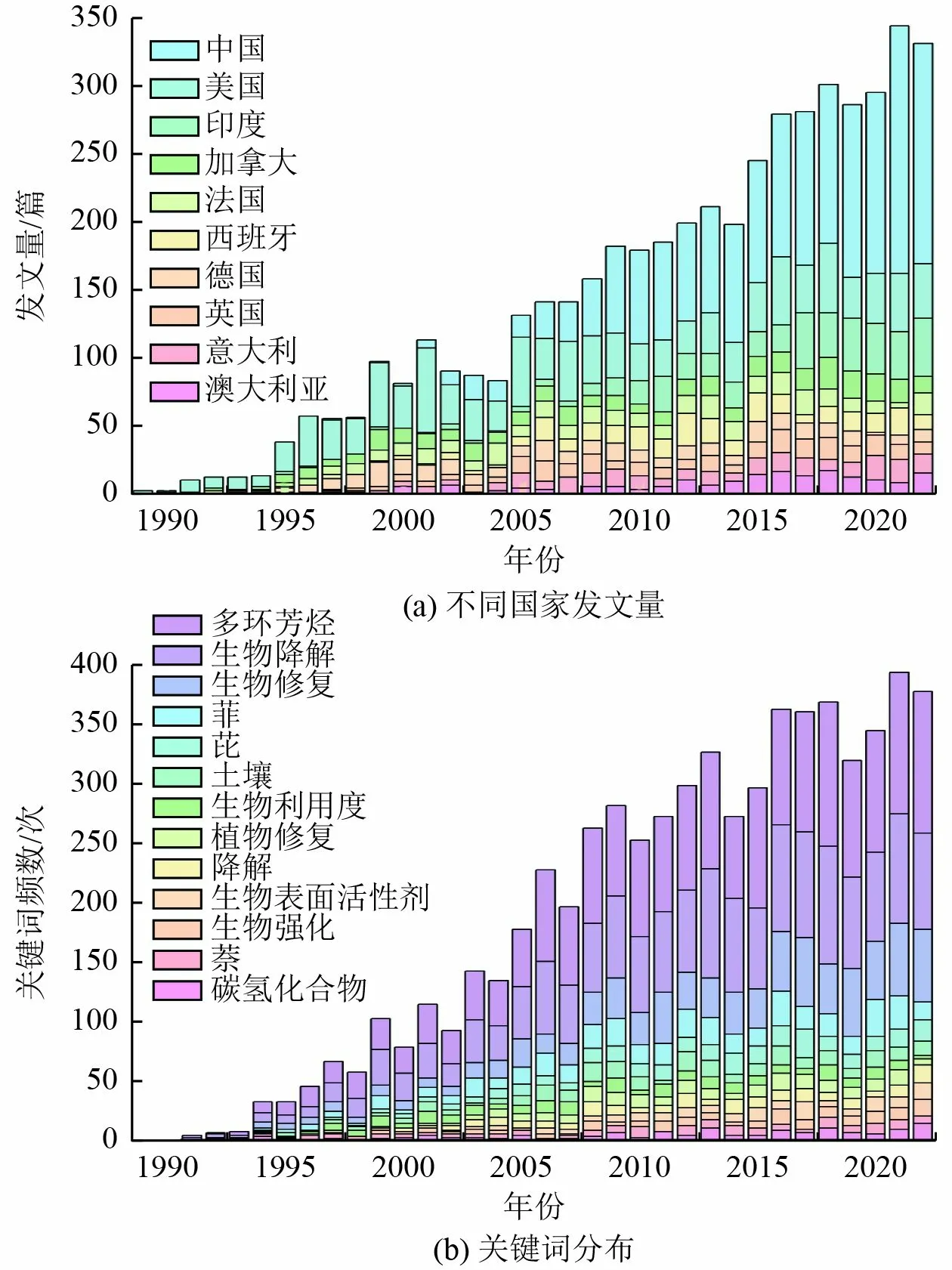
图1 1989—2022 年PAHs 生物降解领域Web of Science文献计量分析Fig.1 Bibliometric analysis of literatures on biodegradation of PAHs based on Web of Science from 1989 to 2022
1 PAHs 降解菌及其降解机制
1.1 PAHs 降解菌
PAHs 降解菌可分为降解菌株和降解菌群。这些菌株或者菌群通过分泌特定的酶,经过一系列的酶催化反应,将PAHs 分解为小分子的化合物。
1.1.1 PAHs 降解菌株
降解菌株是指能够独立完成PAHs 降解过程的微生物,它们具有特殊的代谢途径和酶系统,能够针对PAHs 特定的结构进行降解。降解菌株主要包括细菌和真菌两大类[11]。
大部分研究通过培养的方式分离降解菌株,将富含微生物的水体或土壤样品经过预处理后涂布到添加了一定浓度的某种或某几种PAHs 的基础盐培养基中,经过多次培养和富集,从平板上分离生长的菌株并进行鉴定[12]。PAHs 降解菌株主要包括分枝杆菌属(Mycobacterium)、假单胞菌属(Pseudomonas)以及微杆菌属(Microbacterium)。理论上讲,这些菌株能够以PAHs 作为唯一碳源生长,说明其具有降解PAHs 的性能。不同菌株对PAHs 的降解率差异很大,降解周期在3~45 d,降解率为10%~100%,而降解率受PAHs 种类、培养介质等因素的影响(表1)。例如,Wanapaisan 等[13]采集了富含微生物且未被污染的海面红树林沉积物样本,通过富集分离出了5 种降解菌株,其中,Mycobacteriumsp.PO1 和Mycobacteriumsp.PO2 2 种分枝杆菌可以在6 d 完全降解100 mg/L 芘;Liu 等[14]从天津地区受PAHs 和石化产品污染的土壤中分离得到菌株Pseudomonassp.MPDS,在多种PAHs 复合污染条件下,该菌株在84 h 能够完全降解1 000 mg/L 的萘,在96 h 对100 mg/L 二苯并呋喃和1 000 mg/L 二苯并噻吩的降解率分别为65.7%和32.1%;Kumari 等[15]在液体培养基中评估了5 种菌株降解PAHs 的能力,其中,Microbacteriumesteraromaticum在45 d 对10 mg/L 萘的降解率为80.4%,而Pseudomonasaeruginosa在45 d 对3.5 mg/L菲和6.5 mg/L 苯并[b]荧蒽的降解率分别为67.1%和61.2%。综上,Mycobacterium、Pseudomonas和Microbacterium中的某些菌株具有较好的PAHs降解性能。此外,同一种降解菌株对萘和菲的降解率要高于二苯并呋喃和二苯并噻吩等高环PAHs。

表1 PAHs 降解菌株及其降解率Table 1 PAHs degrading bacteria strains and degradation efficiencies
某些真菌菌株,尤其是白腐真菌也具备PAHs 的降解性能。如Imam 等[27]研究了一种白腐真菌Trametes maximaIIPLC-32 对芘的降解能力。结果表明,Trametes maxima在16 d 对10、25 和50 mg/L芘的降解率分别为79.8%、65.4%和56.4%,说明高浓度的芘可能抑制Trametes maxima的活性。Valentín 等[28]研究发现,在添加10~23 g/L 葡萄糖后,白腐真菌(Bjerkanderasp.BOS5)能够在生物泥浆反应器中生长,该真菌在18~26 d 对芘、荧蒽、二苯并噻吩和䓛的最高降解率分别为80.6%、31.2%、93.1%和83.4%。Arifeen 等[29]探究了10 种真菌对菲、芘和苯并[a]芘的降解能力。结果表明,其中2 种白腐真菌(Schizophyllumcommune和Irpex lacteus)在10 d 对菲的降解率分别为24.8%和12.9%,对芘的降解率分别为18.1%和9.7%,对苯并[a]芘的降解率分别为13.1%和5.0%。由此可见,真菌对PAHs 的降解性能低于PAHs 降解细菌。然而,真菌在适应某些特定的复杂环境中相比细菌有一定的优势,但针对PAHs 降解真菌的应用研究仍较少。
1.1.2 PAHs 降解菌群
降解菌群是由多种微生物组成的群体,共同参与PAHs 的降解过程。微生物之间可能存在协同作用,从而提高PAHs 的降解率[30]。PAHs 降解菌群主要是从PAHs 污染水体或土壤中富集[13],并在LB 培养基或含PAHs 的基础盐培养基中进行培养。一般地,PAHs 菌群比PAHs 单一菌株有更高效的降解性能[30-31]。如 Wanapaisan 等[13]将Mycobacteriumsp.PO1 和Mycobacteriumsp.PO2 与其他菌株共培养,发现共培养体系相比单一菌株对芘有更高降解率。Zhong 等[32]将Mycobacteriumsp.A1-PYR 和Sphingomonassp.PheB4 混合培养,发现该菌群在第3 天对10 mg/L 菲、荧蒽和芘的降解率分别达到100%、71.2%和50%。相比单一菌株,混合培养菌群对芘的降解率显著增加[30]。Zhang 等[33]发现一个富含Sphingobiumsp.和Pseudomonassp.菌群,在60 h可完全降解5 mg/L 菲,对100 mg/L 二苯并噻吩的降解率为94%。PAHs 降解菌群及其降解率见表2。

表2 PAHs 降解菌群及其降解率Table 2 PAHs degrading consortia and degradation efficiencies
真菌菌群和细菌-真菌混合体系对PAHs 的降解鲜有报道。Atagana[37]研究发现,由Fusarium flocciferum、Trichoderma、Trametesversicolor和Pleurotus组成的真菌菌群在30 d 对土壤中150~250 mg/kg PAHs 的降解率达到了21%~93%。Jiang等[31]发现在真菌中添加BacillusthuringiensisFQ1显著提高了菲的降解率,3 个月对500 mg/kg 菲的降解率为95.1%。
综上所述,与单一菌株相比,菌群对PAHs 的降解效率一般更高。一方面,菌群中的某些菌株可能利用其他菌株转化PAHs 过程产生的中间产物,从而提高PAHs 降解效率[38];另一方面,某些菌株可能产生表面活性剂,提升PAHs 的生物利用性[39]。但菌群内不同菌种对PAHs 降解的贡献仍有待研究。
1.2 典型PAHs 降解机制
微生物一般通过表达特定的降解基因和降解酶,产生一系列的代谢反应,进而实现对PAHs 的转化和降解[40]。其中,革兰氏阳性菌(如红球菌、分枝杆菌和诺卡菌)所携带的降解基因主要有nid、phd、baa 和pdo,革兰氏阴性菌(如假单胞菌、拉尔斯顿菌、伯克霍尔德菌、鞘氨单胞菌和聚芳单胞菌)所携带的降解基因主要有nah、nag、pah、phn、C12O 和C23O[40]。降解基因编码酶主要包括双加氧酶、水合酶、醛缩酶和脱氢酶(表3)。

表3 PAHs 降解菌、降解基因和编码酶Table 3 PAHs degrading bacteria,associated genes and encoding enzymes
4 种典型PAHs 萘、菲、芘和苯并[a]芘的好氧降解途径如图2 所示。一般地,萘、菲和芘等PAHs降解包括几个阶段:1)在nahAa、nahAb、nidA 或nidAB 等基因编码的双加氧酶作用下实现芳香环的羟基化,形成顺式二氢二醇[11,57-58];2)在nahB 或phdE 等基因编码的脱氢酶作用下重排为二醇[59];3)在nahC 或phdE 等基因编码的环裂解双加氧酶作用下发生邻位或间位裂解[60];4)在nahD 或phdG 等基因编码的水合-醛缩酶以及双加氧酶和脱氢酶等酶的作用下逐步氧化为水杨酸或邻苯二甲酸;5)进入三羧酸循环(TCA 循环),实现完全降解[11,61-62]。苯并[a]芘的降解途径较为复杂,其完全降解的机制尚不明确。水杨酸羟化酶、2-羧基苯甲醛脱氢酶、儿茶酚1,2-双加氧酶和儿茶酚2,3-双加氧酶参与了苯并[a]芘的降解过程[63]。而4,5-羟基-二羧酸、苯并[a]芘3,6-醌、邻苯二甲酸二乙酯和2-乙酰-3-甲氧基苯甲酸是苯并[a]芘降解过程中可能形成的中间产物[40,49,53]。

图2 萘、菲、芘和苯并[a]芘的生物降解途径[11,45,58,61-62,64-67]Fig.2 Biodegradation pathways of naphthalene,phenanthrene,pyrene,and benzo [a] pyrene
真菌一般不能将PAHs 作为唯一的碳源,而是通过共代谢的方式对PAHs 进行降解。白腐真菌对PAHs 的降解性能与其特有的酶系统有关。白腐真菌能够产生木质素过氧化物酶(LiP)、锰过氧化物酶(MnP)和漆酶(Lac)等木质素酶催化羟化、环氧化、脱烷基、亚砜化、脱氨、脱硫和脱卤等反应,从而降解PAHs[68]。木质素酶通过提供一个电子产生羟基自由基,氧化PAHs 形成醌和酸[2]。例如,白腐真菌Pleurotus ostreatus通过分泌氧化酶和漆酶,将菲和蒽转化为醌类物质,并进一步转化为可进入基础代谢途径的中间产物邻苯二甲酸,最后实现完全降解[69]。此外,木质素酶还具有广泛的底物特异性[2,70],且属于胞外酶,可直接作用于土壤中的PAHs。
然而,PAHs 降解机制的研究主要集中在降解基因和降解酶的识别,缺少在表达水平的分析。因此,PAHs 的降解机制可通过分子生物学手段进行研究,如Imam 等[11]利用转录组学研究了PAHs 真菌降解过程中降解酶的表达量变化,结果表明,单加氧酶FAD、细胞色素P450、环氧化物水解酶、乙醇脱氢酶、乙醛脱氢酶和双加氧酶的表达上调,说明这些酶可能参与了PAHs的降解。因此,利用基因组学、转录组学、蛋白组学和代谢组学联用技术探索复杂条件下PAHs 的生物降解机制和途径,是未来研究的热点,也将为PAHs 降解菌的实际应用提供更多的理论指导。
1.3 PAHs-重金属复合污染的PAHs 降解菌及其降解机制
PAHs 和重金属常常存在于环境中形成复合污染,某些降解菌被发现在重金属和PAHs 复合污染条件下具有高度适应性和较好的降解性能。例如,Czarny 等[20]发现,Acinetobactersp.在40 mg/L Cu、40 mg/L Zn 和20 mg/L Pb 存在条件下,4 d 后对30 mg/L 的荧蒽、菲、芴、芘和苊的降解率分别为25%、38%、45%、45%和67%;Rabani 等[71]发现,Bacillus licheniformis和Bacillus sonorensis在1% Cd、Zn、Cu、Cr 存在条件下,7 d 对100 mg/L 萘的降解率分别为73%和52%;Staninska-Pięta 等[72]研究发现,Burkholdarials 目的微生物在重金属浓度分别为50 和150 mg/L 时,PAHs 的生物降解率相对于不含重金属的对照组分别增加17.9%和16.9%;Huang等[73]发现,Pseudoarthrobacterphenanthrenivoran在30 mg/L K2Cr2O7条件下,17 d 内完全降解100 mg/L菲。重金属耐受PAHs 降解菌在PAHs-重金属复合污染情况下具有潜在的应用价值。
复合污染条件下PAHs 降解是一个复杂的过程,重金属可能起到不同的作用。一定浓度的重金属可能会促进PAHs 的降解[74-75]。首先,重金属可能会诱导细菌产生氧化应激,产生大量的活性氧物质(ROS)。例如,Cu(Ⅰ)和Cu(Ⅱ)可以通过Fenton 反应催化ROS,增加•OH 的产生,并可能引发链式反应氧化PAHs;其次,重金属可能作为电子的供体或受体参与PAHs 的降解过程;最后,重金属可能和PAHs 降解酶形成复合体,参与到PAHs 的降解。然而,高浓度的重金属可能会对PAHs 降解菌产生毒性或抑制PAHs 降解酶的活性,导致微生物生长缓慢和活性下降。因此,应进一步研究重金属与PAHs 的相互作用及相应的降解机制,从而增加重金属耐受PAHs降解菌在环境修复和生物降解方面的应用潜力。
1.4 微生物群落中不同功能的菌属降解PAHs 的机制及其相互作用
实际PAHs 污染土壤微生物群落往往存在多种PAHs 降解菌共存的情况[76]。微生物群落中的不同功能菌属参与PAHs 的降解,往往形成复杂的降解网络和相互作用。这些菌属通常具有不同的代谢途径和降解能力,相互之间通过协同作用或竞争作用,共同参与PAHs 的降解过程。一方面,它们可能利用PAHs 降解各阶段产生的中间产物,协同促进PAHs 的降解;另一方面,它们会竞争同一类PAHs底物,导致PAHs 的降解受到限制。此外,不同菌属还能通过共代谢作用来降解PAHs。某些细菌在利用自身底物过程中的酶和代谢产物可能参与PAHs的降解过程。
然而,对于微生物群落中不同功能的菌属降解PAHs 的机制及其相互作用研究仍然较为缺乏。Gran-Scheuch 等[77]利用高通量16S rRNA 扩增子测序研究了添加有高浓度PAHs 的柴油对富含镉和铅污染土壤中微生物群落结构的影响。结果表明,Sphingobium和Pseudomonas等菌属在添加了PAHs的土壤中的丰度显著增加,说明这些菌属中的细菌是PAHs 降解菌,添加了含高浓度PAHs 的柴油促进了土壤中耐镉微生物和PAHs 降解菌的富集。Ye等[78]发现在土壤中添加萘和2-甲基萘会促进Alicyclephilus和Thauera菌属的富集,而添加菲和蒽会促进Arcobacter、Acinetobacter和Thiobacillus菌属的富集,说明添加不同的PAHs 可能会筛选富集对应的PAHs 降解菌。此外,外源添加的PAHs 降解菌可能和土著PAHs 降解菌发生相互作用。Piubeli等[79]研究了添加Proteobacteria菌属后土壤微生物群落结构的变化。结果发现,添加组和未添加组土壤PAHs 的降解率差别不大,但土壤微生物群落呈现了显著差异。在未添加组,Sphingobium菌属的丰度占比显著提高;而在添加组,Flavobacterium菌属的丰度占比从1.6%上升至8.0%,说明外源添加PAHs降解菌可能促进土壤中PAHs 降解菌的生长。因此,了解降解菌的相互作用将有助于优化细菌降解PAHs 的策略,并开发高效的生物修复技术。
2 PAHs 降解菌的应用
PAHs 降解菌筛选和降解机制研究为其应用提供了理论依据。然而,PAHs 降解菌对PAHs 的降解率受到PAHs 结构、微生物种类和培养条件等因素的影响。目前,对于PAHs 降解菌的研究大部分局限于实验室规模,而缺少中试或场地规模试验的验证。此外,在实际应用中,PAHs 降解菌的性能往往会受到包括PAHs 污染程度、环境条件、降解工艺和降解时间等多种因素的制约[11,80]。例如,在实际PAHs 污染场地中,PAHs 浓度较高或者老化时间太久会导致其生物可利用性差,降解率低于实验室条件,从而限制了降解菌的应用价值。实际应用中,需要根据具体情况制定合理的方案,以提高PAHs 的降解率,实现污染场地的高效修复。本节对PAHs 降解菌在实际应用中的一般环境条件进行了归纳,分析生物刺激和生物强化的应用实例,并对应用过程中可能存在的问题及应对措施进行了探讨。
2.1 一般环境条件
在实际应用中,影响PAHs 降解菌性能的环境条件主要包括pH、温度、氧气浓度、湿度、土壤有机质含量以及土壤类型[81]。
首先,土壤的pH 是影响降解菌生长和活性的重要因素。一般而言,接近中性的土壤pH(约为6~7)有利于大多数降解菌的生长,从而促进PAHs 的降解[1]。不同PAHs 降解菌对酸碱度的适应能力有差异。PAHs 降解菌对酸碱度的适应范围较窄,只有在中性或微碱性的条件下才能正常繁殖[82]。如果土壤的pH 偏酸或偏碱,可能导致PAHs 降解菌生长的抑制和PAHs 降解酶的失活。其次,适宜的温度有助于降解菌的生长和活性。在25~35 ℃的温度范围内,适当提高温度可以增加降解菌对PAHs 的降解率[83]。因为适当提高温度不但会增加降解菌的生长速率,还会提高PAHs 酶的活性。此外,温度的提高还有利于PAHs 从固相到液相的解吸,从而提高PAHs 的生物可利用性[84]。然而,当温度超过60 ℃,会导致PAHs 降解菌生长的抑制和PAHs 降解酶的失活[85]。再次,PAHs 的好氧降解会受到氧气浓度的制约。氧不但可以作为最终的电子受体,还可以作为羟基化和氧化环裂解芳香环的共底物。因此充足的氧气有利于PAHs 的降解[85],也是污染场地修复中常用的手段[2]。通过曝气的方法将空气(或氧气)直接注入到降解体系中,可增加PAHs 降解菌的活性[86]。除了曝气外,还可以通过注入一些增氧剂,如过氧化氢、臭氧微气泡和固态释氧化合物等,提高体系中的溶氧含量[87]。最后,土壤有机质可作为降解菌的营养来源。较高的有机质含量通常有利于降解菌的生长,从而促进PAHs 的降解。特别地,当降解菌以共代谢方式降解PAHs,合适的共代谢基质对修复效果的提高尤为重要[88]。某些共代谢底物能够用来维持PAHs 降解菌的生长,且不容易被其他非PAHs 降解菌所利用[89]。当土壤中有机质含量较低时,可以通过投加外源营养物质的方式提高PAHs 的降解率,缩短降解周期[19]。常见的营养物质有葡萄糖、乙酸钠和丙三醇等[90]。
除上述环境因子外,土壤类型和湿度也会影响降解菌的生长和PAHs 降解率[91-92]。实际应用中要综合考虑一般环境条件的影响,针对具体的污染场地,进行相应的调控和改善,以优化降解环境,提高降解菌活性,从而实现PAHs 污染场地的高效修复。
2.2 生物刺激应用实例
生物刺激是指通过给予适当的营养物质或调控环境条件来增强现有降解菌(群)对目标污染物的降解能力[93]。一方面,可以通过调节温度、pH 等环境因子,优化PAHs 降解菌的环境条件;另一方面,通过提供合适的营养物质(如氮、磷、碳源等)和氧气促进PAHs 降解菌的生长和活性,从而增强PAHs 降解率。例如,Ugochukwu 等[94]通过添加外源有机肥料促进石油烃中PAHs 的降解,在对照组中,PAHs降解率仅为3%~30%;而在投加了10%~20%(质量比)的外源有机肥料后,PAHs 的降解率提高到了39%~90%。Haleyur 等[95]研究了澳大利亚废弃煤气厂的土壤中PAHs 的降解,结果表明,对于老化、风化和长期污染的土壤,生物刺激是最佳的PAHs 污染场地修复策略。
表面活性剂可以促进PAHs 的溶解,增加PAHs的生物可利用性,从而促进PAHs 的降解。决定表面活性剂性能的是其化学性质和临界胶束浓度[96]。高于临界胶束浓度的表面活性剂会促进PAHs 从固体基质向水相中分散。阳离子表面活性剂容易与土壤中带负电荷的黏土矿物和有机质等部分发生吸附,从而降低表面活性剂的有效浓度,影响其在土壤中的作用效果[97]。离子表面活性剂通常会对降解菌产生毒性,抑制降解菌的生长和活性[98]。相比而言,非离子表面活性剂在土壤中不易发生电荷相互作用,而生物表面活性剂对降解菌的毒性较低。因此,非离子表面活性剂和生物表面活性剂通常被优先考虑用于PAHs 污染土壤的治理和修复[99-101]。例如,Dave 等[102]研究了非离子表面活性剂Triton X-100 和生物表面活性剂β-环糊精对海洋细菌Achromobacter xylosoxidans降解PAHs 的影响,结果表明,添加Triton X-100 和β-环糊精使PAHs 的降解率分别提高了2.8~7.6 倍和1.4~2.2 倍。Rathankumar等[103]研究发现,添加1 500 mg/L 的生物表面活性剂时,木材辅助真菌和自由真菌在21 d 对PAHs 的降解率分别从61%和54%提高到100%和86%。但是,有研究表明添加过高浓度的表面活性剂会对PAHs 降解菌的生长和活性产生抑制[104-106]。因此,在选择表面活性剂和添加浓度时,需要综合考虑表面活性剂对PAHs 生物可利用性的提高和对降解菌可能的不利影响。
一般地,生物刺激的作用时间短,可以在较短的时间内迅速调节PAHs 降解菌的生理或行为反应,使其更快地适应环境,并提高降解性能。然而,在复杂条件下,生物刺激的效果可能无法持久,需要高强度或反复的刺激,才能维持降解菌的降解性能。因此,还需要用其他的技术手段提高PAHs 的降解率。
2.3 生物强化应用实例
生物强化是指向污染土壤或水体中添加特定的降解菌株或菌群,以增加对目标污染物的降解能力[93]。通过引入PAHs 高效降解菌株或菌群,可以直接增加体系中降解菌的种类和数量,弥补原有降解菌的不足。生物强化适用于在污染场地缺乏PAHs 降解菌的情况。如Bao 等[1]探讨了在生物泥浆反应器中添加外源细菌BCP-3 对PAHs 的降解效果影响,结果显示,优化曝气速率、混合水土质量比、搅拌速率、温度和Tween-80 浓度等条件,PAHs 的降解效果无明显变化,而添加外源降解菌BCP-3 后,PAHs 的降解率显著提高。Zhang 等[107]通过构建3 株大肠杆菌工程菌株用于苯并[a]蒽的降解,工程菌株对10~500 mg/L 的苯并[a]蒽均有良好降解能力;酶活性和代谢产物分析证实,3 种工程菌在降解过程中协同作用,通过分批次接种,在21 d 对苯并[a]蒽的降解率达到90.7%,生物强化效果明显。
与生物刺激相比,PAHs 降解菌成功定殖,降解效果具有较好的持久性,可适应长期的PAHs 污染环境。例如,Zeneli 等[108]比较了自然衰减、生物刺激和生物强化对炼油厂固体废物中石油污染物中PAHs 去除的影响,结果表明,生物强化条件下,PAHs 的去除率为87%,显著高于自然衰减(37%)和生物刺激(42%)。Rathankumar 等[88]研究了提高土壤有机质含量和添加真菌Pleurotus dryinusIBB 903对PAHs 降解效果的影响,结果表明,提高土壤有机质含量提高了土壤中漆酶、芳香醇氧化酶、过氧化锰酶和过氧化木质素酶的活性,添加真菌Pleurotus dryinusIBB 903 处理组中菲和苯并[a]蒽降解率显著高于未强化组。
3 降解菌应用存在的问题和可能的应对措施
3.1 PAHs 降解菌活性
在实际应用过程中,往往存在着刚开始PAHs 的降解效果好,但伴随着降解的进行,PAHs 的降解率逐步下降的问题。在PAHs 降解的过程中,环境条件可能发生恶化。首先,PAHs 降解过程会逐步消耗氧气和营养物质,此外,其他细菌还可能与PAHs 降解菌竞争资源和生存空间[108]。当氧气供应不足或发生营养物质限制时,PAHs 降解菌会失活[1,81,85]。其次,PAHs 在降解过程中产生中间产物,可能造成毒性积累,当这些毒性物质积累到一定程度时,可能会对PAHs 降解菌的活性产生抑制[80]。最后,在环境不利的条件下,降解菌可能进入休眠状态,需要添加特定的激活因子才能恢复其活性。如果缺乏这些激活因子,PAHs 的降解会受到限制[109]。
为了改变PAHs 降解率逐步下降的情况,在实际应用中,应该对降解菌的活性和降解率进行持续监测,并根据监测结果进行调整和优化。可通过采用周期性处理的方法,维持PAHs 降解菌的活性。主要的措施包括:定期调节温度和pH,为降解菌提供适宜的生存环境;定期补充氧气和营养物质,维持PAHs 降解菌的生长和代谢或激活休眠的降解菌等。
3.2 生物降解与其他技术的耦合联用
利用新型功能材料与生物降解耦合方法可提高PAHs 降解菌的性能。载体材料能够改善土壤的理化性质,为降解菌提供更适宜的生长环境,从而增加降解菌的数量。载体材料还可以促进土壤中水分和空气的交换,增加降解菌的活性。此外,载体材料还能吸附和富集PAHs,增加降解菌与PAHs 接触的机会,从而提高PAHs 的降解率[110]。生物炭材料和纳米材料具有孔隙丰富、比表面积大、生物相容性好等特点,常被作为降解菌的载体。例如,Ren 等[111]使用氧化石墨烯固定化的细菌微球,这些微球具有较高的机械强度、较大的比表面积和介孔体积,增加了土壤中PAHs 降解菌的数量,从而显著提高了PAHs 的降解率。Qiao 等[112]将PAHs 降解菌群固定在磁性悬浮生物炭上,显著提高了芘、苯并[a]芘和茚并[1,2,3-c,d]芘的降解率。Liang 等[113]使用富铁污泥生物炭作为菲降解菌的载体,生物炭负载的降解菌在24 h 对菲的去除率为58.2%,显著高于降解菌单独作用时的去除率(38.7%)。Firoozbakht等[114]研究发现,添加1.0 g/L 氧化铁纳米颗粒,72 h对菲的降解率从37.1%显著提高到77.2%。然而,向体系中添加外源材料还需要考虑其本身可能造成的生态和健康风险[115]。因此,在实际应用中,需要优先考虑环境友好的载体材料,并结合具体情况,对载体的粒径和添加浓度进行优化。
化学氧化能够快速降解土壤中的有机污染物,降低其生物毒性。有研究将化学氧化与生物降解耦合联用,对PAHs 污染的土壤进行协同修复,以期缩短修复周期。例如,Liao 等[116]研究发现,将Fenton、改性Fenton、活化过硫酸钾和高锰酸钾等氧化体系与土著菌的生物降解相结合可明显促进PAHs 的降解效果。以Fenton 体系为例,萘和苊烯的降解率提高了约45%,而苊、芴和菲的降解率提高了约30%。Mora 等[117]针对140 mg/kg 的菲污染土壤,采用活化过硫酸盐氧化耦合生物降解体系,在28 d 内达到了60%~80%的降解效果。然而,化学氧化可能会破坏土壤结构,改变土壤有机质含量和土壤pH,化学氧化后的中间产物也可能会对降解菌造成更强的毒害作用[118-120]。因此,需要进一步研究化学氧化和生物降解耦合联用的条件。一方面,选择合适的化学氧化剂类型、浓度及注入方式,尽量避免氧化药剂对降解菌的不利影响;另一方面,研究化学氧化剂对土壤基质中营养成分的影响,通过补充营养物质,满足降解菌再生的需求。在场地修复工程中,由于土壤状况、气候变化和地下水条件等更为复杂,因此需要对化学氧化顺序和降解菌处理过程进行充分的优化,以适应现场应用的需求。
植物和根际降解菌之间的协同效应能促进土壤中难降解有机物的去除[121]。一方面,土壤中PAHs的生物降解主要受限于其低溶解度和高疏水性,由植物根系分泌的胞外聚合物或根际菌产生的生物表面活性剂可提高PAHs 的生物利用性,并降低其对植物的毒性[122];另一方面,植物可为根际降解菌提供营养物质,而根际降解菌可促进根系对PAHs 的吸附和吸收。Gao 等[123]研究发现,紫花苜蓿(Medicago sativaL.)在70 d 内去除了98.1%的菲和88.1%的芘,而根际降解菌促进了PAHs 的降解。某些根际菌,如假单胞菌(Pseudomonassp.)、芽孢杆菌(Bacillussp.)和不动杆菌(Acinetobactersp.)不但能直接利用烃类物质,还具有植物促生性状(如磷酸盐增溶、分泌植物激素和铁载体等),促进植物生长[124]。某些根际促生菌能够很好地适应恶劣的土壤条件,促进植物对污染土壤的修复效果[125]。然而,对于促生根际菌的筛选和表征主要局限于培养皿中或盆栽试验,缺少通过场地试验验证促生根际菌协同植物修复实际PAHs 污染土壤的效果。因此,需要进一步研究降解菌和植物的相互作用机制,以及环境因子在复合效应中所起的作用,为降解菌-植物联用去除PAHs 提供基础。
3.3 环境风险和降解成本
虽然生物修复是一种环境友好的绿色修复技术,但是PAHs 降解菌的应用也可能存在环境风险。添加外源菌(工程菌、高效降解菌等)或者是添加外源物质(材料、表面活性剂等)来提高土著微生物降解PAHs 的方式,可能会对土壤的微生物群落结构、土壤的理化性质造成不利影响,亟需对微生物修复过程中可能产生的生态风险进行评估。例如,PAHs 降解菌如果未充分评估就引入自然环境,可能对土著菌的生长产生影响。PAHs 降解菌还可能通过接触其他生物体、空气或水等途径传播到其他环境中,因其致癌性和致突变性而对人类健康构成风险[94,126]。此外,在PAHs 降解菌应用过程中化学药品的使用,可能会造成土壤板结、土著菌活性下降等问题。针对上述问题,需要对PAHs 降解菌应用的环境风险进行充分评估,并采取适当的预防措施。目前,大部分研究仍然以PAHs 浓度的降低作为评价终点,而缺少对生态系统功能恢复的综合评估。
此外,针对PAHs 降解菌的应用研究往往只关注降解率,却忽略了成本问题。PAHs 生物降解技术的应用成本主要包括菌株筛选、培养、应用、设备采购和运维等多个方面。除了PAHs 降解菌自身的稳定性和降解效果等因素,成本也是决定PAHs 降解菌能否实际投入工业应用和产业化生产的关键因素[94]。有研究表明,不同生物修复技术的成本存在较大差异。如施用浆料或生物膜处理PAHs 污染土壤的成本分别为170 美元/t 和130~260 美元/m3。相对而言,堆肥的成本效益更高,其成本在50~140 美元/t[127]。针对成本问题,需要对PAHs 降解菌应用的可行性和经济效益进行评估,以选择最佳的解决方案,同时还需对降解工艺进行优化,以降低成本。
4 结语与展望
PAHs 在全球环境中的广泛分布和累积及其生态和健康风险,引起了人们对其污染防控和治理的重点关注。生物降解作为一类环境友好的技术,具有修复PAHs 污染的潜力。PAHs 的生物可利用性差,微生物活性受到各种环境因素制约,导致PAHs 的生物降解率较低、降解周期长。目前为止,仍缺少能够在实际污染场地中高效去除PAHs 的最佳方案。本文归纳了PAHs 降解菌及其降解机制,并对降解菌在实际污染场地中的应用进行了系统综述。主要结论如下:1)PAHs 降解菌主要包括不动杆菌属(Acinetobacter)、分枝杆菌属(Mycobacterium)和假单胞菌属(Pseudomonas)等,真菌主要为白腐真菌;与单一菌株相比,降解菌群具有更好的PAHs 降解性能。2)萘、菲和芘等PAHs的完全降解途径明确,而苯并[a]芘的完全降解机理仍不清楚。3)PAHs降解菌的应用受到环境因子的影响,生物刺激和生物强化是提高PAHs 降解率的常见手段。4)PAHs降解菌在实际应用中,存在降解菌活性低、缺少与其他技术的耦合联用、环境风险和降解成本高等问题。
未来PAHs 降解菌的研究可以从以下几个方面开展:1)探究降解菌的生理学特性,研究降解菌与环境微生物群落的相互作用和生态效应,探索它们在自然环境中的适应机制;2)开发和应用新型技术,例如,通过研发新型表面活性剂或载体材料等方法以提高降解菌的效率和稳定性。此外,应进一步加强降解菌技术的应用和推广,促进技术的产业化发展。通过技术创新,开发新型降解菌剂,提高PAHs的降解率并降低治理成本,通过开展技术示范,推广降解菌技术。将研究成果转化为实际应用,以实现对PAHs 污染的高效、经济、可持续治理。

