焦化污染场地土壤多环芳烃的生物强化协同降解工艺研究
赵立坤,包仕钰,郭涛,程熠晴,郑焰,余晓龙,刘渊文,杨乐巍,刘鹏,毛旭辉*
1.武汉大学资源与环境科学学院
2.天津壹鸣环境污染治理有限公司
3.南方科技大学环境科学与工程学院
4.北京建工环境修复股份有限公司
多环芳烃(PAHs)是一类具有2 个或2 个以上苯环的有机化合物,因其具有致癌、致畸和致突变的特性,其中16 种被美国国家环境保护局(US EPA)列为优先污染物[1]。根据苯环数量的差异可将PAHs分为低分子量PAHs(LMW-PAHs)和高分子量PAHs(HMW-PAHs)。LMW-PAHs 由2~3 个苯环组成,可引起急性中毒[2];HMW-PAHs 由4~7 个苯环组成,毒性较小但具有致癌、致突变或致畸性[3-4]。PAHs可对人体造成多种危害,如对呼吸系统、循环系统、神经系统、肝脏、肾脏等造成损害,被认定为影响人类健康的主要有机污染物[5-9]。环境中的PAHs 可以通过多种途径进入人体,进而危害人类健康,因此对PAHs 污染的治理和修复受到普遍关注。
土壤环境中PAHs 污染来源广泛,其中焦化厂内含PAHs 的石油类化合物的遗撒或渗泄漏是重要来源之一[10-11]。针对焦化厂PAHs 污染,可以采用生物修复、光催化氧化、化学氧化、电动和热技术及土壤淋洗等修复技术[9,12]。微生物修复技术是生物修复技术中的一种,利用微生物代谢降解PAHs,具有修复成本低、无二次污染等特点,被认为是最具有前景的修复技术之一[3,7,13]。化学氧化技术通过投加氧化剂氧化降解PAHs,具有时效快、降解充分等特点,且对HMW-PAHs 有较好的去除效果[14-15]。由于实际土壤颗粒往往与PAHs 结合紧密,且PAHs 具有较高的疏水性,导致在实际修复过程中PAHs 难以被微生物和化学药剂捕捉并利用[5]。土壤淋洗技术则通过投加表面活性剂将PAHs 从土壤颗粒中洗脱出来,在改善PAHs 的生物可利用性和化学氧化效率的同时,表面活性剂也可作为微生物的营养碳源或土壤改进剂,进而增加微生物活性[16-17]。
目前,针对PAHs 污染土壤的生物修复技术、化学氧化技术和土壤淋洗技术已有较多研究,然而大多数的研究主要是针对单一修复技术的探讨,较少考虑技术的联用和组合;同时,以往研究使用的土壤样本大多是实验室配制的模拟土壤,与实际PAHs 污染土壤存在较大差异[5,18-19]。而针对实际焦化场地PAHs 污染土壤,采用多种修复技术相耦合的协同修复降解却鲜有报道。因此,笔者以某废弃焦化厂的PAHs 污染土壤为研究对象,针对PAHs 的特性,通过耦合土壤淋洗、生物降解、化学氧化等修复技术设计了4 种降解工艺,并试验验证了工艺的可行性,以期为焦化污染土壤PAHs 降解修复工程提供工艺技术支撑。
1 材料和方法
1.1 试剂与材料
试验过程中所使用的KH2PO4、K2HPO3·3H2O、NH4Cl、NaCl、MgSO4、MnSO4·H2O、FeSO4·7H2O、CaCl2、HCl、NaOH、正己烷、二氯甲烷、乙腈等药品均购自国药集团化学试剂有限公司,LB 培养液购自青岛海博生物技术有限公司,无特别指出外均为分析纯。试验全程使用超纯水(电阻率≥18.2 MΩ·cm,25 ℃)。
1.2 土壤样品的采集与保存
土壤样品采集于某废弃焦化厂,选取多个采样点进行样品采集,采样深度为0~15 cm,采集的土壤样品用无菌袋密封好,放在含有冰袋的样品保存箱中,迅速送回实验室于4 ℃冰箱保存。
1.3 土壤样品的理化性质
采集的土壤样品于阴凉处自然风干后,除去树枝等杂质,研磨混匀过10 目(1.7 mm)筛网后,测试其理化性质。土壤pH 采用HJ 962—2018《土壤pH 值的测定 电位法》测定;有机质浓度采用HJ 761—2015《固体废物有机质的测定 灼烧减量法》测定;全氮浓度采用NY/T 53—1987《土壤全氮测定法(半微量开氏法)》测定;总磷浓度采用HJ 632—2011《土壤 总磷的测定 碱熔-钼锑抗分光光度法》测定;含水率采用HJ 613—2011《土壤 干物质和水分的测定 重量法》测定。
1.4 PAHs 的测试分析方法
针对降解过程土壤相中残留的PAHs 和淋洗过程淋洗液中的PAHs 采用不同的提取方法。土壤相中PAHs 的提取方法(基于HJ 784—2016《土壤和沉积物 多环芳烃的测定 高效液相色谱法》进行了优化):准备5 mL 泥浆样品,平铺于通风橱内直至风干,研磨后取2 g 土壤样品,加入10 mL 正己烷溶液,涡旋15 min,超声萃取30 min,于5 000 r/min 离心10 min,收集上层提取液;收集后再加入10 mL 正己烷溶液重复提取1 次,将2 次提取液汇总。淋洗液中PAHs 的提取方法(基于HJ 478—2009《水质 多环芳烃的测定 液液萃取和固相萃取高效液相色谱法》进行了优化):准备2 mL 淋洗液,5 000 r/min 离心10 min;取1 mL 离心后的上层淋洗液,加入3 mL 正己烷溶液,涡旋15 min,剧烈振荡5 min,待其充分混匀后,12 000 r/min 离心10 min,收集上层提取液。提取过后的前处理及测试条件:1)在含有PAHs 的提取液中加入适当的无水硫酸钠和铜粉(除水除硫),涡旋5 min,氮吹浓缩至0.5 mL 后,用正己烷定容到1 mL;2)过硅酸镁净化柱(除杂质),并用10 mL 的洗脱液(二氯甲烷:正己烷=1∶1,体积比)洗脱,收集洗脱液,氮吹浓缩至0.5 mL 后,用正己烷或乙腈定容到1 mL;3)通过HPLC(Essentia LC-16,SHIMADZU,日本)测试。HPLC 测试参数为C18 液相色谱柱,柱温35 ℃,流 速1.0 mL/min,流动相为甲醇∶水=9∶1(体积比),进样量为20 µL,检测波长为254 nm。
PAHs 分析方法:先通过PAHs 标准品分别确定萘、菲、蒽、荧蒽、芘、苯并[a]蒽、苯并[b]荧蒽、苯并[a]芘以及茚并芘共9 种PAHs 的标准曲线及对应出峰时间;再根据测试样品中对应PAHs 的峰面积及标准曲线计算其相应浓度。以萘、菲和蒽的平均降解效果代表LMW-PAHs 的降解效果,以荧蒽、芘、苯并[a]蒽、苯并[b]荧蒽、苯并[a]芘和茚并芘的平均降解效果代表HMW-PAHs 的降解效果,以9种PAHs 的平均降解效果代表总PAHs 的降解效果。
1.5 土壤降解工艺路线及试验方案
针对实际焦化土壤PAHs 的污染特性,探究了4 种降解工艺的降解效果,并分别设计了试验方案,具体见图1。值得注意的是,为了方便在实验室开展试验,工艺1、2 针对的是过筛后粒径≤1.7 mm 的实际污染土壤。但考虑到不同粒径实际污染土壤的质量占比和PAHs 浓度往往存在较大差异,因此为了更加准确全面地分析实际工程层面PAHs 污染土壤的降解效果,设计了工艺3、4,针对的是未筛分的实际污染土壤。
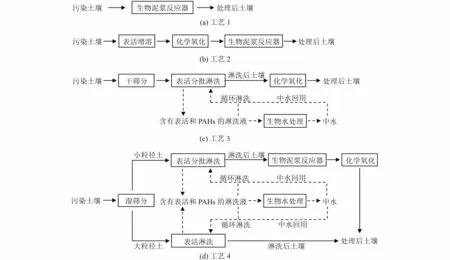
图1 4 种试验工艺路线设计Fig.1 Design of four experimental process routes
1.5.1 工艺1:生物泥浆降解工艺
土壤样品加入如图2 所示生物泥浆反应器中,在投加无机盐培养液(MSM)和外源降解菌株后,在一定的温度、搅拌和曝气等条件下避光反应,通过微生物作用降解土壤中的PAHs。生物泥浆反应器为圆柱形,亚克力(PMMA)材料,尺寸为φ10 cm×15 cm,有效容积为1 L。反应器由罐体、搅拌装置、加热装置、曝气装置和采样孔组成。1 L MSM 培养液的配方为1.7 g KH2PO4、5.6 g K2HPO3·3H2O、1.0 g NH4Cl、0.5 g NaCl、100 mg MgSO4、20 mg MnSO4·H2O、10 mg FeSO4·7H2O、15 mg CaCl2,pH维持在7.0~7.2[6,20]。外源降解菌株为从环境介质中筛选出来的一株气单胞菌(Aeromonassp.BCP-3),该气单胞菌对PAHs 的降解效果较好(实验室条件下,针对305 mg/L 的模拟PAHs 溶液,7 d 降解率可以达到90%),保存在中国典型培养物保藏中心,编号为CCTCC M2022117。试验条件:先将外源降解菌株BCP-3 在LB 培养液中扩培,待其OD600(在600 nm 处的吸光度)为1.0±0.1 且处于生长对数期时,按10%(体积分数)的比例投加到MSM 培养液中;之后将含有外源降解菌的MSM 培养液与实际土壤样品按2:1(质量比)混合均匀后置于生物泥浆反应器内,投加40 g/L 表面活性剂(Tween80),在30℃、200 r/min、曝气1.5 L/min 的条件下开始试验,并于试验的第0、1、2、4、7、14、21 天分别取样测试泥浆样品中PAHs 浓度。
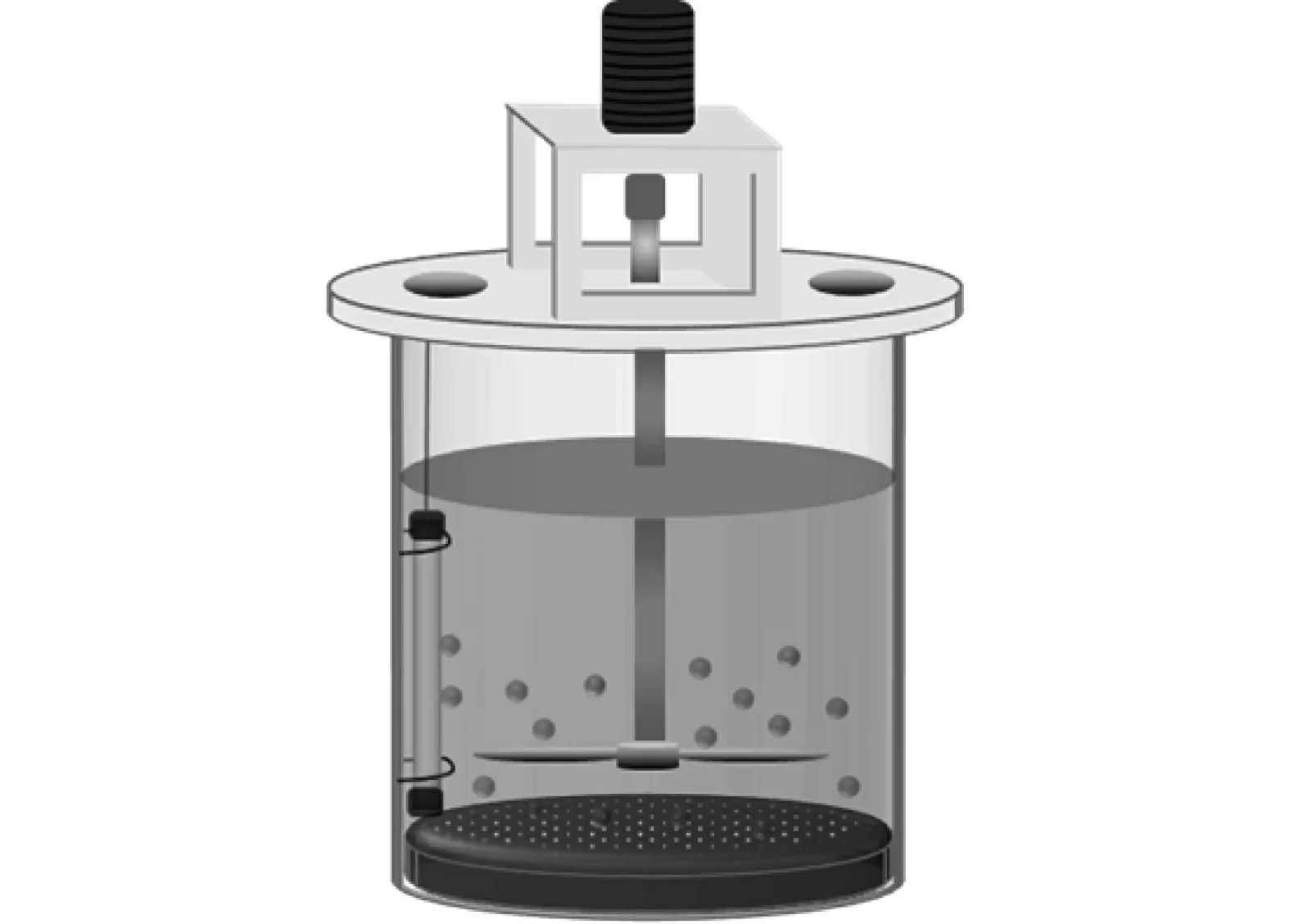
图2 生物泥浆反应器Fig.2 Soil-slurry bioreactors
1.5.2 工艺2:表活增溶+化学氧化+生物泥浆工艺
在实际污染土壤中投加相应浓度的Tween80,使得土壤中部分PAHs 溶出,之后依次投加化学药剂以及外源降解菌,通过化学氧化和生物降解实现对实际污染土壤中PAHs 的协同降解修复。表活增溶:为增加土壤中PAHs 的溶解性和生物可利用性,将10 g/L Tween80 溶液与实际土壤样品按1.5∶1(质量比)混合后置于生物泥浆反应器内,在35 ℃,200 r/min 的条件下避光增溶4 d,并在增溶开始后的第
1、2、3 天分别补充一定量的Tween80(每次补充10 g/L Tween80,最终Tween80 的投加量为40 g/L),测试增溶前后土壤中PAHs 浓度变化。化学氧化:增溶结束后在生物泥浆反应器内依次投加多聚磷酸盐(TPP)、硫酸亚铁(FeSO4)和双氧水(H2O2)的母液,使得混合后的溶液与实际土壤样品的质量比为1.8∶1,混合后溶液中TPP、Fe2+和H2O2的浓度分别为50、50 mmol/L 和1.5%[21-24];在常温、转速200 r/min 的条件下氧化2 d(目的是将体系中残留的H2O2消散,避免对后续生物降解的影响),氧化结束后测试土壤中PAHs 浓度。生物泥浆的反应条件与工艺1 相同,在投加MSM 培养液和菌液后确保混合后的溶液与实际土壤样品的质量比为2∶1,并于试验的第0、1、3、7、14、21 天分别取样测试土壤样品中PAHs 浓度。
1.5.3 工艺3:干筛分+表活增溶+化学氧化工艺
针对原始实际污染土壤,先进行干筛分,以1.7 mm 为界划分为小粒径土(≤1.7 mm)和大粒径土(>1.7 mm),再对不同粒径的土壤(淋洗液与土壤质量比为10∶1)分批淋洗,待土壤中大部分的PAHs 被淋洗出来后,土壤中残留的少部分PAHs 采用化学氧化降解,直至达标。针对淋洗过后含有表面活性剂和PAHs 的淋洗液,一方面可通过生物水处理的方式将其降解生成无害化的中水;另一方面因淋洗液中含有一定量的表面活性剂残留,其具有循环使用的价值,可与处理后的中水混合对实际污染土壤进行循环淋洗。干筛分:将自然风干后的实际污染土壤除去树枝等杂质,研磨混匀后依次使用1.7 和0.075 mm 的筛网筛分,并测试不同粒径土壤的质量占比和PAHs 浓度占比。表活分批淋洗:将淋洗溶液与污染土壤混合,总质量比为10∶1,分5 次进行分批淋洗增溶,单次质量比为2∶1,Tween80 浓度为40 g/L,淋洗前后分别测试土壤和淋洗液中的PAHs 浓度。化学氧化:对淋洗后土壤中剩余的PAHs 进行氧化处理,水土比为2∶1(质量比),氧化条件同1.5.2 节。循环淋洗:为探究使用后淋洗液的循环使用价值,将质量比为2∶1 的淋洗溶液与污染土壤于250 mL 烧杯中混合,在30 ℃、200 r/min 的条件下于摇床中开展循环淋洗试验,泥浆离心后的上层淋洗液重复使用继续淋洗新的污染土壤,共淋洗5 次,测试每次重复淋洗后淋洗液中PAHs 的增量。生物水处理:针对重复使用后的含有PAHs 的淋洗液采用投加外源降解菌Aeromonassp.BCP-3 的方式降解其中的PAHs,生物投加量为10%(体积比),在30 ℃,150 r/min、曝气0.5 L/min 的条件下开始试验,并于试验的第0、1、2、3、5、7 天分别取样测试淋洗液中的PAHs浓度。
1.5.4 工艺4:湿筛分+表活增溶+生物泥浆+化学氧化工艺
针对原始实际污染土壤,先进行湿筛分(也称造浆筛分,更有利于分离不同粒径的土壤),再对湿筛分后的大粒径土和小粒径土(淋洗液与土壤质量比为10∶1)分批淋洗,最后针对土壤中残留的少部分PAHs 依次投加外源降解菌以及化学药剂,通过生物降解和化学氧化协同降解实现对实际污染土壤中PAHs 的协同降解修复。针对淋洗过后的含有表面活性剂和PAHs 的淋洗液,处理方法同1.5.3 节。湿筛分:在泥浆搅拌器中进行,加入清水和污染土壤,保持水土比2∶1~3∶1(质量比),搅拌速率为200 r/min,分别于24、48、72 h 取样,并依次使用1.7、0.25 和0.075 mm 的筛网筛分。随后,样品经适当清水清洗和风干后,进行土壤质量占比和PAHs 浓度占比的测试。表活分批淋洗试验方案与1.5.3 节相同。生物泥浆试验方案与1.5.1 节相同,在投加MSM 培养液和菌液后确保混合后的溶液与实际土壤样品的质量比为2∶1,并于试验的第0、1、3、5、7、10、14 天分别取样测试土壤样品中PAHs 的残留浓度。化学氧化,针对生物降解后土壤中剩余的PAHs,进行氧化处理,水土比为2∶1(质量比),将氧化剂设置为200 mmol/L TPP、200 mmol/L Fe2+、6%H2O2。循环淋洗试验方案和生物水处理试验方案均与1.5.3 节相同。
1.6 质量控制
为减小试验误差,所有试验过程中所用到的LB 培养液、MSM 培养液、外源菌液等溶液均现配现用;所有样品保证在48 h 内检测,待测样品均保存在-20 ℃冰箱。试验过程设置了空白对照组和试验组,且每组3 个平行样以进行质量保证和质量控制。9 种PAHs 加标回收率为77%~112%,样品平行样相对标准偏差控制在10%以内。
2 结果与讨论
2.1 土壤样品理化性质及PAHs 浓度
土壤pH 为8.33,有机质浓度为39.1 g/kg,全氮浓度为0.55 g/kg,总磷浓度为0.578 g/kg,含水率为5.5%。土壤PAHs 浓度测试结果表明,针对工艺1、2 中筛分后的粒径≤1.7 mm 的土壤,9 种PAHs总浓度为(171.04±15.51)mg/kg,其中LMW-PAHs 的浓度为(17.05±4.79)mg/kg,HMW-PAHs 的浓度为(153.99±10.72)mg/kg;针对工艺3、4 中的未筛分的实际污染土壤,9 种PAHs 总浓度为(93.67±6.10)mg/kg,其中LMW-PAHs 的浓度为(13.44±2.71)mg/kg,HMW-PAHs 的浓度为(80.23±3.39)mg/kg。
2.2 4 种工艺对土壤中多环芳烃的降解效果
2.2.1 工艺1 降解效果
工艺1 设置了空白组(未加外源降解菌)和试验组(投加了外源降解菌Aeromonassp.BCP-3)。由图3 可知,工艺1 针对实际污染土壤中PAHs 的降解,空白组和试验组的降解趋势相似,均表现为0~7 d降解速率较快,7 d 后降解速率放缓,21 d 时降解率最高。试验组针对实际污染土壤中的LMW-PAHs、HMW-PAHs 以及总PAHs 的降解率分别为82.57%、51.67%和58.64%,相对于空白组的降解效果分别提升了31.21%、20.56%和23.60%。针对实际污染土壤,试验组和空白组均展现了一定的PAHs 降解能力,且在试验初期,空白组的降解效果优于试验组。这表明在实际污染土壤中,存在一定数量的PAHs 土著降解菌,这些土著菌能够更快地适应泥浆降解体系并表现出一定的降解能力[25]。相比之下,试验组所投加的外源降解菌BCP-3 需要一定时间来适应泥浆降解体系,导致试验初期降解效果不佳。随着时间的推移,外源降解菌BCP-3 成功定殖,其降解能力显著提升。
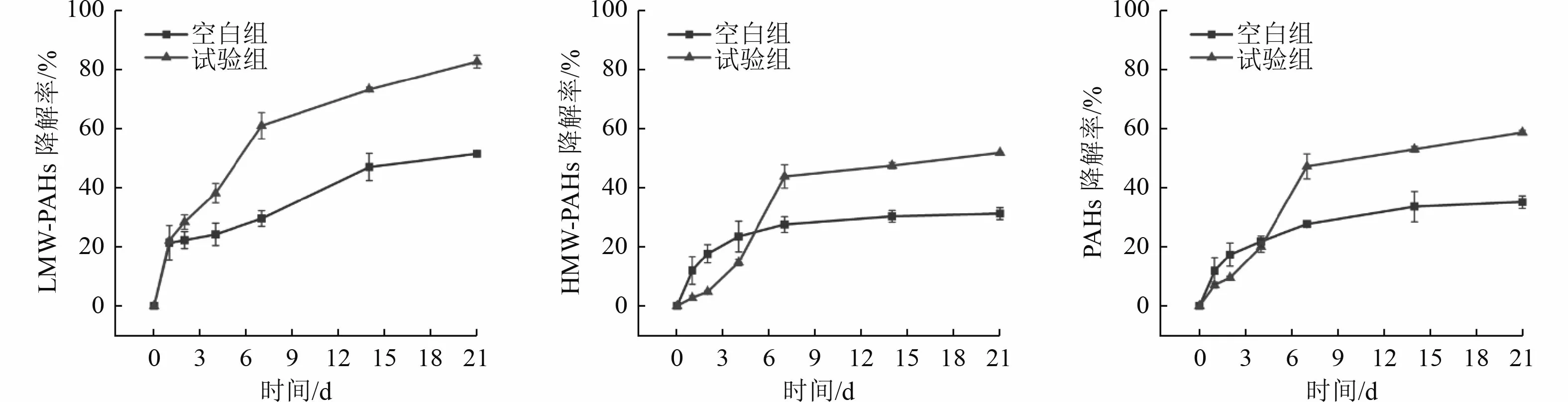
图3 工艺1 生物降解效果Fig.3 Biodegradation effects of Process 1
2.2.2 工艺2 降解效果
为了增加土壤中PAHs 的溶解性和生物可利用性,工艺2 首先进行了表活增溶处理,通过测试表活增溶前后土壤中PAHs 浓度的变化可知其增溶率为25.16%±3.21%;接着氧化反应2 d,化学氧化降解率为38.68%±1.35%;最后进行了生物降解,降解效果如图4(生物降解在化学氧化基础上进行,因此起始降解率为38.68%±1.35%)所示。试验组实际污染土壤中的LMW-PAHs、HMW-PAHs 以及总PAHs 的生物降解率分别为70.75%、61.88%和65.68%,相对于空白组的降解效果分别提升了12.63%、13.78%和13.29%。工艺2 相比于工艺1,生物降解的增量变小,一方面原因是化学氧化降解了容易降解的PAHs,另一方面可能是化学药剂对微生物的抑制作用[26]。
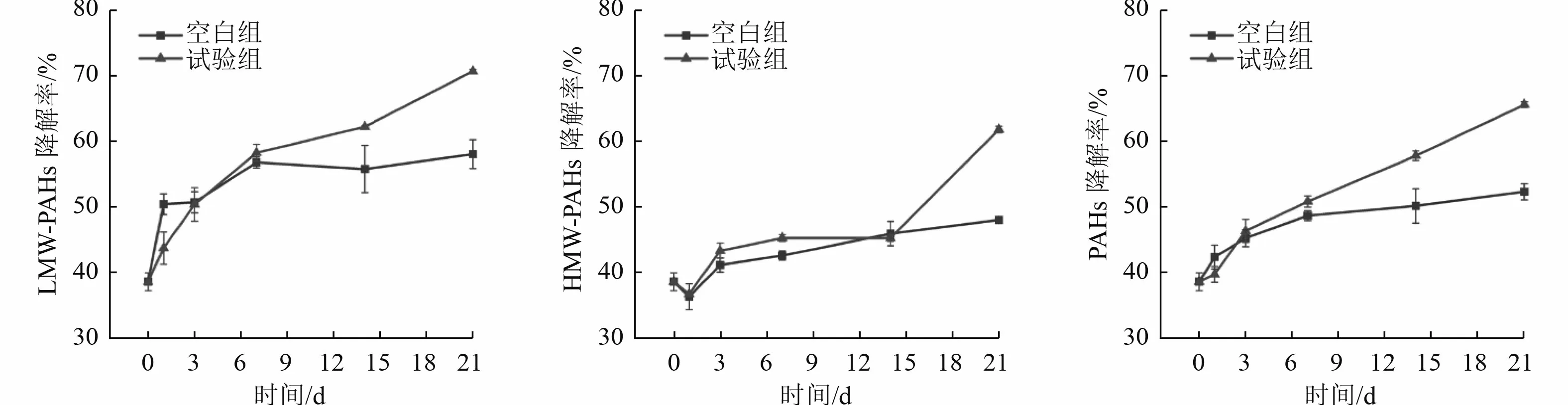
图4 工艺2 生物降解效果Fig.4 Biodegradation effects of Process 2
2.2.3 工艺3 降解效果
实际污染土壤干筛分后各粒径土壤质量占比及PAHs 浓度占比如表1 所示。以0.075 和1.7 mm 为划分标准将实际污染土壤划分为3 类,通过测试不同粒径土壤的PAHs 浓度可知,干筛分后粒径≤1.7 mm 的2 类土壤中PAHs 浓度相似,介于150.00~159.70 mg/kg,粒径>1.7 mm 的土壤PAHs 的浓度为52.15 mg/kg。对比土壤质量占比和PAHs 浓度占比可知,粒径≤1.7 mm 的2 类土壤质量占比总和仅为38.45%,但其PAHs 浓度占比总和却高达65.43%;粒径>1.7 mm 的土壤质量占比虽高达61.55%,但其PAHs 浓度占比却仅为34.57%。由此说明,在不同粒径的实际污染土壤中存在PAHs 分布不均匀的现象,一般土壤粒径越小,其比表面积越大,土壤孔隙越多,越容易富集PAHs[27-28]。
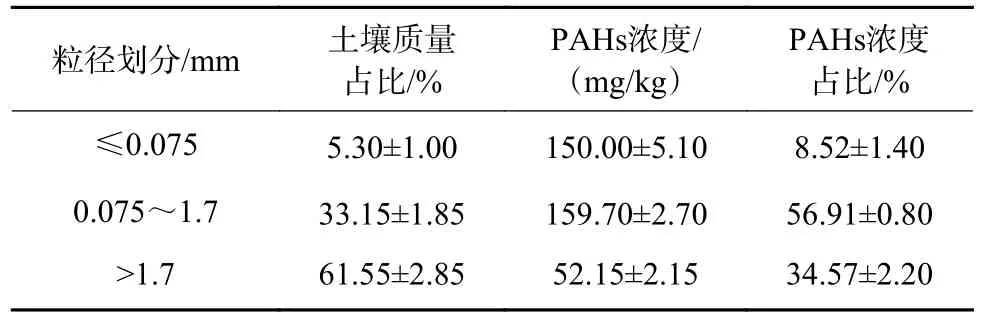
表1 干筛分后各粒径污染土壤质量占比以及PAHs 浓度占比Table 1 Mass proportion and PAHs content proportion of contaminated soil with different particle sizes after dry-sieving
根据干筛分后不同粒径土壤质量占比和PAHs 浓度占比分布特点,以1.7 mm 为界将干筛分后的土壤划分为小粒径土(≤1.7 mm)和大粒径土(>1.7 mm),进行分批淋洗处理。由图5(a)可知,不同粒径土壤的分批淋洗效果均为随着淋洗次数的增加,PAHs 的淋洗率不断增加。针对小粒径土,5 次淋洗后淋洗率可达到71.06%±3.70%,土壤中PAHs 残留浓度为(45.84±5.86)mg/kg;针对大粒径土,分批淋洗效果显著,5 次可达到88.32%±2.18%,土壤中PAHs 残留浓度为(6.09±1.14)mg/kg。在此基础上针对不同粒径土壤进行化学氧化,氧化后小粒径土PAHs 残留率为20.24%±0.10%,PAHs 总残留浓度为(32.06±0.16)mg/kg,苯并[a]芘残留浓度为0.5 mg/kg;氧化后大粒径土PAHs 残留率为4.03%±0.22%,PAHs 总残留浓度小于2.5 mg/kg,未检测到苯并[a]芘,可达到GB 36600—2018《土壤环境质量 建设用地土壤污染风险管控标准(试行)》一类建设用地标准。计算可知,工艺3 对实际污染土壤总PAHs 的降解率为85.36%(表2)。
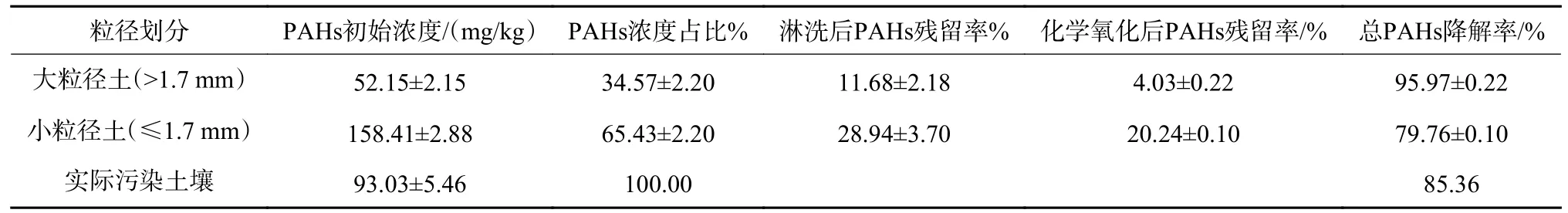
表2 工艺3 对污染土壤中PAHs 的降解效果Table 2 PAHs degradation effect of contaminated soil in Process 3
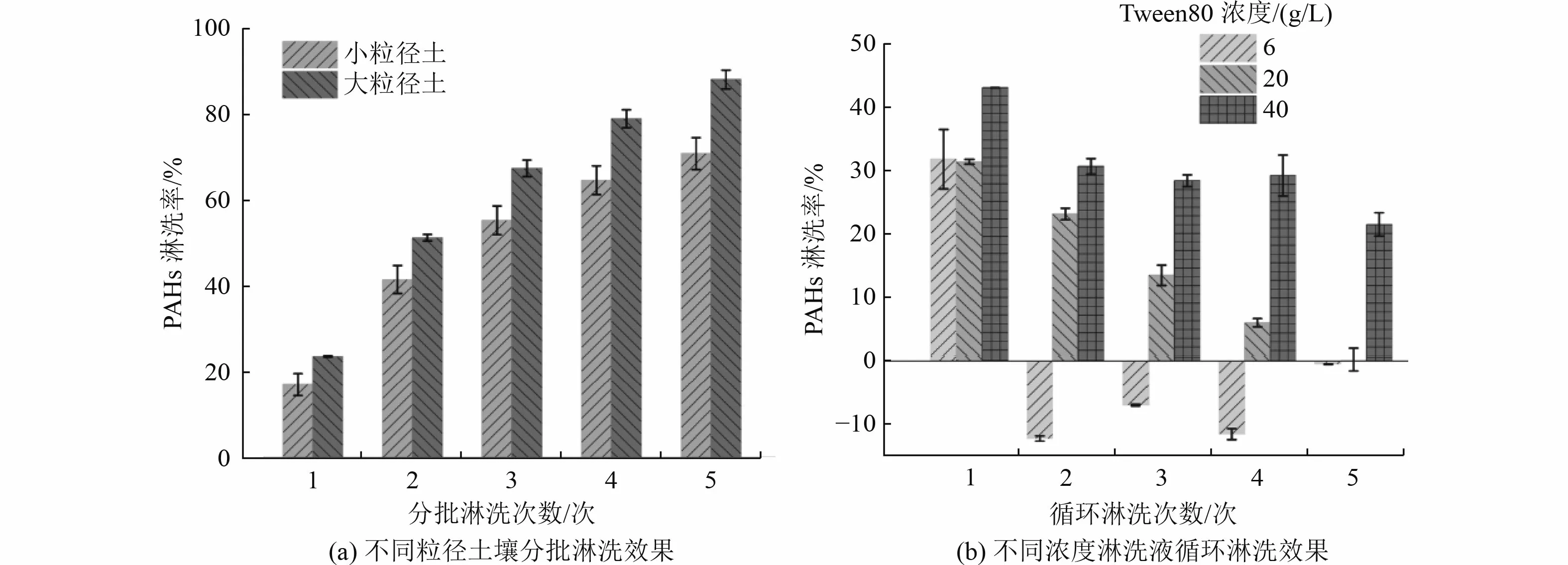
图5 工艺3 淋洗效果Fig.5 Washing effects of Process 3
淋洗液的重复利用率如图5(b)所示。不同浓度的淋洗液在5 次循环淋洗中表现出了不同的淋洗率。当淋洗液浓度为6 g/L 时,仅在第1 次淋洗时淋洗率达到31.88%,不具有循环利用价值;当淋洗液浓度为20 g/L 时,随淋洗次数的增加淋洗率不断降低,第1 次和第5 次的淋洗率分别为31.46%和0.15%,循环利用价值有限;当淋洗液浓度为40 g/L 时(本工艺所采用的淋洗液浓度),随淋洗次数的增加淋洗率降低缓慢,第1 次和第5 次的淋洗率分别为42.23%和21.58%,具有循环利用价值。由此说明,本工艺所选择的淋洗液(40 g/L Tween80),循环淋洗效果稳定,具有重复利用价值,可降低工程处理成本。
针对重复使用后的含有PAHs 的淋洗液,采用微生物水处理的方式降解其中的PAHs。PAHs 浓度为40 mg/L、Tween80 浓度为6 g/L 的模拟淋洗液降解效果如图6 所示,试验设置了空白组(未加外源降解菌)和试验组(投加了外源降解菌Aeromonassp.BCP-3)。通过投加外源降解菌可显著提升PAHs 的降解效果,7 d 降解率可达到94.95%,水中残留PAHs 的浓度小于2 mg/L。由此说明,通过微生物水处理的方式可有效降解淋洗液中的PAHs。
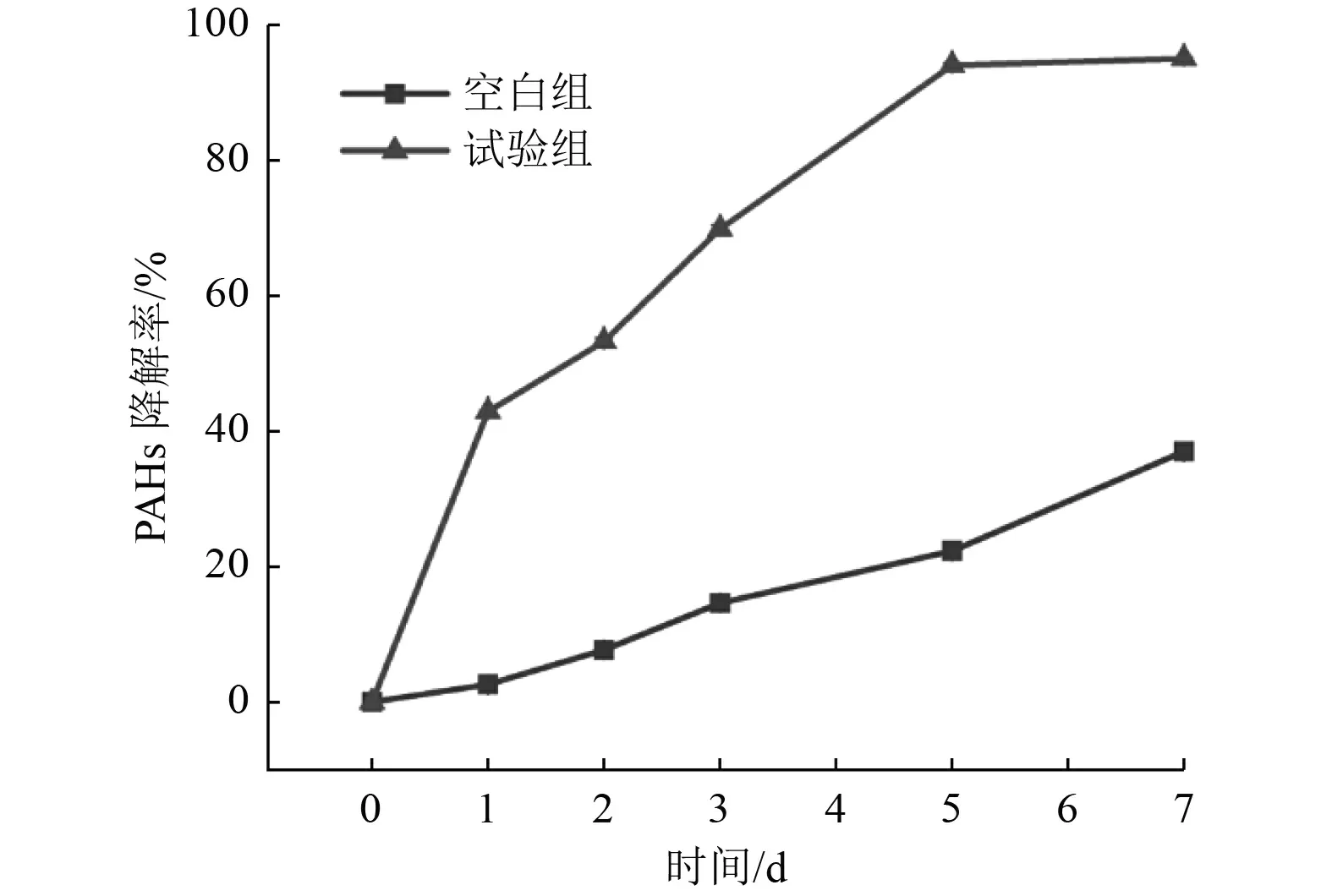
图6 淋洗液中PAHs 的生物水处理降解效果Fig.6 Biodegradation effect of PAHs in washing fluid by biological water treatment
2.2.4 工艺4 协同降解效果实际污染土壤湿筛分后各粒径质量占比及PAHs 浓度占比如表3 所示,以0.075、0.25 和1.7 mm 为划分标准将实际污染土壤划分为4 类,通过测试不同粒径土壤的PAHs 浓度可知,湿筛分后粒径≤1.7 mm 的3 类土壤中PAHs 浓度均大于100 mg/kg,而粒径>1.7 mm 的土壤中PAHs 的浓度仅为(5.45±0.45)mg/kg。除此之外,粒径≤1.7 mm 的3 类土壤质量占比约为50%,其PAHs 浓度占比却高达95.63%;粒径>1.7 mm 的土壤PAHs 浓度占比却仅为4.37%。与干筛分相比,湿筛分后各粒径土壤质量占比和PAHs 浓度占比差异化更加显著,由此说明湿筛分较干筛分的筛分效果更好,且湿筛分后的大粒径土中PAHs 浓度极低,更有利于实际工程中的减量化处理。
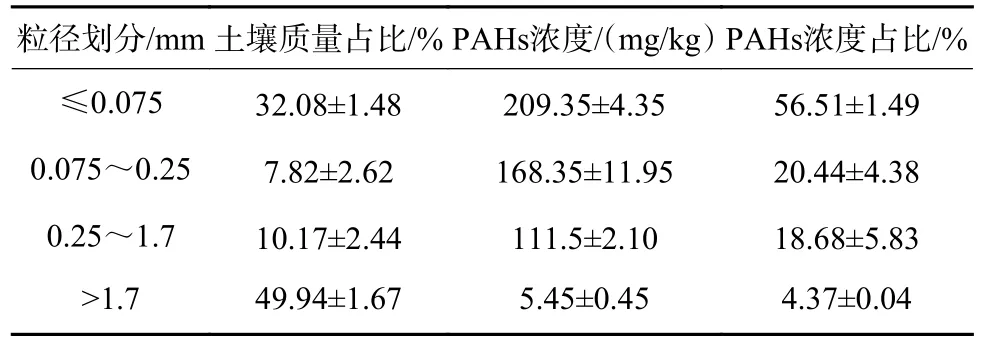
表3 湿筛分后各粒径污染土壤质量占比以及PAHs 浓度占比Table 3 Mass proportion and PAHs content proportion of contaminated soil with different particle sizes after wet-sieving
根据湿筛分后不同粒径土壤质量占比和PAHs 浓度占比分布特点,以1.7 mm 为界将干筛分后的土壤划分为小粒径土(≤1.7 mm)和大粒径土(>1.7 mm),进行分批淋洗处理。因大粒径土壤PAHs 浓度较低,仅通过1 次淋洗淋洗率就达到了89.10%±6.51%〔图7(a)〕,淋洗后的土壤PAHs 残留浓度小于1.2 mg/kg,且未检测到苯并[a]芘,达到GB 36600—2018 一类建设用地标准。针对小粒径土壤,随着淋洗次数的增加,PAHs 的淋洗率不断增加,5 次淋洗可达到64.76%±3.30%,土壤中PAHs 残留浓度为(64.33±6.02)mg/kg。随后针对未达标的小粒径土壤进行生物降解,由图7(b)~(d)可知,试验组对LMW-PAHs、HMW-PAHs 以及总PAHs 的生物降解率(起始降解率为64.76%±3.30%)分别为89.05%、85.33%和86.73%,相对于空白组的降解效果分别提升了8.90%、9.11%和8.54%。工艺4 相比于工艺1、2,生物降解的增量最小,可能原因为:1)生物降解时间较短,导致降解菌未能发挥出应有的降解潜力,在0~14 d 的降解周期内,试验组的降解速率未随时间的增加而明显放缓,存在降解潜力;2)土壤中大部分PAHs 被淋洗液带走,剩余的PAHs 与土壤颗粒结合更加紧密,被牢牢“锁定”在土壤颗粒中,导致生物利用率较低,降解效果差[5,18-19]。在生物降解的基础上进行化学氧化,氧化后小粒径土总PAHs 残留率为4.40%±0.27%,PAHs 总残留浓度约为(8.03±0.49)mg/kg,其中,未检测到萘、菲、蒽、苯并[a]蒽和茚并芘这5 种物质,荧蒽和芘的残留浓度分别为1.08 和1.45 mg/kg,苯并[b]荧蒽和苯并[a]芘的残留浓度分别小于5.5 和0.55 mg/kg,均达到GB 36600—2018 一类建设用地标准。计算可知,工艺4 对实际污染土壤总PAHs 的降解率为95.32%(表4)。循环淋洗和微生物水处理的部分试验已在2.2.3 节验证了其可行性,本节不再赘述。

表4 工艺4 对污染土壤中PAHs 的降解效果Table 4 PAHs degradation effect of contaminated soil in Process 4
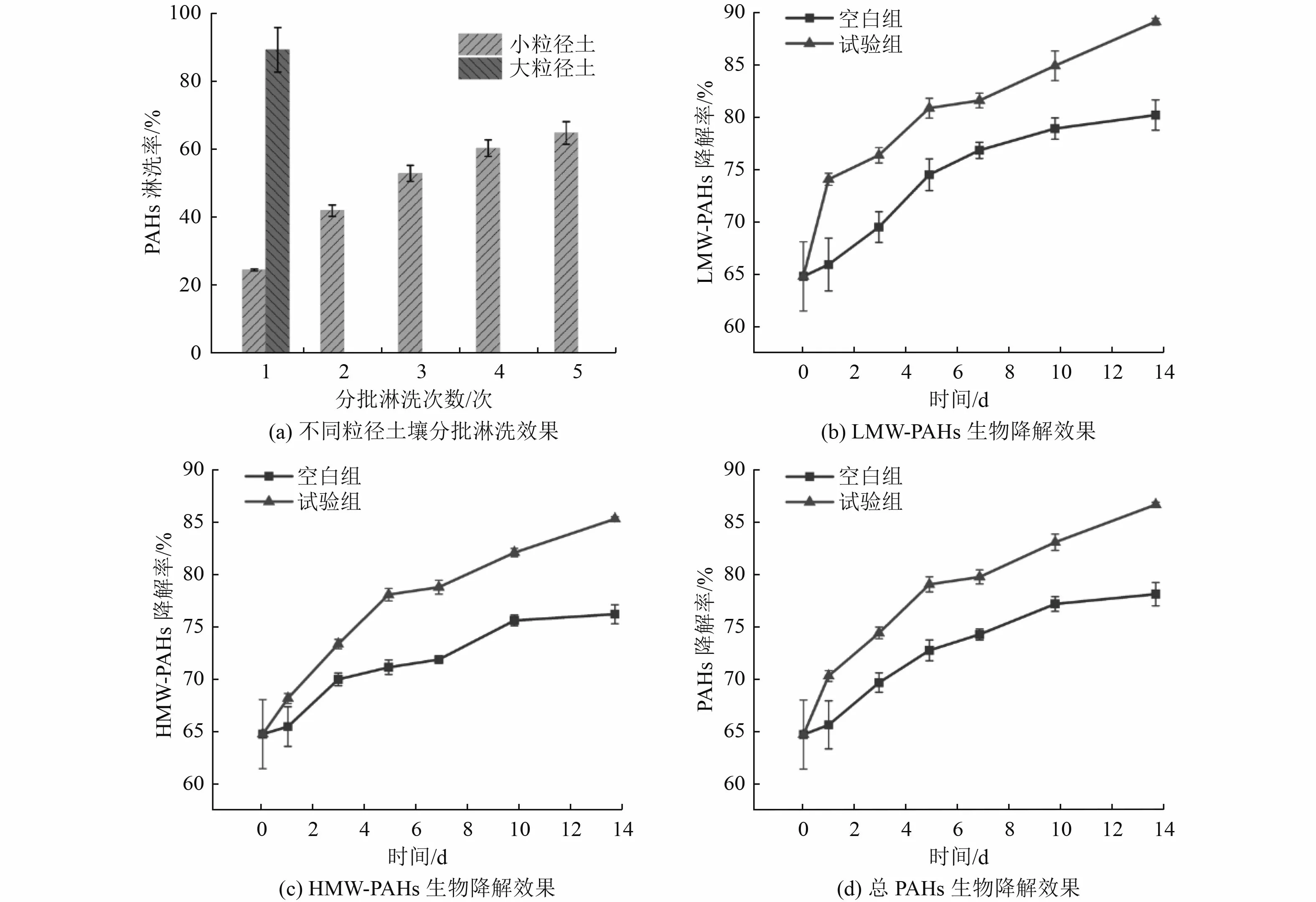
图7 工艺4 的淋洗及生物降解效果Fig.7 Washing and biodegradation effects of Process 4
2.2.5 4 种工艺对土壤中多环芳烃的降解效果对比
表5 给出了4 种工艺的降解效果对比。工艺1仅采用生物修复技术,在21 d 内达到58.64%的降解率。工艺2 在工艺1 的基础上增加了化学氧化技术,使得降解率提高到65.68%。工艺3 则摒弃了生物降解技术,将土壤淋洗与化学氧化技术相结合,大大缩短了修复时间,在13 d 内达到了85.36%的降解率。与前3 种工艺相比,尽管工艺4 的修复时间更长(29 d),但通过耦合多种修复技术,其协同降解率达到了95.32%,符合GB 36600—2018 一类建设用地标准。因此,在实际工程应用中,可根据土壤环境条件、污染程度、经济成本和修复目标等具体情况选择表5 中的降解工艺。
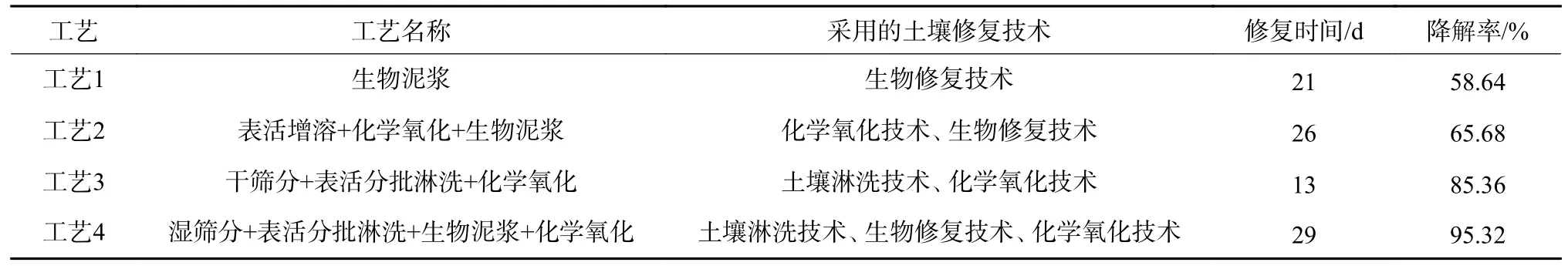
表5 不同工艺PAHs 降解效果对比Table 5 Comparison of PAHs degradation effects in different processes
3 结论
(1)针对焦化污染土壤PAHs 降解采用单一的生物泥浆降解工艺(工艺1)很难实现较高的降解效果,在一定的条件下,该工艺21 d 可实现58.64%的降解率。
(2)采用表活增溶+化学氧化+生物泥浆的降解工艺(工艺2)可以弥补单一处理方式的不足,但是化学氧化处理会对土壤产生一定的破坏作用,进而抑制生物降解的效果,导致总降解率提升有限,26 d 降解率可达到65.68%。
(3)通过土壤筛分发现在不同粒径的实际污染土壤中存在PAHs 分布不均匀的现象,一般土壤粒径越小,越容易富集PAHs,并且湿筛分比干筛分的筛分效果更好,湿筛分后的大粒径土中PAHs 浓度极低,更有利于实际工程中的减量化处理。
(4)采用干筛分+表活分批淋洗+化学氧化的降解工艺(工艺3)可有效缩短降解时间,但因分批淋洗后土壤中残留的PAHs 与土壤颗粒结合紧密,氧化药剂难以直接作用到颗粒物孔道中PAHs 分子,进而抑制了降解效果,13 d 降解率可达到85.36%。
(5)湿筛分+表活分批淋洗+生物泥浆+化学氧化的生物强化协同降解工艺(工艺4)的降解率最好,通过耦合多种修复技术并调整修复顺序,29 d 降解率可达到95.32%。
(6)工艺3 和工艺4 所选择的40 g/L Tween80淋洗液,循环淋洗效果稳定,具有重复利用价值。并且针对重复使用后的含有PAHs 的淋洗液可采用微生物水处理的方式有效降解其中的PAHs。
(7)工艺4 在实验室规模下表现良好,但应用于实际场地修复还需要综合考虑多个因素,如土壤环境条件、PAHs 种类和浓度、工艺操作条件和经济成本等。

