香雪抗病毒口服液体外抗甲型流感病毒及炎症因子的作用机制研究
李杰婷 ,陈俏连 ,赵昕 ,杨子峰,王玉涛*
1.广州呼吸健康研究院,广东 广州 510000
2.广州医科大学附属第一医院 呼吸疾病国家重点实验室,广东 广州 510000
3.广东省化学测量与应急检测技术重点实验室,广东 广州 510000
4.广东省科学院测试分析研究所(中国广州分析测试中心),广东 广州 510000
流感病毒是具有包膜的单链负链核糖核酸(RNA)病毒,根据核衣壳蛋白(NP)和基质蛋白(MP)分为A、B、C、D(甲、乙、丙、丁)4 种类型[1-2]。其中甲型流感病毒(IAV)可引起人畜共患呼吸道传染病,对人类健康构成巨大威胁。据世界卫生组织估计,季节性流感每年可导致300~500 万人患上严重疾病,每年可致25~50 万人死亡[3]。预防和控制流感最有效方法是接种疫苗和抗病毒药物[4-5],但病毒变异和耐药性使流感难以控制[6]。因此,迫切需要寻找新的抗病毒药物。
在我国中药用于预防和治疗流感已有数千年的历史,在治疗流感具有多途径、多靶点、不良反应少且不易产生耐药的独特优势,而被临床广泛应用。抗病毒口服液作为经典中药制剂,临床用于流感、手足口病、上呼吸道感染、手足口病等疾病[7]。全方由9 味中药组成,方中板蓝根清热解毒、凉血消肿、利咽散结,连翘苦凉、清热解毒以祛邪,二者共为君药。生石膏、知母甘寒清润,消泻肺胃之热,能增强君药清热之力为臣药;广藿香芳香辛散、解表祛湿,芦根清热解暑、生津止渴,生地黄清热凉血生津,石菖蒲芳香走窜、化湿祛痰,郁金行气凉血利咽,共为佐药;共奏清热祛湿,凉血解毒之效[8]。现有药理应用和临床实验研究发现,抗病毒口服液在体内可通过抑制炎性因子肿瘤坏死因子-α(TNF-α)从而达到减轻肺部炎症的作用,且可以提高γ 干扰素(IFN-γ)的含量从而抑制病毒的复制。此外,抗病毒口服液中的活性成分通过抑制线粒体融合素基因2(Mfn2)的表达以增强线粒体抗病毒信号蛋白(MAVS)抗病毒信号通路促进β 干扰素(IFN-β)的分泌,抑制流感病毒的复制,同时通过下调核因子-κB(NF-κB)抑制炎症反应,从而降低应激小鼠对流感病毒的易感性[9-15]。中药制剂由于现代工艺提取及遣方用药的配比不同,导致药效不同,而抗病毒口服液是基于原有的中药成分,进行了新的配比研发得来。本研究主要探讨了香雪抗病毒口服液体外抗流感病毒活性及其调节流感病毒诱导的炎症反应作用,以及在体外靶向宿主信号通路的潜在作用机制。
1 材料
香雪抗病毒口服液浸膏(规格0.352 g 生药/mL,批号20210129)购自广州市香雪制药股份有限公司;磷酸奥司他韦(批号20200308)购自南京康南林化工实业有限公司。以(R,S)-告依春、连翘酯苷A、连翘苷作为对照品对抗病毒口服液进行HPLC测定,每1 g 含(R,S)-吿依春73.58 μg,连翘酯苷A 890.94 μg,连翘苷3 544.06 μg。取351.50 g 该浸膏作为药效研究样品,每1 g 香雪抗病毒口服液浸膏含1.22 g 生药材,每1 mL 抗病毒口服液含本浓缩液0.352 g。
狗肾细胞系(MDCK)和人肺癌上皮细胞系(A549)均引自美国典型培养物保藏委员会细胞库(ATCC)。2 种细胞采用10%胎牛血清的DMEM/F12培养基(美国Gibco 公司)培养。
甲型流感病毒A/PR/8/34(H1N1)和A/Aichi/2/68(H3N2)均购自ATCC,依照标准病毒培养方法扩增保存。病毒滴度通过观察细胞病变效应(CPE)并采用Reed-Muench 法计算半数组织培养感染剂量(TCID50)表示。
2 方法
2.1 细胞毒性实验
采用噻唑蓝(MTT)染色法检测香雪抗病毒口服液对MDCK 细胞和A549 细胞的细胞毒作用。将生长密度适度的细胞接种到96 孔培养板中,24 h 后汇成单层细胞。加入DMEM 配制的香雪抗病毒口服液(1.562 5、3.125、6.25、12.5、25、50、100 mg/mL)培养液加入细胞培养板中,48 h 后去上清并用含0.5 mg/mL MTT 的PBS 溶液温育细胞4 h;弃上清并加入二甲基亚砜(DMSO)溶解活细胞内甲瓒晶体。使用Multiskan Spectrum 酶标仪(美国Thermo Fisher公司)测定490 nm 处的吸光度(A)。根据A值计算细胞存活率。
细胞存活率=(A药物组-A空白组)/(A正常组-A空白组)
将细胞存活率及对应药物浓度用GraphPad Prism 建立曲线,进行非线性回归方程(曲线拟合)并计算出药物的半数细胞毒性浓度(TC50)[16]。
2.2 体外抗病毒活性实验
以细胞病变抑制法对待测药物进行抗病毒活性检测。在96 孔板细胞长至单层后,接种100 个TCID50病毒液(100 μL/孔),37 ℃、5% CO2培养箱中孵育2 h 后,弃去病毒液,将DMEM-F12 培养基(含1.5 μg/mL TPCK 处理的胰蛋白酶)配制不同质量浓度(1.562 5、3.125、6.25、12.5、25、50、100 mg/mL)香雪抗病毒口服液、阳性对照药物奥司他韦(1.562 5、3.125、6.25、12.5、25、50、100 μmol/L),加入培养板中,48 h 后观察并记录致细胞病变效应(CPE)。采用Reed-Muench 法计算半数有效浓度(IC50),选择指数(SI)=TC50/IC50。SI 判断标准:SI<1 表示无效;SI 为1~2 表示高毒低效;SI>2表示低毒高效[16]。
抑制率=(A药物组-A病毒组)/(A正常组-A病毒组)
IC50=Antilog[B+(50-B)/(A-B)]×C
A=log(抑制率>50%药物浓度);B=log(抑制率<50%药物浓度);C=log 稀释倍数
2.3 空斑减少实验
用MOI=0.05 的H1N1 病毒感染6 孔板中的单层MDCK 细胞,分别设置H1N1 感染组、香雪抗病毒口服液(5、10、20 mg/mL)组(在香雪抗病毒口服液体外抗病毒活性实验中,已测得IC50=8.665 mg/mL,在此基础上,选择接近IC50浓度,低于IC50和高于IC50的3 个浓度,且呈梯度关系)。另设置对照组和非感染的香雪抗病毒口服液20 mg/mL 组。
H1N1 病毒感染的MDCK 细胞于37 ℃、5%CO2培养箱吸附2 h;换掉病毒液,加入含香雪抗病毒口服液(5、10、20 mg/mL)的0.8%琼脂(含1.5 μg/mL TPCK 处理的胰蛋白酶)覆盖细胞单层。H1N1 感染组和对照组加入等量培养液(含0.8%琼脂+1.5 μg/mL TPCK 处理的胰蛋白酶);在37 ℃、5% CO2培养箱中孵育,48 h 后使用10%福尔马林固定并去除覆盖琼脂,1%结晶紫染色,流水洗涤后计数斑块。
2.4 免疫荧光法检测抗流感时相实验
MDCK 细胞接种含小玻片培养板上,弃去上清,加入MOI=1 的H1N1 病毒感染细胞,4 ℃吸附2 h,各组别加入含TPCK 酶的DMEM 培养基。感染后0、2、4、6 h 分别加入含TPCK 酶的香雪抗病毒口服液10 mg/mL,同时设立对照组,置37 ℃、5%CO2培养箱培养8 h。然后取出玻片用4%多聚甲醛室温固定30 min;PBST 洗涤3 次(5 min/次),加入0.5% Triton X-100 通透10 min,PBST 洗涤3次(5 min/次),加入5%羊血清封闭30 min;吸弃封闭液加入H1N1 病毒NP 蛋白的特异性抗体(1∶100,用1%羊血清稀释),置4 ℃孵育过夜;加入FITC 标记二抗(1∶200,用1%羊血清稀释),室温1 h,PBST 洗涤3 次,甘油封(含细胞核染料)在荧光显微镜下观察结果。
2.5 实时荧光定量PCR 测定炎症细胞因子的表达
在6 孔板A549 细胞长至单层,加入MOI=0.02的H1N1 流感病毒培养液1 mL/孔作为模型组,在模型组的基础上,设置香雪抗病毒口服液(0.25、2.5、25 mg/mL)组,另设置非H1N1 感染的香雪抗病毒口服液(25 mg/mL)组和对照组。将细胞置于37℃、5% CO2培养箱中吸附2 h 后,弃去上清,再加入含待测药物的DMEM-F12 培养基,24 h 后,加入TRIzol 试剂裂解各组细胞,提取总RNA。方法如下:在各组别中加入1 mL TRIzol/孔裂解细胞,然后加入0.2 mL 氯仿充分混匀;室温静置2 min,12 000 r/min,4 ℃离心15 min。转移上清至1.5 mL EP 管中,按体积比加入异丙醇沉淀,室温静置10 min,12 000 r/min,4 ℃离心10 min,弃去上清。然后加入1 mL 75%酒精4 ℃、7 500×g离心5 min弃上清;再加入20 μL DEPC 水溶解RNA,测定RNA 浓度并用PrimeScriptTMRT Master Mix 试剂盒(TaKaRa Bio)进行逆转录。并采取Tag Man Premix Ex TapTMII(Takara Bio)对cDNA 样品进行RTqPCR 检测。PCR 数据使用检测系统(ABI PRISM®7500 Real-time PCR system,美国Applied Biosystems Co.)进行分析。PCR 产物的相对表达量使用2-ΔΔCt方法计算[17],引物序列见表1。

表1 RT-qPCR 引物探针序列Table 1 Primers and probes sequences for RT-qPCR
2.6 蛋白印迹实验检测信号通路蛋白表达
A549 细胞接种6 孔板中培养24 h 长至单层,分别设置对照组、H1N1 病毒感染的模型组、香雪抗病毒口服液(5、10、20 mg/mL)组以及非H1N1感染的香雪抗病毒口服液20 mg/mL 组。首先用PBS洗涤细胞,加入MOI=0.1 的H1N1 病毒感染A549细胞,37 ℃、5% CO2培养箱孵育2 h,弃病毒上清液,按设置组别加入相应培养基。24 h 后使用预冷PBS 洗涤细胞1 次,加入适量的RIPA 裂解液裂解细胞、提取总蛋白;采用BCA 试剂盒(Beyotime,中国)检测样品的蛋白浓度。取定量的蛋白样品进行10% SDS-PAGE 凝胶电泳;使用BIO-RAD 的半干转或湿转法将蛋白条带转至PVDF 膜上,5%牛血清白蛋白室温封闭1 h;4 ℃孵育对应抗体过夜,次日使用TBST 洗涤PVDF 膜并室温孵育相应二抗,TBST 洗涤3 次后加入ECL 发光液,使用化学发光成像仪进行曝光,获得目的蛋白条带。
2.7 统计学方法
应用SPSS 20.0 软件进行统计分析,GraphPad Prism 9 软件做图,计量资料以表示,采用单因素方差分析(One-Way ANOVA),如果差异有统计学意义,则进行组间LSD 检验。
3 结果
3.1 香雪抗病毒口服液的细胞毒性和抗流感活性
香雪抗病毒口服液对MDCK、A549 细胞的TC50分别为42.12、79.36 mg/mL,见图1。香雪抗病毒口服液对MDCK 细胞的H1N1 和H3N2 毒株有一定的抑制作用,IC50分别为 8.665、5.260 mg/mL,见表2。

图1 香雪抗病毒口服液对MDCK 和A549 细胞的细胞毒性(n=3)Fig.1 Effects of Xiangxue Kangbingdu Oral Liquid on viability of MDCK cell and A549 cell (n=3)

表2 香雪抗病毒口服液对流感病毒H1N1 和H3N2 的体外抑制作用Table 2 Inhibitory effects of Xiangxue Kangbingdu Oral Liquid against influenza virus strains H1N1 and H3N2 in vitro
此外,空斑减少实验结果如图2 所示,与H1N1感染组相比,香雪抗病毒口服液20 mg/mL 组可以有效抑制病毒斑块的形成。非感染的香雪抗病毒口服液20 mg/mL 组不会引起炎症反应。结果表明香雪抗病毒口服液在体外具有抗甲型流感病毒活性。

图2 香雪抗病毒口服液对感染H1N1 的MDCK 细胞空斑数量的影响Fig.2 Effect of Xiangxue Kangbingdu Oral Liquid on the number of plaque in MDCK cells infected with H1N1
3.2 香雪抗病毒口服液对H1N1 病毒感染的NP 蛋白表达的影响
H1N1 病毒感染MDCK 细胞后0、2、4、6 h 给予香雪抗病毒口服液10 mg/mL 干预治疗,结果显示0~2 h 给药干预处理,病毒合成的NP 蛋白不但明显减少(图3),而且可以观察到大部分NP 蛋白被限制在细胞核内;4~6 h 后再给药干预,对病毒合成的NP 蛋白无影响。该结果提示香雪抗病毒口服液可抑制H1N1 病毒的NP 蛋白释放,且其作用阶段可能在病毒复制早期。

图3 香雪抗病毒口服液对H1N1 病毒感染MDCK 细胞后NP 蛋白表达和核输出的影响Fig.3 Effect of Xiangxue Kangbingdu Oral Liquid on NP protein expression and nuclear output of MDCK cells infected with H1N1 virus
3.3 香雪抗病毒口服液对H1N1 感染诱导的炎症细胞因子和趋化因子mRNA 表达的影响
如图4 所示,与模型组比较,香雪抗病毒口服液能呈剂量相关性降低H1N1 诱导的A549 细胞炎症因子TNF-α、RIG-I、CCL5、MIP-1β、IP-10、IL-10、IFN-λ、IFN-β、IL-8mRNA 的表达(P<0.05、0.01、0.001)。非感染的香雪抗病毒口服液25 mg/mL组未引起显著的炎性反应。

图4 香雪抗病毒口服液对H1N1 病毒诱导的A549 细胞炎症因子mRNA 相对表达量的影响(,n=3)Fig.4 Effect of Xiangxue Kangbingdu Oral Liquid on the relative expression of mRNA of inflammatory factors in A549 cells induced by H1N1 virus (,n=3)
3.4 香雪抗病毒口服液对H1N1 感染诱导的信号通路分子表达的影响
如图5 所示,与对照组相比,模型组的TLR3、RIG-I、MDA-5 和磷酸化的NF-κB p65、IκBα、STAT1、STAT2、STAT3 明显上调。而在香雪抗病毒口服液的干预下,能抑制TLR3、RIG-I 和MDA-5受体的表达,下调NF-κB p65、IκBα、STAT1、STAT2、STAT3 的磷酸化水平,且在20 mg/mL 浓度下尤为明显。
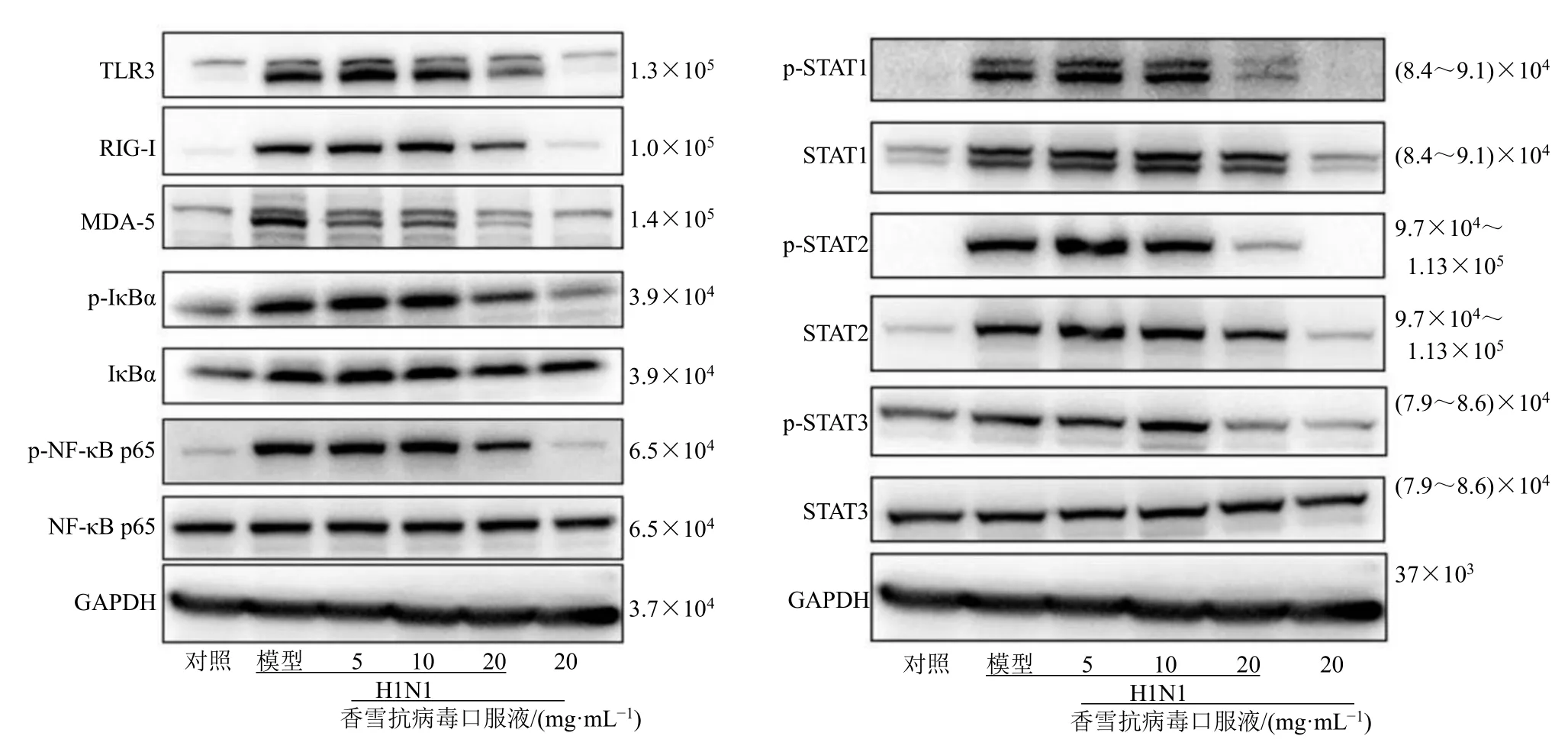
图5 香雪抗病毒口服液对H1N1 病毒感染A549 细胞引起的信号通路蛋白的影响Fig.5 Effects of Xiangxue Kangbingdu Oral Liquid on signaling pathway proteins induced by H1N1 virus infection in A549 cells
4 讨论
香雪抗病毒口服液是以白虎汤和清瘟败毒饮为基础加减而制成。药理应用和临床实验研究发现其有较好的抗病毒疗效,但其抗病毒、抗炎的作用机制尚较少。此外,中药制剂由于现代工艺提取及遣方用药的配比不同,导致药效不同,而香雪抗病毒口服液是基于原有的中药成分,进行了新的配比研发得来。因此,本研究主要探讨了香雪抗病毒口服液的体外抗病毒和抗炎活性及作用机制。
本研究以CPE 法、MTT 检测和空斑减少实验观察了香雪抗病毒口服液对甲型流感病毒的抗病毒作用。结果表明,香雪抗病毒口服液对H1N1 和H3N2 病毒的抑制作用显著,IC50分别为8.665、5.260 mg/mL,且能显著减少H1N1 病毒斑块数目。同时免疫荧光实验发现,香雪抗病毒口服液可减少甲型流感病毒的NP 蛋白合成,而且主要在流感病毒复制的早期,说明香雪抗病毒口服液可能作用于病毒入侵的吸附、穿入或内体释放阶段。另一种可能性与宿主的免疫调节有关。
流感病毒感染可诱导IL-8、IL-10、TNF-α、IP-10、CCL5、MIP-1β 等细胞因子及趋化因子产生[18],并激活IFN 依赖的抗病毒宿主应答,但也可能引起炎症级联反应。研究表明,“细胞因子风暴”是诱发重症流感及死亡的原因之一[19]。体外模型发现,经香雪抗病毒口服液20 mg/mL 处理后,TNF-α、CCL5、MIP-1β、IP-10、IL-10、IL-8、IFN-β、IFNλmRNA 表达均显著降低。
当流感病毒通过呼吸道入侵机体后,靶向感染呼吸道上皮细胞,宿主天然免疫反应被迅速启动,通过模式识别受体(PRRs),识别病原相关分子模式(PAMPs),启动抗病毒级联反应。首先PRRs(包括RIG-I、MDA5、TLRs)特异性识别在甲型流感病毒复制过程中形成的核酸和中间产物:RIG-I 和MDA5 的CARD 结构域进一步与线粒体膜中的MAVS 蛋白发生作用;TLRs 依赖或不依赖Myd88适配体以激活β 干扰素TIR 结构域衔接蛋白(TRIF)[20]。激活的MAVS 和TRIF 共同诱导NFκB 的激活。在没有病原体刺激的情况下,NF-κB 与IκBα 结合形成一个复合物。当IκBα 被激活形成磷酸化的IκBα 时,导致NF-κB/IκBα 复合物降解并释放转录因子p65,使NF-κB 信号通路激活,从而介导促炎细胞因子(TNF-α、IL-8、IL-6 等)以及I 型(IFN-α、IFN-β)、II 型(IFN-γ)与III 型(IFN-λ)干扰素的释放[21]。机体的免疫反应有利于抵抗并清除病毒,减轻组织损伤,但过度的免疫反应也会介导机体产生严重失衡的炎症因子风暴以及促使病毒的子代病毒复制。本研究的结果表明,20 mg/mL香雪抗病毒口服液不仅抑制了H1N1 感染引起的A549 细胞中RIG-I 和MDA-5 表达的上调,而且还抑制了TLR3 的表达。同时NF-κB p65 和IκBα 转录因子的磷酸化也明显受到抑制。
此外,IFNs 可以被适配器受体识别,并进一步激活JAK-STAT 转录因子。然后,磷酸化的STAT1和STAT2 形成异源二聚体,进入细胞核,诱导干扰素刺激基因(ISGs)的表达,调节抗病毒蛋白的合成,如Mx 家族蛋白、干扰素诱导蛋白15 抗体(ISG-15)、干扰素诱导跨膜蛋白(IFITMS)等[22-23]。20 mg/mL 香雪抗病毒口服液可显著抑制p-STAT1 和p-STAT2 转录因子的激活,从而抑制干扰素产生和级联放大效应。
综上,香雪抗病毒口服液对甲型流感病毒的作用机制可能是通过抑制模式识别受体(RIG-I、MDA-5、TLR3)的表达,从而抑制NF-κB 及JAKSTAT 信号通路激活,下调促炎因子和趋化因子的产生,减少炎症反应。
利益冲突 所有作者均声明不存在利益冲突

