金毛狗脊原叶体增殖和孢子体转化条件的优化
黄嘉凤, 但 俊, 黄满霖, 陈选鹏, 黄海波
(广州中医药大学中药学院, 广州 510006)
金毛狗脊[Cibotiumbarometz(L. ) J. Sm.]为蚌壳蕨科(Dicksoniaceae)金毛狗属(CibotiumKaulf.)多年生大型树状陆生蕨类[1],又称金毛猴、狗青、百枝、金毛狗等,以根状茎入药,具有祛风湿、补肝肾、强腰膝等功效,适用于腰背酸痛、风寒湿痹、手足麻木及半身不遂等症,是重要的药用植物[2]。金毛狗脊植株具有四季常绿的大型羽状叶,且根状茎和叶柄基部密被金色茸毛而状似伏地的金毛狗,形态独特,具有较高的经济开发价值[3-4]。虽然金毛狗脊分布范围较广,但由于生存环境破坏严重以及人为大量采挖等因素的影响,野生资源量不断减少,已被列为国家二级保护植物[5]。通过金毛狗脊组织培养的研究,对保护野生资源、扩大该物种的数量,对该物种的开发利用等具有重要意义。
目前,针对金毛狗脊的组织培养研究多集中在金毛狗脊的孢子萌发[6-7]、配子体发育[8-9]和孢子体诱导[10]方面,缺乏对金毛狗脊原叶体增殖和孢子体诱导分化方面的研究。苏钰琴[10]研究了6-BA对金毛狗脊孢子体诱导分化的影响;李雪等[6]研究了无机盐浓度和是否添加KT、NAA和BA对孢子体诱导的影响,但其考察的影响金毛狗脊生长发育的因素还不够完善,且因素水平设置不够。因此,设计无机盐、蔗糖、KT、NAA和6-BA等5因素4水平正交实验,研究金毛狗脊原叶体增殖和孢子体转化的最佳培养条件,为金毛狗脊组织培养提供理论依据,以更好地实现金毛狗脊孢子无菌繁殖培养。
1 材料与方法
1.1 孢子的采集
金毛狗脊孢子于2021年4月17日采自广州花都区梯面镇西坑村,113°14′15.12″E,23°34′40.76″N,海拔101 m。采集孢子时将背面有成熟孢子囊的羽片剪下,用干净的报纸包裹并装于干净的密封袋中带回实验室,于室内通风干燥处放置1 d,轻轻拍打使孢子囊内的孢子充分脱落,取出羽片后把报纸上的孢子先后用60目和200目的金属筛过筛,得到较为纯净的孢子粉。过筛后的孢子粉收集于50 mL离心管内,密封条密封,放入密封袋中于4 ℃冰箱保存备用。
1.2 孢子的消毒
孢子在接种前进行消毒处理,称取适量金毛狗孢子,置于2 mL离心管中,先用无菌水润湿,离心去掉上清液,加入5%次氯酸钠水溶液,浸泡消毒4 min,离心去上清液,用无菌水清洗3~5次,加入蒸馏水至2 mL摇匀。
1.3 培养基的筛选
采用正交设计考察不同浓度的无机盐、蔗糖、萘乙酸(NAA)、激动素(KT)和6-苄氨基嘌呤(6-BA)对金毛狗脊原叶体增殖和孢子体转化的影响,用L16(45)正交表安排实验,见表1。
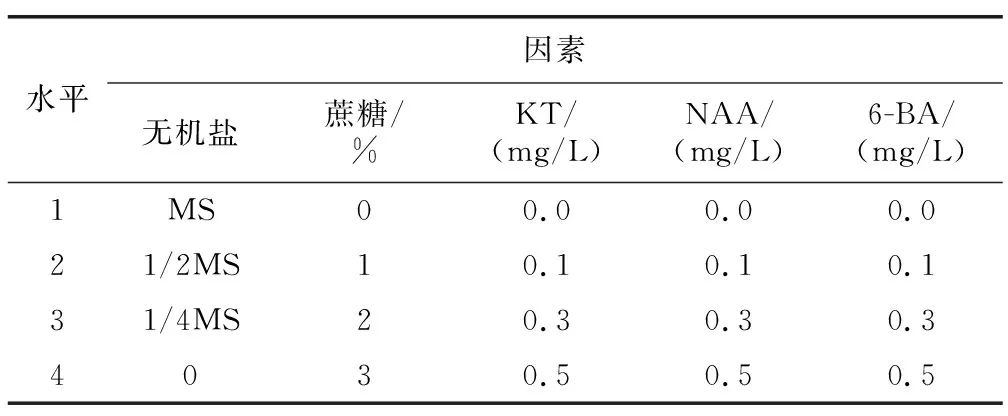
表1 金毛狗脊原叶体增殖和孢子体转化培养基正交设计Table 1 Orthogonal design table of Cibotium barometzprotophyll proliferation and sporophyte transformation medium
1.4 实验方法
从孢子接种培养60~80 d所得原叶体中,选取生长良好无污染的翠绿色原叶体团在超净工作台上,将其剥离开,分割成1 cm3的小原叶体团,每瓶接种5个原叶体团(图1),16个处理组,每组15瓶。接种30 d后将原叶体团取出称量每瓶的总鲜重,使用烘箱,于60 ℃烘干6 h,称量每瓶总干重,得到原叶体增殖后的重量数据[11]。

注:A为接种前;B为接种后;培养瓶直径6.8 cm。图1 金毛狗脊原叶体Fig.1 Cibotium barometz protolophylls

图3 16个处理组金毛狗脊孢子体转化结果Fig.3 Transformation results of sporophytes in 16 treatment groups
同样方法,每瓶接种5个原叶体团,16个处理组,每组15瓶。培养80 d后计算孢子体转化数和孢子体转化率,得到孢子体转化数据。以第一片孢子小叶片出现视为孢子体开始转化,预实验中发现原叶体接种40~55 d后开始转化,故原叶体增殖培养以原叶体接种30 d后统计数据,孢子体转化培养开始转化30 d后(原叶体接种80 d后)进行孢子体转化率数据统计。
1.5 数据处理及统计
数据采用Minitab软件对指标的综合评分进行极差分析,采用SPSS软件对原始数据进行非参数检验分析。孢子体转化数为每瓶从5个原叶体团观测到的小孢子体总数。
孢子体转化率/%=(原叶体团转化数/原叶体接种团数)×100%。
2 结果与分析
2.1 不同培养基配比对金毛狗脊原叶体增殖的影响
表2结果表明,无机盐、蔗糖和NAA浓度对金毛狗脊原叶体增殖有显著影响,而KT浓度对原叶体增殖无显著影响,原叶体鲜重表明,6-BA浓度对原叶体增殖影响无显著差异,从原叶体干重结果可知,6-BA浓度对原叶体增殖存在显著影响。随着无机盐浓度升高,原叶体重量呈先升后降趋势,最佳无机盐浓度为1/2MS,在无机盐为零的13~16处理组中,原叶体生长发育较差,发黄发蔫;随着蔗糖浓度升高,原叶体重量先增后减,添加2%蔗糖最为适宜。原叶体重量随着NAA浓度提高呈先增后减又增的趋势,当NAA浓度为0.1 mg/L时,原叶体增殖结果最佳;原叶体重量随着6-BA浓度提高呈先减后增又减的趋势,当6-BA浓度为0.3 mg/L时,原叶体增殖效果最佳。

表2 不同培养基配比对金毛狗脊原叶体增殖的影响Table 2 Effects of different media ratios on the proliferation of protolophylls in Cibotium barometz
由于实验涉及原叶体鲜重和原叶体干重两个指标,因此采用排队评分法[12]对实验结果进行分析,原叶体重量从小到大排序依次评分1~16分,将每组实验的两个指标得分相加即得综合评分(表3),随即进行极差分析,分析结果如表4所示。
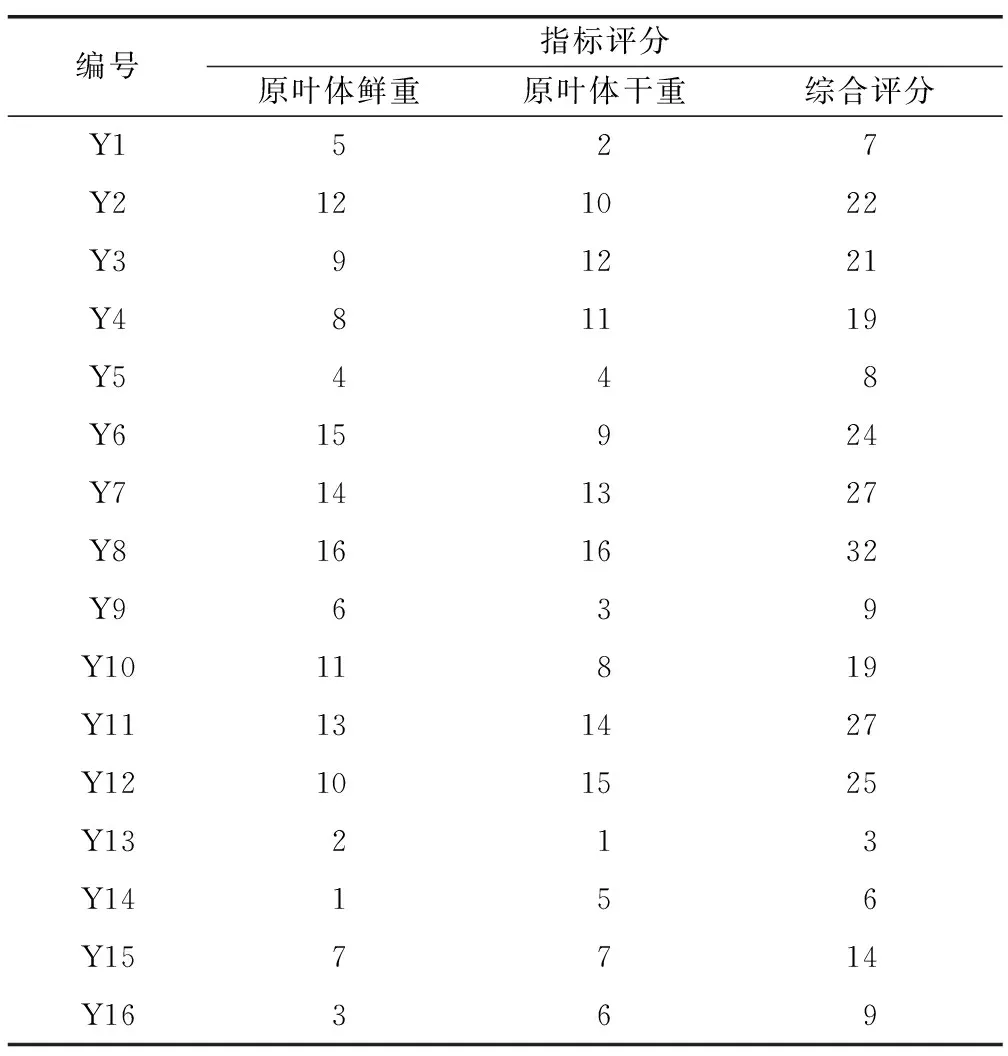
表3 原叶体增殖排队评分法结果Table 3 Results of protophyll proliferation queuing scoring method

表4 原叶体增殖排队评分法极差分析Table 4 Extreme analysis table of protophyll proliferation queuing scoring method
在16组实验中,Y8组原叶体鲜重、干重和实验综合评分最高,条件为1/2MS+3%蔗糖+0.3 mg/L KT+0.1 mg/L NAA,原叶体干重和鲜重分别为1.798 1 g、0.159 1 g。根据极差分析结果(表5),5个因素对金毛狗脊原叶体增殖的影响为:蔗糖(B)>无机盐(A)>NAA(D)>6-BA(E)>KT(C),最佳培养基配比为B3A2D2E3C2,即1/2MS+2%蔗糖+0.1 mg/L NAA+0.3 mg/L 6-BA+0.1 mg/L KT。

表5 不同培养基配比对原叶体增殖的影响非参数检验Table 5 Nonparametric test of the effect of different media ratios on protophyll proliferation
2.2 不同培养基配比对金毛狗脊孢子体转化的影响
表6结果表明,无机盐、KT、NAA和6-BA浓度对金毛狗脊孢子体转化有显著影响,而蔗糖浓度对孢子体转化无显著影响。随着无机盐浓度升高,孢子体转化数和转化率均呈先升后降趋势,1/4MS对于孢子体转化最适宜,在无机盐为零的13~16处理组中,原叶体生长发育较差,逐渐发黄并死亡,无法诱导孢子体;随着NAA浓度提高,孢子体转化数和孢子体转化率呈先增后减又增的趋势,当NAA浓度为0.1 mg/L时,孢子体转化结果最佳;随着6-BA浓度提高,孢子体转化数和孢子体转化率呈先减后增又减的趋势,不添加6-BA时,孢子体转化效果最佳;孢子体转化数和孢子体转化率随着KT浓度的提高呈先减后增的趋势,当KT浓度为0.5 mg/L时,孢子体转化结果最佳。

表6 不同培养基配比对孢子体转化的影响Table 6 Effects of different media ratios on sporophyte transformation
由于实验指标同样有两个:孢子体转化数和孢子体转化率,因此采用排队评分法对实验结果进行分析,从小到大排序给分,转化数和转化率为0的均给1分,其余依次下去,数据相同则取平均,如排名为7的数据有两组,则评分为7.5分,将每组实验的两个指标分数相加即得综合评分(表7),随即进行极差分析,分析结果如表8所示。
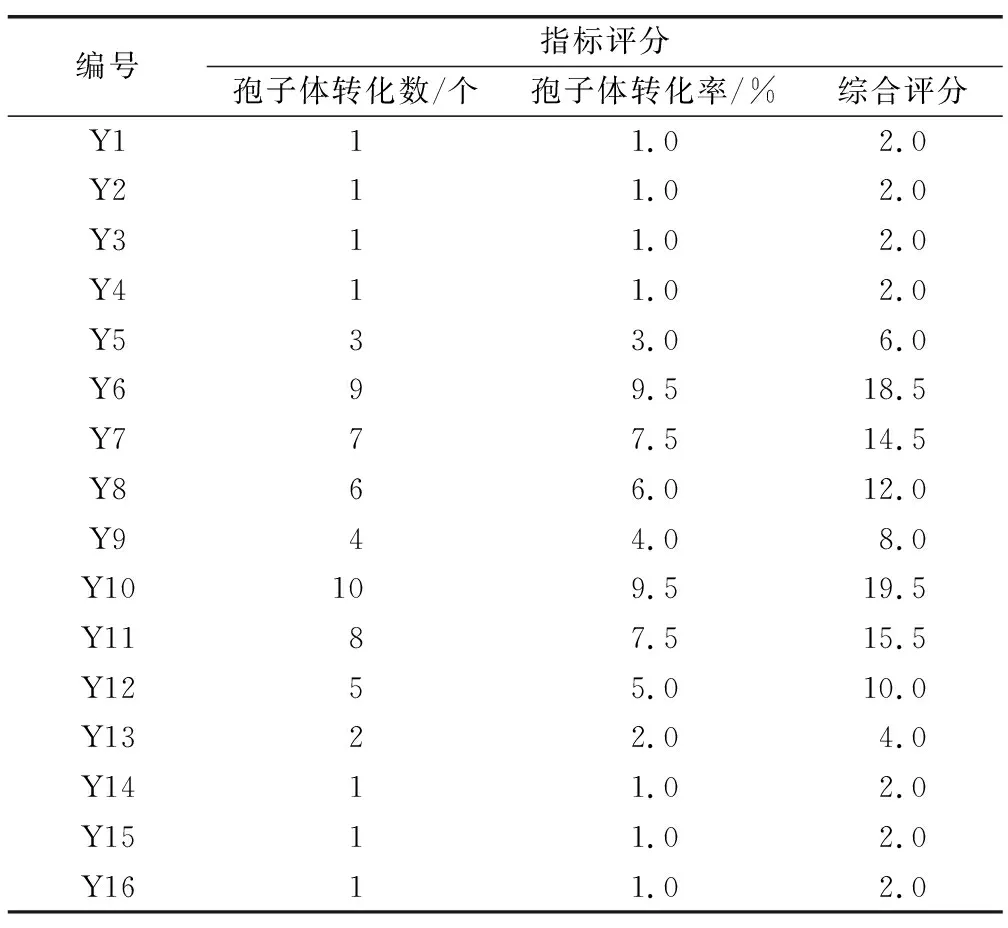
表7 孢子体转化排队评分法结果数据Table 7 Sporophyte transformation queuing scoring method result data
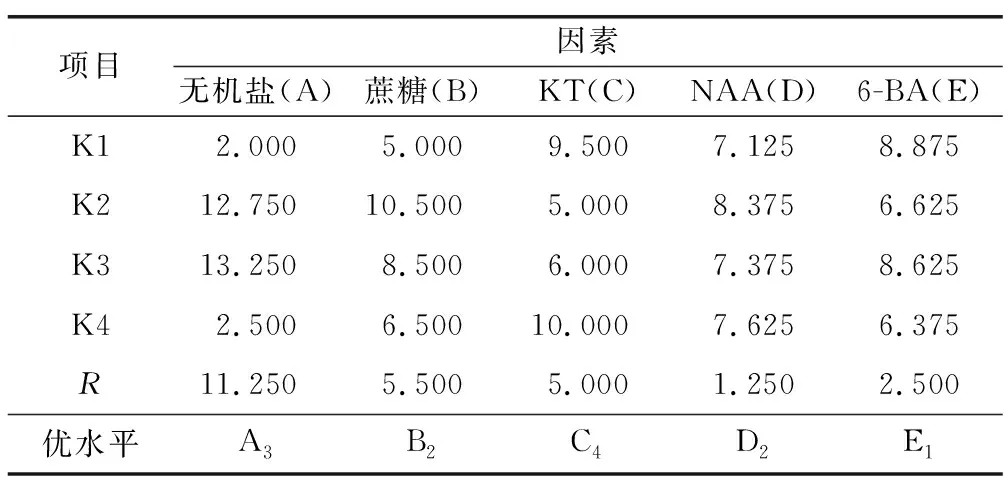
表8 孢子体转化排队评分法极差分析Table 8 Extreme analysis table of sporophyte transformation queuing scoring method

表9 不同培养基配比对孢子体转化的影响非参数检验Table 9 Nonparametric test of the effect of different media ratios on sporophyte transformation
在16组实验中,Y10组孢子体转化数、转化率和实验综合评分最高,即条件为1/4MS+1%蔗糖+0.5 mg/L KT+0.3 mg/L NAA,孢子体转化数和转化率分别为61.44和100%。Y6组孢子体转化率虽然也达到100%,但孢子体转化数仅为37.78,仅为Y10组(61.44)的50%,故Y6组劣于Y10组。根据极差分析(表8),5个因素对金毛狗脊孢子体转化的影响为:无机盐(A)>蔗糖(B)>KT(C)>6-BA(E)>NAA(D),最佳培养基配比为A3B2C4E1D2,即1/4MS+1%蔗糖+0.5 mg/L KT+0.1 mg/L NAA。

图2 16个处理组金毛狗脊原叶体增殖结果 Fig.2 Proliferation results of protolophylls of Cibotium barometz in 16 treatment groups
3 结论与讨论
培养基中无机盐浓度对金毛狗脊原叶体的生长发育和孢子体转化都有显著影响。本研究表明,金毛狗脊原叶体增殖宜采用1/2MS,孢子体转化宜采用1/4MS。在无机盐为零的处理组中,原叶体生长发育较差,逐渐发黄并死亡,无法诱导孢子体,不能正常生长发育,这说明在金毛狗脊原叶体增殖和孢子体转化过程中,无机盐是必不可少的成分,且低浓度的无机盐更适宜于金毛狗脊原叶体的生长发育。李雪等[6]认为,低盐离子浓度有利于金毛狗脊孢子体的诱导,1/10 MS孢子体诱导相对最高。本实验结果与之有一定差异,原因有待进一步验证。
蔗糖可为蕨类植物的生长发育提供碳源,同时调节培养基中的渗透压。在蔗糖对金毛狗脊原叶体增殖和孢子体转化影响的研究中发现,蔗糖对金毛狗脊的原叶体增殖影响较大,但对金毛狗脊的孢子体转化无明显影响,在一定范围内,较高的蔗糖含量更有利于金毛狗脊的原叶体增殖,而金毛狗脊孢子体转化对蔗糖的需求不高,因此培养中可不添加或少量添加蔗糖。吴华等[13]对扇叶铁线蕨(AdiantumflabellulatumL.)的研究表明,蔗糖有利于分生区的发育和性器官的分化,本实验结果与之一致;而在孢子体转化上结果不同,蔗糖对金毛狗脊孢子体转化影响不显著,原因可能为蕨类植物之间存在一定差异,金毛狗脊孢子体转化相较扇叶铁线蕨对蔗糖的需求更少。
本研究表明,NAA和6-BA对金毛狗脊原叶体增殖和孢子体转化均有显著影响。添加低浓度NAA(0.1 mg/L),有利于金毛狗脊原叶体增殖和孢子体转化,且生根也较多,可以达到孢子体诱导的目的;与王益和[14]的实验结果一致。添加低浓度6-BA(0.3 mg/L),有利于金毛狗脊原叶体增殖;不添加6-BA对孢子体转化更适宜。苏钰琴[10]在原叶体接种25 d后统计金毛狗脊孢子体分化率,发现随着6-BA浓度的增加,孢子体分化率提高,原叶体变得紧实,当6-BA浓度达1.5 mg/L时,分化率最高,再加大6-BA的浓度,分化率降低。本实验结果与其不一致,原因可能是原叶体初始大小和培养天数的不同,导致所得到的孢子体转化率不一致;另外,6-BA浓度设置的不同,金毛狗脊的孢子体转化可能需要较高浓度的6-BA,有待进一步的验证。KT对金毛狗脊的孢子体转化有利,随着KT浓度的提高,孢子体转化数和孢子体转化率呈先减后增的趋势,原因可能为金毛狗脊生长所需KT浓度较高,不在实验浓度范围内,有待进一步研究。李雪等[6]实验显示,KT(0.1 mg/L)有利于金毛狗孢子体诱导;孙晓丹[15]对桂皮紫萁(OsmundacinnamomeaL. var. Asiatica)的研究中显示,一定浓度的KT有利于桂皮紫萁原叶体增殖和孢子体转化。因此,金毛狗脊原叶体增殖需要低浓度的NAA和6-BA,对KT无明显需求;孢子体转化培养同样需要低浓度的NAA和6-BA,KT或需要更高浓度。

