一株酸性红壤拟小球藻的分离及其镉吸附能力研究
张 菊,谢章彰,汤 佳,张亚平,刘芳华*
1.广东工业大学环境科学与工程学院,广东 广州 510006
2.广东省科学院生态环境与土壤研究所,华南土壤污染控制与修复国家地方联合工程研究中心,广东省农业环境综合治理重点实验室,广东 广州 510650
2014 年《全国土壤污染状况调查公报》数据显示,全国大约19%的农业土壤受到重金属污染,7%的土壤受到Cd 污染.水稻田被Cd 污染时会导致水稻中Cd 含量超标,而长期食用含Cd 大米时会引起痛痛病和肾衰竭等疾病[1-3].因此水稻田土壤中Cd 的钝化及去除对保障水稻食品安全意义重大.土壤中Cd 活性与土壤pH、有机质、氧化还原电位及矿物元素等相关,其中pH 是影响其生物有效性的主要因素[1,4].土壤pH 的升高会降低Cd 的生物有效性,进而降低作物中的Cd 含量[3,5].Honma 等[6]研究表明,将水稻盆栽中土壤pH 从5.80 提升至6.30 后,生物有效态Cd含量从0.50 μg/kg 降到0.00 μg/kg.Chen 等[7]在水稻大田实验中将土壤pH 从5.50 提升到6.50 时发现,土壤中生物有效态Cd 含量从0.40 mg/kg 降至0.10 mg/kg,谷物中的Cd 含量降低了70%~80%.可见,提升水稻田土壤pH 将有利于降低土壤Cd 的生物有效性.
另外,由于降雨淋溶作用以及氮肥的过度使用,我国华南红壤酸化问题日益严重.Wen 等[8]研究发现,在2005-2020 年的15 年间,珠江三角洲稻田土平均pH 从5.95 降到5.27,下降了0.68 个单位.土壤酸化一方面会导致农作物减产,另一方面又加剧了土壤Cd 污染,进一步威胁粮食安全.常用的治理方法(如施用石灰、粉煤灰等)容易导致土壤板结、施加材料容易流失和土壤复酸化等问题[9],无法从根本上解决土壤酸化问题,因此亟待开发出绿色可持续的酸性红壤改良方法.
微藻具有生长速度快、环境适应性强等特点,其中部分微藻具有较强的Cd 吸附能力[10].例如,Kumar等[11]从废水中筛选得到一株Chlorella vulgaris,其对Cd 的最大吸附量为97.43 mg/g,最大去除率为80%;Yang 等[12]研究发现,Chlorella minutissimaUTEX2341对Cd 的最大吸附量达到303.30 mg/g,去除率达到90%;Sooksawat 等[13]研究发现,Chara aculeolata和Nitella opaca对Cd 的最大吸附量分别为23.00 和20.50 mg/g,去除率为70%左右.除此之外,微藻还具有提升pH 的潜力,如Wallace 等[14]研究表明,藻类可以通过消耗无机碳和无机氮提升环境中的pH.Wang 等[15]也发现,微藻可以将体系中的pH 从7.00提升至10.00 左右.这些特性使微藻在我国南方水稻田Cd 污染修复和土壤酸化改良方面展现出较好的应用潜力.
然而目前关于微藻在酸性环境下的pH 提升作用及Cd 吸附能力的研究较少,相关的藻种资源仍旧缺乏.本研究从广东省广州市稻田土壤中筛选得到一株耐酸且具有Cd 吸附能力的微藻,对其耐酸性、Cd耐受性及Cd 吸附能力进行了研究,以期为缓解水稻田酸化及Cd 污染提供新的微生物资源.
1 材料与方法
1.1 样品获取
样品采集于春季华南稻田土壤(113°52′51″E、23°03′43″N),用取样器采集深度为0~40 cm 的稻田土,用聚乙烯样品袋盛放样品,4 ℃下保存备用.
1.2 微藻的富集培养
将10.00 g 新鲜土壤样品置于50.00 mL 灭菌BG-11液体培养基[16]〔NaNO31.00 g/L,K2HPO440.00 mg/L,MgSO4·7H2O 75.00 mg/L,CaCl2·2H2O 36.00 mg/L,柠檬酸铁6.00 mg/L,EDTA 1.00 mg/L,Na2CO320.00 mg/L,H3BO42.86 mg/L,MnCl2·H2O 1.81 mg/L,ZnSO4·7H2O 0.22 mg/L,CuSO4·5H2O 0.08 mg/L,Na2MoO4·2H2O 0.39 mg/L,Co(NO3)2·6H2O 0.05 mg/L〕,培养基初始pH 为5.00,加入CdCl2母液,使培养基Cd 浓度为5.00 mg/L,置于30 ℃光照培养箱中培养5 d;转接两次,转接量为2%.
1.3 微藻的分离与鉴定
用稀释涂布法分离微藻,将1.2 节所述富集物用无菌蒸馏水稀释至浓度为10-4~10-6,吸取一定的稀释液(10.00 μL)置于BG-11 固体培养基〔NaNO31.00 g/L,K2HPO440.00 mg/L,MgSO4·7H2O 75.00 mg/L,CaCl2·2H2O 36.00 mg/L,柠檬酸铁6.00 mg/L,EDTA 1.00 mg/L,Na2CO320.00 mg/L,H3BO42.86 mg/L,MnCl2·H2O 1.81 mg/L,ZnSO4·7H2O 0.22 mg/L,CuSO4·5H2O 0.08 mg/L,Na2MoO4·2H2O 0.39 mg/L,Co(NO3)2·6H2O 0.05 mg/L,琼脂粉18.00 g/L〕平板上,用涂布棒将稀释液均匀涂在整个平板上.将平板置于30 ℃光照培养箱中,4 000 lx 全光照培养5 d,挑取单个藻落划线于BG-11 固体平板中培养基中,4 000 lx 全光照培养待长出单菌落后,重复平板划线过程直至获得纯藻.
将单藻置于无菌BG-11 培养基中,4 000 lx 全光照培养至对数期,取2.00 mL 对数期生长的藻液于离心管中,8 000 r/min 下离心5 min,收集藻体转移至研钵中,加入液氮研磨,用Ezup 柱式真菌基因组DNA抽提试剂盒提取DNA(上海生物工程股份有限公司),进行18S rRNA 基因扩增.
PCR 扩增体系:2×Tap mix 12.50 μL,18S rRNA基因通用引物为NS1(GTATCATATGCTTGTCTC)和NS6(GCATCACAGACCTGTTATTGCCTC),购买于上海生物工程股份有限公司.PCR 程序:预热95 ℃,5 min;裂解95 ℃,30 s;退火55 ℃,30 s;延伸72 ℃,30 s;循环30 次;72 ℃延伸10 min.将产物进行琼脂糖凝胶电泳判断是否成功获得目标条带,并将产物送至生物工程(上海)股份有限公司测序,将测序结果上传NCBI 数据库(Genebank 登记号为OR122455),并将测序结果上传NCBI 数据库,进行Blast 比对[17].
1.4 形态观察
取2.00 mL 对数生长期的微藻培养液于离心管中,6 000 r/min 下离心5 min,用2.00 mL PBS(浓度为0.10 mmol/L,pH=7.40) 重悬浮后离心弃上清,加入2.5%戊二醛磷酸缓冲液重悬浮后于4 ℃下过夜固定,用0.15%戊二醛磷酸缓冲液冲洗后,依次用30%、50%、70%、90%和100%浓度的乙醇进行梯度脱水,每次脱水15 min,再用叔丁醇置换乙醇,静置15 min,8 000 r/min 下离心5 min,将得到的藻体冷冻干燥2 h后进行喷金镀膜,将制备好的样品于扫描电镜(Phenom Pro X,复纳科学仪器有限公司,荷兰)下观察[18].
1.5 微藻的耐酸耐Cd 能力鉴定
用浓度为0.50 mmol/L 的HCl 调节BG-11 培养基pH 分别为3.00、3.50、4.00、5.00、6.00、7.00,分别接种对数生长期微藻,接种量均为2%,于30 ℃光照培养箱中培养,4 000 lx 全光照培养,每3 d 测一次OD680,共培养24 d.
以pH 为6.00 的BG-11 培养基为基础培养基,加入CdCl2母液,使Cd 浓度分别为0.00、1.00、2.00、3.00、6.00 mg/L,接种对数生长期的微藻,接种量为2%,于30 ℃光照培养箱中培养,4 000 lx 全光照培养,每3 d 测一次OD680,共培养12 d.
1.6 微藻对Cd 的吸附及不同pH 对微藻吸附Cd 的影响
以pH 为6.00 的BG-11 培养基为基础培养基,加入CdCl2母液使BG-11 培养基中Cd 浓度分别为0.00、1.50、3.00、5.00 mg/L.用无CdCl2的BG-11 培养基培养微藻,离心收集并等体积加入不同Cd 浓度的BG-11培养基中,于30 ℃光照培养箱中培养,4 000 lx 全光照培养48 h,每12 h 取一次样监测OD680和体系pH.收集滤液(0.22 μm 滤头脱氯)用于Cd 浓度检测.
配置pH 分别为4.00、5.00、6.00 的BG-11 培养基,分别加入100 μL 1.50 g/L 的CdCl2母液,使培养基中Cd 浓度为3.00 mg/L.接种等体积用无CdCl2的BG-11 培养基培养至对数期的微藻,于30 ℃光照培养箱中培养48 h,每12 h 取一次样监测OD680和体系pH.收集滤液(0.22 μm 滤头脱氯)用于Cd 浓度检测.
使用电感合等离子发射光谱仪(ICP-OES,Perkin Elmer Optima 8000,美国)测定溶液中Cd 的含量.
2 结果与分析
2.1 微藻的分离及鉴定
经富集及稀释涂布和平板划线得到一株具有耐酸耐Cd 能力的微藻,命名为ZJ1,藻株ZJ1 藻落呈绿色圆形,表面相对光滑;藻株ZJ1 藻细胞为圆球形,直径约4~5 μm,表面相对光滑(见图1).
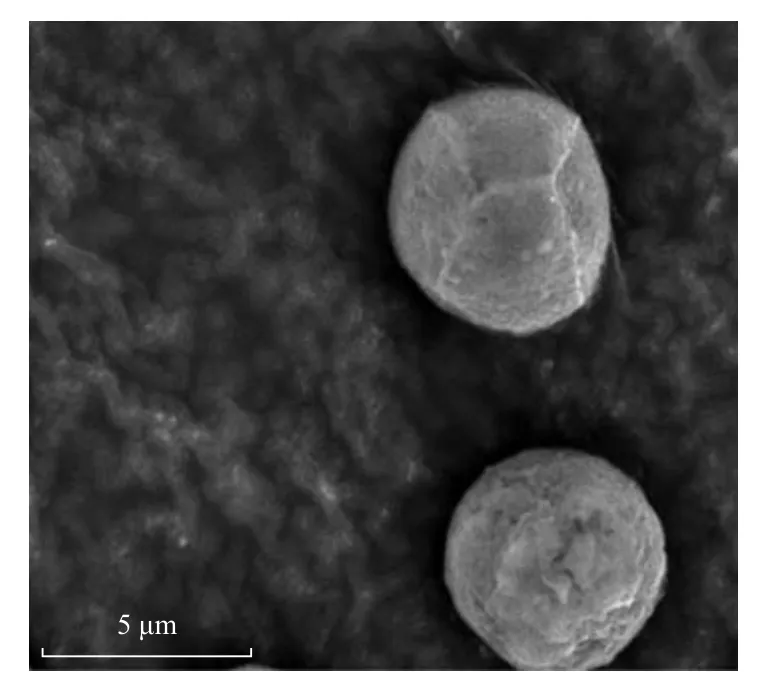
图1 藻株ZJ1 的扫描电镜图像Fig.1 Electron microscope image of ZJ1
通过18S rRNA 基因序列的测序和比对,建立藻株ZJ1 的系统发育树(见图2).通过Blast 比对发现藻株ZJ1 与Parachlorella kessleriSAG 27.87 相似度最高,为99.41%.将藻株ZJ1 与其他几株相似度较高的微藻的18S rRNA 基因序列绘制成系统发育树,发现藻株ZJ1 与Parachlorella kessleriSAG 27.87 在同一分支,所以鉴定藻株ZJ1 为拟小球藻属,将其命名为Parachlorellasp.ZJ1.

图2 基于18S rRNA 基因序列构建的藻株ZJ1 的系统发育树Fig.2 Phylogenetic tree of strain ZJ1 based on 18S rRNA gene sequences
2.2 藻株ZJ1 的耐酸耐Cd 能力鉴定
2.2.1 藻株ZJ1 耐酸能力鉴定
为考察藻株ZJ1 的耐酸能力,将藻株ZJ1 接种于不同初始pH 的BG-11 培养基,检测其培养液OD680值的变化.藻株ZJ1 在初始pH 分别为3.50、4.00、5.00、6.00 和7.00 的BG-11 培养基中培养24 d 后,藻液OD680值由初始的0.01 分别增至1.91±0.21、4.43±0.02、4.41±0.21、4.52±0.05 和4.51±0.05,而在初始pH 为3.00 的培养体系中,OD680值没有增加〔见图3(a)〕.因此可以推断,藻株ZJ1 适宜生长的pH 为4.00~7.00,并且能够耐受pH 为3.50 的培养体系,具有较强的耐酸能力.这说明藻株ZJ1 具备在南方酸性水稻田中生长的潜力.
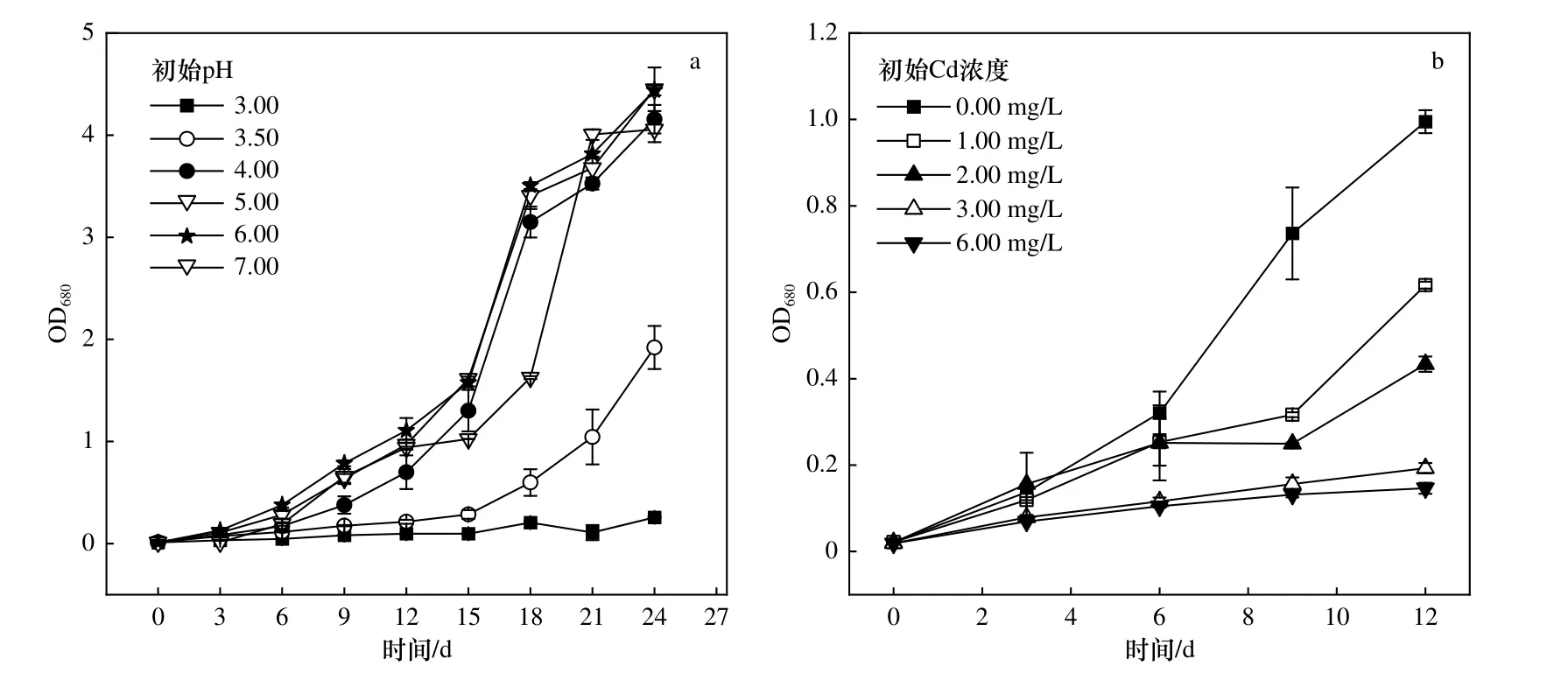
图3 不同初始pH 下和不同初始Cd 浓度下藻株ZJ1 的生长情况Fig.3 ZJ1 growth with different initial pH values and different initial Cd concentrations
2.2.2 藻株ZJ1 耐Cd 能力鉴定
为了考察藻株ZJ1 的耐Cd 能力,将藻株ZJ1 接种于不同初始Cd 浓度的BG-11 培养基中,检测其培养液的OD680.藻株ZJ1 在初始Cd 浓度分别为0.00、1.00、2.00、3.00 和6.00 mg/L 的BG-11 培养基培养15 d 后,藻液OD680值由初始的0.02±0.01 分别增至0.99±0.03、0.61±0.01、0.44±0.02、0.19±0.01和0.15±0.01,虽然Cd 浓度为6.00 mg/L 时藻株ZJ1 的生长受到明显的抑制,但是经过15 d 的培养,藻株ZJ1 的藻液OD680值从0.02±0.01 增至0.15±0.01〔见图3(b)〕,说明藻株ZJ1 可以在Cd 浓度为6.00 mg/L 的培养体系中生长,具有一定的Cd 耐受能力.
2.3 藻株ZJ1 对Cd 的吸附能力鉴定
为考察藻株ZJ1 的Cd 吸附能力,将藻株ZJ1 接种于不同Cd 浓度下pH=6.00 的BG-11 培养基中,检测其培养液的OD680值.藻株ZJ1 在初始Cd 浓度分别为1.50、3.00 和5.00 mg/L 的体系中培养24 h 后达到Cd 吸附平衡〔见图4(a)〕,3 种浓度下的Cd 吸附率分别为67.36%±0.38%、64.89%±0.58%和41.03%±0.71%〔见图4(b)〕,其中初始Cd 浓度为5.00 mg/L 时的吸附率与初始Cd 浓度为1.50 和3.00mg/L 时的吸附率有显著性差异(P<0.01).同时,初始Cd 浓度为1.50、3.00 和5.00 mg/L 体系中的OD680由1.17±0.01 分别增至1.57±0.02、1.52±0.02 和1.33±0.01〔见图4(d)〕,pH 由6.00 分别升至7.66±0.10、7.40±0.08 和6.81±0.10〔见图4(c)〕,说明藻株ZJ1 在生长的过程中具有提升体系pH 的能力.
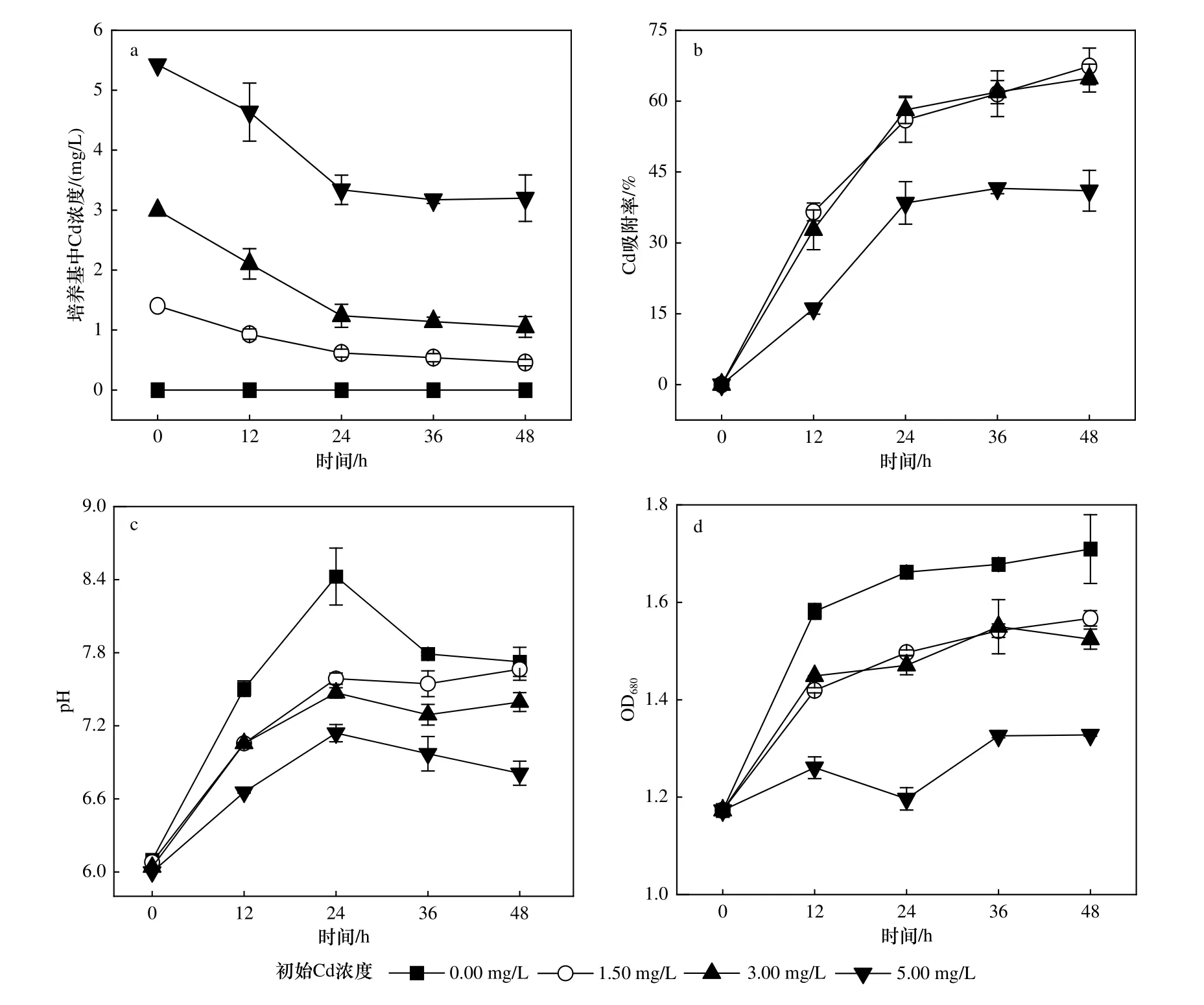
图4 不同初始Cd 浓度(pH=6.00)培养基中藻株ZJ1 吸附Cd 的过程中Cd 浓度、吸附率、pH 和OD680 随时间的变化情况Fig.4 The change of free Cd concentration,adsorption rate,pH and OD680 with time during the adsorption of Cd by ZJ1 in different initial Cd concentration (pH=6.00) mediumover time
2.4 藻株ZJ1 吸附Cd 的动力学及等温吸附模型分析
2.4.1 藻株ZJ1 吸附Cd 的动力学模型分析
利用动力学模型对微藻吸附Cd 的实验数据进行拟合,可以了解微藻吸附Cd 的反应动力学过程,探究微藻吸附Cd 的物理化学机制.常用的动力学模型包括一级动力学(pesudo-first-order)和二级动力学(pesudo-second-order)模型.符合一级动力学模型表明微藻对Cd 的吸附以物理吸附为主,符合二级动力学模型则表示吸附过程以化学吸附为主[19-21].
一级动力学模型:
二级动力学模型:
式中:qe为吸附平衡时菌体对重金属离子的吸附量,mg/g;qt为时间t时菌体对重金属离子的吸附量,mg/g;K1为一级动力学速率常数,h-1;K2为二级动力学速率常数,g/(mg·h);t为时间,h.
藻株ZJ1 在Cd 浓度为3.00 mg/L 时吸附Cd 的动力学模型拟合参数见表1.
由表1 可知,Cd 浓度为3.00 mg/L 时藻株ZJ1 吸附Cd 的一级和二级动力学模型拟合相关系数(R2)分别为0.76 和0.91,并且二级动力学模型预测的qe(5.80 mg/g)与吸附实验结果(5.60 mg/g)相差不大,由此可知藻株ZJ1 吸附Cd 更符合二级动力学模型.上述结果说明在Cd 浓度为3.00 mg/L 时,藻株ZJ1对Cd 的吸附更符合二级动力学模型,可推测藻株ZJ1 对Cd 的吸附过程主要受藻株ZJ1 表面结构与重金属离子之间电子分享、化合价力的化学吸附、络合或者螯合作用,更符合化学吸附[22-23].
2.4.2 藻株ZJ1 吸附Cd 的等温吸附学模型分析
Langmuir 等温吸附模型是描述生物吸附剂吸附重金属离子广泛使用的模型,该模型是基于以下3 个假设:①气体只能在固体表面上呈单分子层吸附;②所有的吸附位点都相似;③被吸附分子之间无相互作用.Freudlich 等温吸附模型是基于吸附材料具有不同的吸附位点这一假设[20,24-25].利用式(3)(4) 对藻株ZJ1 在Cd 浓度为1.50、3.00 和5.00 mg/L 时达到吸附平衡时的数据进行Langmuir 等温吸附模型拟合,利用式(5)(6) 对藻株ZJ1 在Cd 浓度为1.50、3.00 和5.00 mg/L 时达到吸附平衡时的数据进行Freudlich等温吸附模型拟合,模型参数如表2 所示.

表2 藻株ZJ1 吸附Cd 等温吸附模型相关参数Table 2 Parameters of the isothermal adsorption model for cadmium ions adsorbed by ZJ1
式中:Qe为吸附剂上的平衡重金属浓度,mg/g;Qm为吸附剂的饱和吸附量,mg/g;Ce为溶液中平衡重金属浓度,mg/L;KL为Langmuir 吸附常数,L/mg.
Freundlich 等温吸附模型是一个经验方程,是建立在实验基础上,基于吸附质在多相表面上的吸附建立的经验吸附平衡模式.计算公式如下:
式中:KF为Freundlich 吸附常数,(mg/g)/(mg/L)n;n为Freudlich 等温吸附模型常数.
由表2 可知,对于藻株ZJ1,Langmuir 等温吸附模型的相关系数(R2) 为0.97,高于Freudlich 等温吸附的R2值(0.89),表明Langmuir 等温吸附能更好地描述藻株ZJ1 对溶液中Cd 的吸附过程,说明藻株ZJ1 吸附Cd 是单层吸附类型.Langmuir 等温吸附模型常数KL<1.00 L/mg,表明藻株ZJ1 对Cd 具有较好的吸附能力.Freudlich 等温吸附模型常数n>1.00,表明藻株ZJ1 可以在Cd 相对较高的浓度中进行吸附[26].
2.5 低pH 下藻株ZJ1 的Cd 吸附能力
为考察在酸性条件下藻株ZJ1 对Cd 的吸附效果,将藻株ZJ1 接种于不同初始pH 的BG-11 培养基中,检测其生长周期的OD680、培养基的pH 和培养基中Cd 浓度随时间的变化情况.藻株ZJ1 在Cd 浓度为3.00 mg/L 以及初始pH 分别为4.00、5.00 和6.00 的BG-11 培养基中培养48 h,Cd 的吸附率分别为56.79%±0.02%、56.77%±0.03% 和56.81%±0.01%,在36 h 基本达到吸附平衡〔见图5(b)〕.藻株ZJ1 在吸附Cd 的过程中,生物量和pH 都有一定的提升,培养48 h后,初始pH 为4.00、5.00 和6.00 体系中的pH 也从4.50、5.50 和6.40 分别增至6.61±0.01、6.78±0.15 和7.10±0.03〔见图5(c)〕,初始pH 为4.00、5.00 和6.00体系中的OD680从1.47 分别增至2.59±0.03、2.39±0.06和2.31±0.07〔见图5(d)〕.与初始pH 为5.00 和6.00的处理相比,pH 为4.00 时藻株ZJ1 在前12 h 的Cd吸附速率较慢,与pH 为5.00 和6.00 时的吸附率有显著性差异(P<0.01),OD680也明显低于其他两个处理.这可能是因为较低的pH 影响了藻株ZJ1 的生长及其对Cd 的吸附.
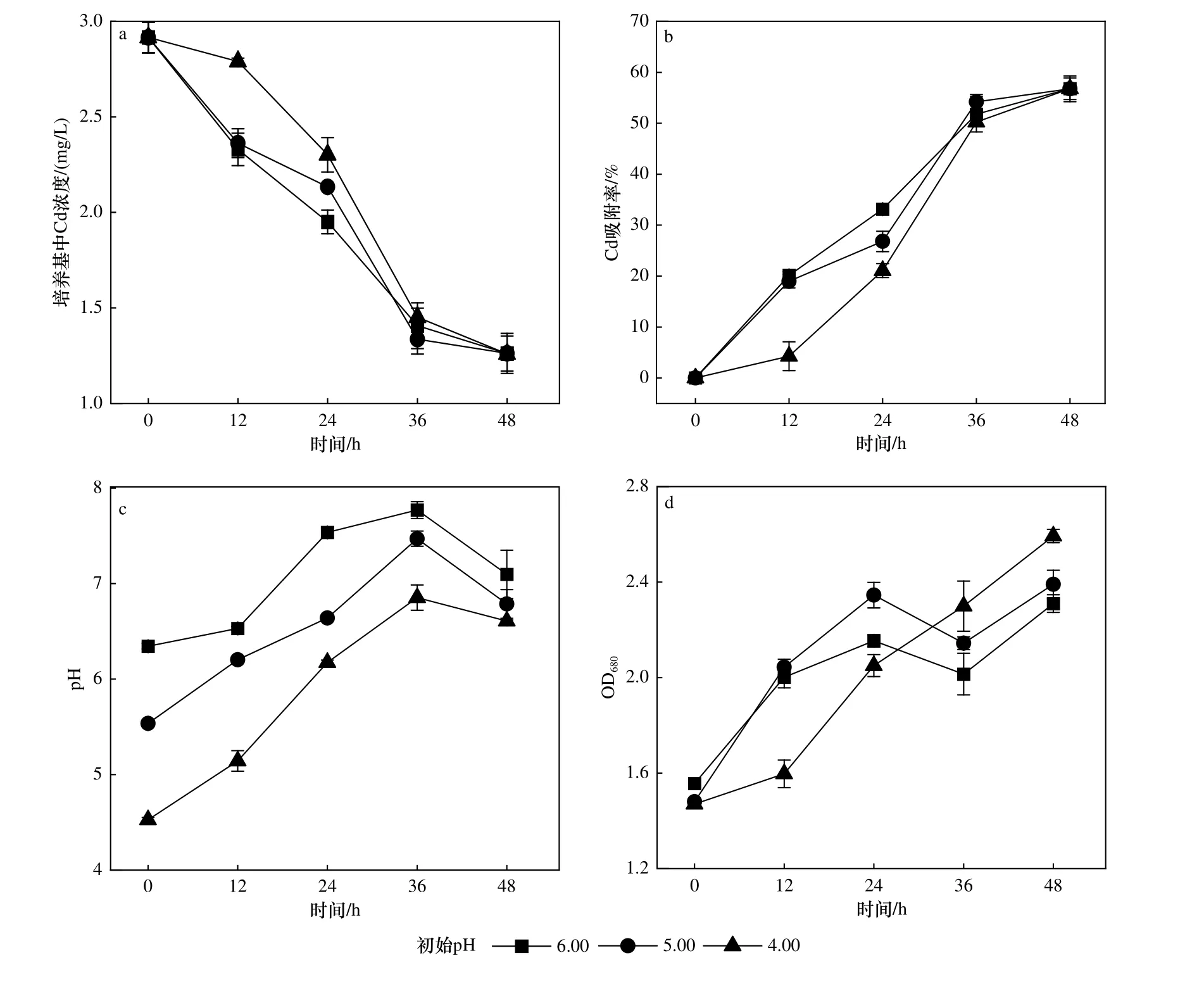
图5 不同初始pH 条件 (Cd 浓度为3.00 mg/L)下藻株ZJ1 Cd 吸附过程中Cd 浓度、吸附率、pH 和OD680 的变化情况Fig.5 The change of free Cd concentration,adsorption rate,pH and OD680 in the adsorption process of ZJ1 under different initial pH conditions (Cd concentration of 3.00 mg/L)
2.6 讨论
2.6.1 藻株ZJ1 的Cd 污染修复潜力
近期有较多研究者分别从废水和土壤中筛选获得具有Cd 吸附能力的微藻,并且证实其对Cd 的吸附率在60.00% 以上[13,27],这些结果都表明微藻具备Cd 污染处理潜力.然而,华南水稻土的酸性环境对微藻在Cd 污染土壤修复中的应用提出了新的挑战.酸性环境一方面会抑制微藻的生长,另一方面又会提升Cd 活性,加剧其对微藻的毒性作用,这使得普通微藻在酸性Cd 污染环境中难以生存.由于目前有关微藻Cd 吸附相关研究大多在中性pH 条件下进行[14-15],且已公开的Cd 污染修复微藻大多不具备耐酸能力.因此,筛选出耐酸耐Cd 的微藻对酸性环境下的Cd污染修复具有重要意义.本研究从华南水稻土中定向筛选得到一株耐酸且具有Cd 吸附能力的微藻Parachlorellasp.ZJ1,有助于拓展微藻在Cd 污染修复领域的应用范围.
耐酸耐Cd 实验发现,藻株ZJ1 能在pH 较低的环境中生长,能耐受的最低pH 为3.50;对Cd 也有一定的耐受,能在Cd 浓度为6.00 mg/L 的体系中生长.我国华南土壤pH 大多在4.50~6.50 之间,呈现弱酸性,土壤Cd 含量为0.02~4.23 mg/kg[28-29].因此,藻株ZJ1 能够适应绝大部分华南土壤环境,具有修复华南水稻土壤Cd 污染的潜力.
2.6.2 藻株ZJI 的Cd 吸附机制及影响因素
微藻对Cd 的吸附包括物理吸附和化学吸附,物理吸附主要是范德华力的作用,化学吸附主要是离子交换和络合反应,与微藻表面的官能团及聚合物有关,化学吸附较物理吸附有更好的稳定性[30-32].藻株ZJ1对Cd 的吸附实验发现,藻株ZJ1 对Cd 具有一定的吸附能力,动力学模型拟合结果表明藻株ZJ1 对Cd的吸附以化学吸附为主,所以藻株ZJ1 对Cd 的吸附可能由其胞外聚合物和官能团与Cd 发生的离子交换或络合反应主导的.并且,微藻胞外聚合物含量会受外界因素的影响,Cd 的加入很有可能会增加微藻胞外聚合物的量从而增加其对Cd 的吸附.此外,藻株ZJ1 对Cd 的吸附效率随着Cd 浓度的增加而下降,这可能是因为微藻表面的吸附位点是有限的,当微藻表面吸附位点达到吸附饱和时,体系中Cd 浓度的增加并不会提升微藻对Cd 的去除率[33-34].
低pH 条件下藻株ZJ1 的Cd 吸附实验结果表明,藻株ZJ1 可提升体系pH,这与已有研究结果相一致,如Wallace 等[14]在研究废水pH 波动影响因素时发现其与废水中的微藻含量相关,废水中微藻含量增加会导致废水pH 升高;Wang 等[15]研究栅藻对锰的吸附时发现,栅藻通过生长可以将体系的pH 从7.00 提升至9.00,证实pH 的提升可能是由于微藻在生长过程中能够同化无机碳和硝酸盐,通过硝酸根、碳酸根和碳酸氢根离子的消耗,产生大量的OH-从而提高体系pH.张露等[35]的研究同样发现,栅藻可以将培养基的pH 从3.50 提升至5.50 左右.藻株ZJ1 不同pH的酸性BG-11 培养基中可以将体系pH 提升1.50~2.00 个单位,说明其有较强的pH 提升能力.
由图5 可知,初始低pH 对藻株ZJ1 的Cd 吸附能力产生了一定的抑制效果.研究[36]表明,微藻表面基团对重金属的吸附会受到其他阳离子的影响,而且当环境中的H+浓度较高时会与Cd 竞争吸附位点,影响微藻对Cd 的吸附,因此低pH 条件下,微藻对Cd的吸附率较低.但在初始低pH 条件下培养12 h 后,藻株ZJ1 的Cd 吸附能力迅速恢复,OD680分析结果表明,藻株ZJ1 在培养12 h 后,pH 为4.00 的处理中藻株ZJ1 生长速度恢复,这个过程可能同时伴随着培养体系中OH-的产生[14-15],因此显著提升了体系pH,从而使藻株ZJ1 的Cd 吸附效率快速回升.这一结果说明藻株ZJ1 可以在酸性条件下吸附Cd,并且随着藻株ZJ1 对环境pH 的提升作用,藻株ZJ1 对Cd 的吸附能力可以得到进一步提升.华南水稻土面临土壤酸化和Cd 污染的双重危害,而藻株ZJ1 可以在吸附Cd 的同时提升土壤pH,这使得藻株ZJ1 在改良华南水稻土中具有潜在的应用前景.
3 结论
a) 从华南水稻土中分离得到一株耐酸耐Cd 微藻Parachlorellasp.ZJ1,藻株ZJ1 能耐受的最低pH为3.50,能耐受的Cd 浓度为6.00 mg/L,说明藻株ZJ1具有一定的耐酸耐Cd 能力.藻株ZJ1 在pH 为4.00条件下对Cd 的吸附率能达到56.81%,在较低pH 条件下仍具有较好的Cd 吸附能力,说明藻株ZJ1 可以应用于较低pH 环境的Cd 污染修复.
b) 藻株ZJ1 可以同时去除环境中Cd 并提升环境pH,在改良华南水稻田Cd 污染及土壤酸化中具有潜在的应用前景.

