五味苦参肠溶胶囊减轻小鼠肠道炎症
冯碧燕
广州市第一人民医院,华南理工大学附属第二医院药剂科(广州 510180)
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病(inflammatory bowel disease,IBD)的一种亚型,是一种发病机制尚未完全清楚的肠道非特异性炎症疾病,疾病反复复发与缓解交替,结肠黏膜以连续性、弥漫性炎症为主要特征,患者临床症状主要表现为腹泻、黏液脓血便[1]。目前临床上常用治疗UC的药物主要有氨基水杨酸制剂、糖皮质激素(激素)、生物制剂和免疫抑制剂等。激素依赖、免疫抑制剂的不良反应以及生物制剂价格昂贵等因素限制了其在临床的应用,寻找其他肠道抗炎药物具有重要意义[2]。五味苦参肠溶胶囊,又名复方苦参结肠溶胶囊,由苦参、地榆、青黛、白及和甘草组成,原为院内灌肠剂,可用于轻、中度活动期UC的治疗[3-5]。本研究通过葡聚糖硫酸钠诱导小鼠急性结肠炎,探索五味苦参灌肠液对小鼠肠道炎症及肠道屏障功能的影响。
1 材料与方法
1.1 试剂与仪器
葡聚糖硫酸钠(dextran sulphate sodium,DSS)购自美国的Sigma公司。五味苦参肠溶胶囊(five-flavor sophora flavescens enteric-coated capsules,FSEC),北京中惠药业有限公司,国药准字Z20150002,0.4 g/例。PCR仪(东胜兴业科学仪器有限公司),离心机(长沙湘智离心机仪器有限公司),NanoDrop微量分光光度计(美国ThermoFischer Scientific公司),生物安全柜(上海力康生物医疗科技有限公司)。
1.2 实验动物
6~8周龄无特定病原体(specific pathogen free,SPF)级雄性BALB/c小鼠15只,由广东省医学实验动物中心提供(许可证编号:SCXK 2018-0002)。小鼠饲养在SPF级环境中,遵循昼夜循环节律,维持环境适宜的温度和湿度,室内温度:22~26℃;相对湿度:50%~60%。本研究动物实验方案经广州市第一人民医院动物伦理委员会批准(伦理批件号:K-2019-146-01)。
1.3 实验方法
1.3.1 小鼠急性结肠炎及分组 15只小鼠适应性喂养1周,然后随机分成3组,健康对照组、急性肠炎模型组和五味苦参组,每组5只小鼠。DSS诱导的小鼠肠炎的炎症严重程度与DSS浓度、给药时间和动物种系有关。用BALB/c小鼠根据此文献构建急性结肠炎模型[6]。健康对照组小鼠(正常组)正常饲养,自由饮用灭菌矿泉水;余下2组小鼠自由饮用含3% DSS的灭菌矿泉水7天以诱导急性DSS肠炎模型,在饮用DSS水的同时急性肠炎模型组(DSS+PBS)予磷酸盐缓冲液(phosphate-buffered saline,PBS)灌肠,五味苦参组(DSS+FSEC)用胶囊中五味苦参粉末溶于PBS中制成FSEC灌肠液,终浓度为每只小鼠予含0.728 g/(kg·d)的FSEC灌肠液灌肠。模型组和五味苦参组均予等容量溶液灌肠,均为0.2 mL/d,连续干预7天。药物剂量换算是基于2005年7月美国FDA官网发布了关于“健康成年志愿者首次临床试验药物最大推荐起始剂量的估算指导原则”的文件,采用了体表面积折算法进行动物与人类等效剂量的换算[7]。具体换算如下,按照体表面积法,不同动物与人类之间的换算系数各不相同。人的体质量设为60 kg,小鼠给药剂量约为人的9.1倍。UC患者服用FSEC方式为:0.4 g/粒,每次口服4粒,每日3次,则每天的总剂量为4.8 g/d。则每只小鼠每日给药剂量为4.8(g/d)/ 60 kg×9.1= 0.728 g/(kg·d)。灌肠前予0.5%戊巴比妥钠腹腔注射麻醉小鼠,手指按摩肛门部,用灌肠器轻柔缓慢插入肛门,深度为3 cm时推注0.2 mL灌肠液并倒立2分钟。
1.3.2 观察指标 每天观察并记录小鼠的一般精神状态、体质量、大便性状及血便情况。实验终点(第8天)予1%戊巴比妥钠腹腔注射麻醉小鼠后处死小鼠。收集小鼠肠组织、血清等标本,测量结肠长度,炎症结肠组织多聚甲醛浸泡,随后包埋,进行苏木精-伊红染色(hematoxylin-eosin staining,HE)和组织病理评分,余下结肠组织立即冻存于-80 ℃,后续取部分组织行实时定量PCR。
1.3.2.1 疾病活动度评分 疾病活动度评分(disease activity index,DAI)分为体重减轻程度、大便性状(干燥或稀便)、血便情况(隐血/肉眼血便)。每项最高分为4分,DAI为三项相加,最高分为12分,分数越高代表小鼠肠炎越严重[6]。
1.3.2.2 结肠组织学病理评分 小鼠炎症结肠组织用预冷0.9%氯化钠注射液冲洗2次,取1 cm靠近肛门的直肠组织进行多聚甲醛浸泡24 h,脱水,石蜡包埋,切片及HE染色。请教两名病理科医师分别独立进行组织病理学评分,使用0~3分制来描述炎症的严重程度,将3个参数相加,最高得分为9。评分表见表1。
1.3.2.3 结肠组织炎症因子及屏障因子qPCR检测 使用Trizol试剂从小鼠结肠炎症组织中提取总RNA。严格按照制造商提供的方案,进行定量PCR。引物序列见表2。

表2 引物序列
1.4 统计学方法
所有统计分析均使用SPSS 23.0进行统计学处理和分析。每个分组均重复3~5次,所有数据符合正态分布,结果以(±s)表示,采用两两比较,独立样本t检验分析两组间差异。P<0.05为差异有统计学意义。使用GraphPad Prism 8 绘图软件。
2 结 果
2.1 FSEC灌肠改善小鼠体质量
与健康对照组相比,小鼠自由饮用含3% DSS饮用水后第3天开始出现进食明显减少、体质量下降、懒动,且随着饮用DSS水时间逐渐加重,在第8天体质量降到最低。与PBS灌肠组相比,FSEC灌肠组小鼠体质量下降不如PBS组明显,FSEC灌肠在第6、7、8天中有明显改善小鼠体质量下降趋势,且差异有统计学意义。见图1。

图1 体质量变化情况
2.2 FSEC灌肠减轻小鼠DAI评分
与健康对照组相比,小鼠自由饮用含3% DSS饮用水后第3天开始出现稀便、体质量减轻、进食减少,随着时间延长,小鼠出现精神萎靡、懒动,进食明显减少,逐渐出现水样便,甚至血便,体质量出现断崖式下降。与PBS灌肠组相比较,从第3天开始FSEC灌肠组DAI评分低于PBS灌肠组,第6、7、8天FSEC灌肠组DAI评分降低尤为显著,且第3天到第8天DAI评分下降均差异有统计学意义。见图2。

图2 DAI评分
2.3 FSEC灌肠改善小鼠结肠长度
正常组小鼠平均结肠长度为9.50 cm,PBS灌肠组小鼠平均结肠长度为6.73 cm,与健康对照组相比,饮用DSS饮用水7天后的小鼠结肠长度明显缩短。FSEC灌肠可一定程度改善结肠缩短,予7天FSEC灌肠小鼠平均结肠长度为7.45 cm,但比较差异未见有统计学意义。结肠长度大体图见图3A,结肠长度统计柱状图见图3B。
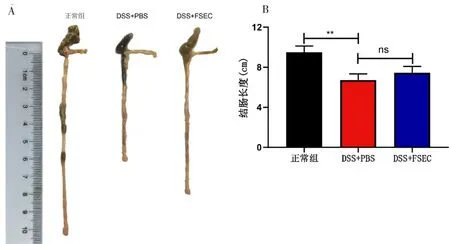
图3 结肠长度
2.4 FSEC灌肠改善小鼠组织学表现
小鼠结肠组织HE染色镜下观察,正常组小鼠结肠组织黏膜上皮层完整,腺体排列整齐,可见散在分泌黏蛋白的杯状细胞。DSS模型组镜下可见黏膜上皮层完整性破坏,杯状细胞明显减少甚至消失,腺体结构破坏,隐窝脓肿,黏膜固有层和黏膜下层较多炎症细胞浸润。FSEC组可明显改善结肠组织病理学表现,黏膜上皮部分恢复,杯状细胞数量明显多于PBS组,腺体及隐窝结构部分恢复,炎症细胞数量及浸润范围减少。小鼠组织学评分可观察到FSEC组分数明显低于PBS灌肠组,见图4。

图4 结肠HE染色(100X)
2.5 FSEC灌肠减轻小鼠结肠炎症
小鼠结肠炎症组织充分研磨后提取总RNA,进行qPCR检测。结果发现急性肠炎模型组结肠组织IL-1β的mRNA相对表达高于正常组,给予FSEC灌肠治疗7天后,炎症因子mRNA相对表达量下降。IL-6和TNF-α相对表达量在各组中变化趋势一致。见图5。简而言之,FSEC灌肠可降低小鼠结肠炎症因子表达。

图5 qPCR结果——炎症细胞因子
2.6 FSEC灌肠有利于小鼠结肠上皮屏障恢复
结肠上皮细胞紧密连接蛋白Occludin和ZO-1的表达是检测上皮屏障功能的重要指标[8-10]。我们通过检测结肠组织Occludin和ZO-1 mRNA的相对表达量,进一步评估FSEC灌肠对结肠上皮屏障的影响。观察到3% DSS肠炎组小鼠结肠组织Occludin和ZO-1 mRNA的相对表达量明显少于健康对照组,FSEC灌肠能明显增加结肠组织Occludin和ZO-1 mRNA的相对水平。见图6。
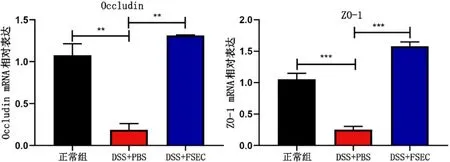
图6 qPCR结果——屏障因子
3 讨 论
IBD的发病机制很复杂,尚不明确。目前普遍达成一致的意见是IBD被认为是遗传易感、某种环境、微生物、肠道屏障破坏以及免疫紊乱在易感宿主中相互作用,最终导致肠道非特异性肠道炎症的结果[11-14]。临床上常用药物治疗如水杨酸制剂、激素等效果有限,长期服用也可能出现消化道出血、股骨头坏死等不良反应。尽管生物制剂的出现使疗效提高[15],展现了较好的前景,然而抗 TNF-α单克隆抗体,抗 IL-12 和 IL-23 生物制剂,以及靶向NF-κB治疗等价格高昂,并非大部分患者的经济能力所能长期获取。反复复发、迁延不愈的疾病,严重影响患者生活质量的疾病,探索其他药物治疗的需求呼之欲出。从中医辨证角度,UC临床中常见类型是大肠湿热型,又称湿热内蕴型UC。五味苦参肠溶胶囊为中药复合制剂,由5种中药组成,具有清热燥湿,凉血止血,适应证为腹泻、黏液脓血便、腹痛等。其治疗轻、中度活动期UC的疗效与美沙拉嗪相当[16-18]。基于国内外前期研究背景,本研究选用五味苦参肠溶胶囊灌肠液治疗实验性小鼠结肠炎,能有效减轻小鼠结肠炎和改善肠道屏障功能,为五味苦参肠溶胶囊的临床用药提供理论基础及数据支撑。
之前已有研究探讨五味苦参肠溶胶囊口服治疗UC的疗效研究,两项研究均为复方苦参肠溶胶囊联合美沙拉嗪 vs 美沙拉嗪单用治疗UC的疗效研究,焦英伟等[4]观察到其有效率为95% vs 81%(P<0.05);另一项研究刁凌云等[19]发现其总有效率有95% vs 75%(P<0.05)。赵军[17]则单用复方苦参肠溶胶囊治疗UC,结果发现与美沙拉嗪相比,单用复方苦参肠溶胶囊能有效改善UC患者湿热内蕴证,总有效率为95% vs 86.67%。以上结果表明口服复方苦参肠溶胶囊在治疗UC中的积极作用。考虑到对于病变局限于远端结肠甚至直肠的UC患者,药物灌肠直接作用于病灶的疗效会明显优于口服药物。在此背景下,本研究针对五味中药复合物灌肠液即五味苦参灌肠液对小鼠肠炎的疗效研究。
尽管罗丹[20-21]的研究探讨了五味苦参肠溶胶囊灌肠液对结肠炎小鼠的影响,其主要结果集中在小鼠结肠组织中视黄酸受体相关孤儿受体γt(RORγt)、IL-17、Caspase-1、IL-1β等的蛋白水平。然而,本研究五味苦参肠溶胶囊灌肠液治疗小鼠急性肠炎效果显著,主要表现在以下几个方面。首先从大体上,观察到五味苦参肠溶胶囊可改善小鼠的体质量,腹泻、便血的次数,降低了DAI,有利于改善小鼠结肠缩短。进一步从组织学层面观察五味苦参肠溶胶囊对小鼠结肠的影响,结果显示五味苦参肠溶胶囊有利于结肠上皮细胞屏障修复,增加了杯状细胞数量,一定程度修复隐窝结构,并减少了炎症细胞浸润。随后从RNA层面定量检测小鼠结肠组织炎症因子及屏障因子的表达,结果也证实了五味苦参肠溶胶囊治疗明显降低几种炎症因子,如IL-1β、IL-6和TNF-α的相对表达,增加了屏障因子Occludin和ZO-1 mRNA的相对表达量(图5-6)。总之,本研究相较于其他已有文献,优势在于从组织病理学、RNA水平评估五味苦参肠溶胶囊灌肠液治疗小鼠急性肠炎的疗效,包括降低炎症因子及增加肠道屏障因子两个方面起作用。
目前国内外大量研究发现肠道炎症是IBD的常见表型,先天性免疫和适应性免疫通过多种机制参与IBD的发病,促炎细胞因子与抗炎细胞因子之间免疫失衡是IBD的机制之一[22]。在活动期UC患者的肠组织中,观察到炎性细胞,如巨噬细胞、T淋巴细胞等在肠黏膜中聚集,导致炎症因子IL-1β、IL-6和TNF-α分泌增加,增加的促炎细胞因子进一步加剧了肠道炎症以及肠黏膜屏障的破坏[23]。本研究用五味苦参肠溶胶囊灌肠液治疗急性肠炎的相关机制可能在一定程度上抑制了过激的免疫反应,导致促炎细胞因子表达减少,减缓肠屏障的损害,一定程度改善了肠道黏膜免疫和有利于肠道屏障功能修复。综上所述,五味苦参肠溶胶囊灌肠可减轻DSS诱导的小鼠急性结肠炎。

