低温等离子体协同磷化镍催化甲烷干重整反应性能
王 荣,徐 波,郑兆宇,王安杰,刘颖雅,孙志超,王 瑶
(大连理工大学 精细化工国家重点实验室,辽宁 大连 116024)
甲烷干重整(DRM)作为一种高效的CH4/CO2转化技术,可同时将2种温室气体CH4和CO2转化为合成气(H2/CO混合气),进而转化为化工原料或液体燃料,既实现了CH4高附加值利用,又能减少CO2排放,可助力中国“碳达峰、碳中和”目标的实现。
CH4和CO2的热力学性质稳定,CH4的C—H键平均键能为415 kJ/mol,CO2的C=O键的解离能高达526 kJ/mol[1],因此,传统热法DRM反应(式(1))需要在高温(>700 ℃)下进行[2]。然而过高的反应温度会导致金属催化剂烧结,也会引发副反应CH4热解反应(式(2))和CO歧化反应(式(3))[2-3],在催化剂表面积碳,覆盖催化活性相中心,导致催化活性降低甚至失活。
CH4+CO2→2CO+2H2
(1)
CH4→C+2H2
(2)
2CO→C+CO2
(3)
低温等离子体技术可在外加高压电场条件下激发放电区的气体分子,促使分子发生解离活化,转化为高活性的粒子,有利于促进化学反应,其所产生的高能电子(平均能量为1~10 eV)[4],可以在常温下有效解离CH4的C—H键(解离能4.5 eV)和CO2的C=O键(解离能5.5 eV),并且等离子体的非平衡特性可以打破CH4/CO2干重整反应热力学平衡限制。杜军等[5]利用介质阻挡放电等离子体技术在室温及无催化剂条件下将CO2分子活化,经加氢制备出CH3OH。黑雪婷等[6]以CH4和CH3OH为原料,采用纳秒脉冲放电等离子体,在低温条件下实现CH4-CH3OH直接反应制C2~C4液态产品。可见,等离子体技术可实现低温下解离活化CH4和CO2。在等离子体中进行DRM反应时,有望提高反应效率,同时可解决传统热法DRM催化剂积炭和烧结问题[7-8]。在各种低温等离子体产生的方式中,介质阻挡放电(DBD)非热等离子技术因其设备简单、操作方便、供能效率高等优点而倍受关注。然而将等离子体技术单独应用于DRM反应,目标产物的选择性低,原料气的转化率不高,能量效率较低。
低温等离子体技术与催化剂协同催化可有效解决上述技术问题。已有研究表明,高活性催化剂的应用可显著提升DBD等离子体协同催化DRM反应的CO2/CH4转化效率和能量利用率。一方面,在低温等离子体放电区域中加入固体催化剂颗粒会增强等离子体放电电场,促进反应活性物质的产生;另一方面,等离子体产生的活性物质也可以改变催化剂的表面反应。Lu等[9]在DBD反应器中研究了等离子体与催化剂协同催化DRM反应,结果表明,DBD等离子体与g-C3N4基催化剂协同作用后,CH4和CO2的转化率及H2和CO的产率均高于单独等离子体反应体系。非贵金属Ni基催化剂常被应用于DBD等离子体协同催化DRM反应当中[10-11]。Mei等[12]利用Ni/γ-Al2O3催化剂,在等离子体输入功率60 W时,CO2和CH4的转化率分别达到48.1%和31.7%,能量利用率为1.75 mmol/kJ。Khoja等[13]以Ni/Al2O3-MgO为催化剂,当等离子体高输入功率为100 W时,CO2和CH4的转化率分别达到73%和74.5%,能量利用率0.117 mmol/kJ。尽管DBD等离子体与Ni基催化剂协同,显著降低了DRM反应温度,但仍存在反应物转化率不够高,能量利用率低的问题。
相较于单质Ni,磷化镍(NixP)具有更高的化学活性[14-15]。近年来,NixP催化剂被陆续应用于热催化DRM反应中。Gonzlez-Castao等[16]用不同载体负载Ni2P用于DRM反应,当反应温度为700 ℃时,CH4和CO2转化率均超过80%。但由于Ni2P相在反应过程中被氧化,催化剂在反应10 h后失活。笔者所在课题组在前期研究Ni2P水相加氢脱氧反应时发现,在适宜水热条件下,Ni2P发生转晶,在高温下稳定为Ni3P,得到的Ni3P具有较高的低温加氢活性和稳定性[17]。这一现象表明,相较于其他类NixP活性相,Ni3P不仅具有较高的催化活性,还具有独特的耐氧化特性,可在具有CO2气氛中有效保持Ni3P活性晶相的稳定。
因此,采用化学镀方法制备Ni3P/SiO2催化剂,在低温等离子体条件下协同催化DRM反应,旨在克服传统Ni基催化剂的低活性以及NixP催化剂的低稳定性问题。将制备的Ni3P/SiO2与传统浸渍法制备的Ni/SiO2催化活性进行对比,考察Ni负载量、氢气还原温度、时间以及等离子体输入功率、进料气体积比对DRM反应性能的影响。
1 实验部分
1.1 原料和试剂
二氧化硅(A-380),工业级,由赢创工业公司提供;六水合硝酸镍(Ni(NO3)2·6H2O)、一水合次亚磷酸钠(NaH2PO2·H2O)、无水乙酸钠(CH3COONa,简称NaAc)、冰醋酸(CH3COOH,简称HAc)、硝酸(HNO3)、尿素(CH4N2O),均为分析纯,国药集团化学试剂有限公司生产;二氧化碳(体积分数>99.99%)、甲烷(体积分数>99.99%)、氢气(体积分数>99.99%)、氧/氩混合气(氧气体积分数0.5%),由大连化学物理研究所提供;实验用去离子水,由大连理工大学纯水系统提供。
1.2 催化剂制备
采用化学镀法制备催化剂,以Ni负载量(质量分数,下同)15%的Ni3P/SiO2催化剂为例,具体步骤如下:
沉积沉淀法(DP)制备Ni前体:将2.62 g Ni(NO3)2·6H2O溶于300 mL去离子水中,形成溶液A。在三口烧瓶中加入3.67 g载体SiO2和240 mL溶液A,不断搅拌加热至70 ℃,形成悬浮液B。在剩余的60 mL溶液A中加入7.56 g尿素和0.56 g浓硝酸形成溶液C,在70 ℃下将溶液C缓慢加入到悬浮液B中,然后加热至90 ℃,沉积沉淀16 h,用去离子水清洗至中性后,110 ℃干燥过夜,制得催化剂前体D。
化学镀法制备Ni3P/SiO2:将4.613 g NaAc和0.6 g HAc溶于100 mL去离子水中,制得pH=5.5的NaAc-HAc缓冲溶液,放入三口烧瓶中,加入9.55 g NaH2PO2·H2O并恒定搅拌加热至90 ℃。向烧瓶中缓慢加入催化剂前体D,待溶液停止冒气泡时化学镀结束。用去离子水洗至中性、干燥,在H2气氛中400 ℃还原2 h。所得催化剂记为Ni3P/SiO2。
后续制备Ni负载量分别为10%、20%、25%的Ni3P/SiO2催化剂时,仅在沉积沉淀法制备Ni前体中将载体SiO2质量分别改变为5.28、2.64、2.11 g,其他步骤同上。
浸渍法制备Ni/SiO2(质量分数15%):将2.62 g硝酸镍配成溶液,滴加到3.67 g SiO2粉末上。在室温下老化24 h,然后在110 ℃下干燥12 h,于马弗炉500 ℃焙烧5 h(升温速率5 ℃/min)。在H2气氛中500 ℃还原2 h,所得催化剂记为Ni/SiO2。
1.3 催化剂表征
采用Rigaku D/Max 2400型X射线衍射仪测定XRD谱图,使用CuKα放射源,管电压45 kV,管电流200 mA,扫描速率10 °/min,扫描范围5°~90°。采用Micrometritics Tristar Ⅱ 3020在-196 ℃下测定催化剂的N2吸附-脱附曲线,分别以BET和BHJ理论计算催化剂比表面积、孔径和孔体积。在Multilab 2000型X射线光电子分光仪上测定催化剂的XPS表征,光源为Al Kα,以C 1s的结合能(284.6 eV)为基准校准不同元素的电子结合能。采用Tecanai G2 F30 透射电子显微镜在200 kV测试催化剂微观形貌。CO2-TPD是在Chembet-3000分析仪上测定。在测量之前,将0.1 g钝化的Ni3P/SiO2或Ni/SiO2样品分别在400和500 ℃的H2中重新还原0.5 h,然后冷却到30 ℃后吸附CO2至饱和,再用Ar气吹扫20 min,除去物理吸附的CO2,然后以10 ℃/min的升温速率从30 ℃升温至600 ℃,记录CO2-TPD曲线。
1.4 催化剂活性评价
催化剂性能评价在介质阻挡放电等离子体反应装置上进行,实验装置示意图如图1所示。由图1可知,装置由4部分组成:进气系统、高频交流电源、DBD反应器和产物分析系统。DBD反应器由1个石英管(内径8 mm,外径10 mm)用作介质层,使用不锈钢棒(外径3 mm)作为高压电极,高压电极总长度23 cm,并与石英管同轴设置,石英管外部由高度为2.5 cm铁丝缠绕的铝箔作为接地电极,放电间隙2.5 mm,放电区域体积约为1.2 mL。反应放电间隙用石英砂稀释的0.2 g催化剂颗粒填充。使用示波器(UTD2101CEX)测试等离子体输出功率,其值可以通过改变外加电压来控制。在实验中放电频率固定在9.8 kHz。
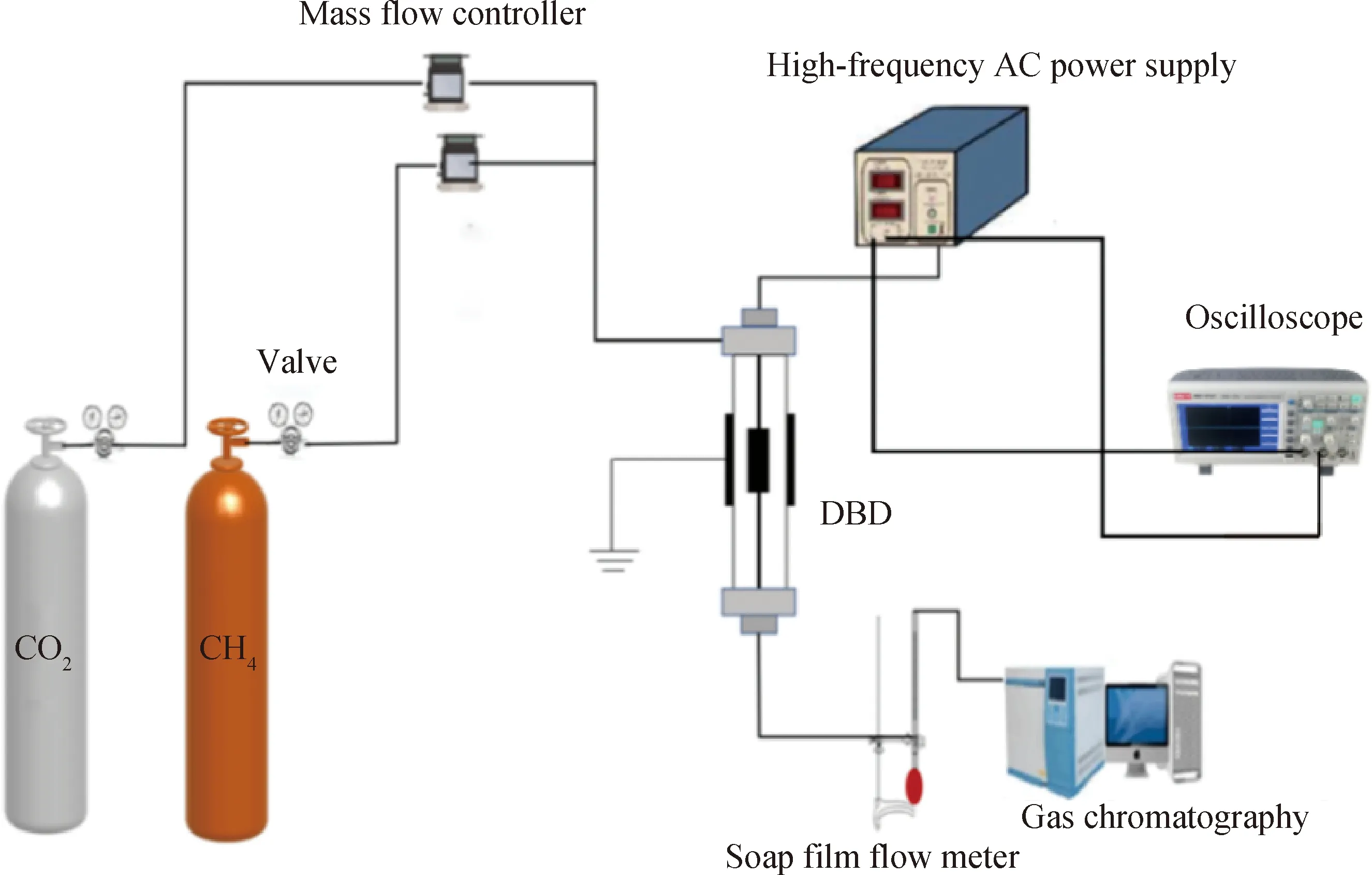
DBD—Dielectric barrier discharge图1 甲烷干重整反应装置图Fig.1 Schematic diagram of methane dry reforming reaction setup
CH4和CO2体积流量用质量流量控制器控制为25 mL/min,CH4/CO2进气体积比为1。用气相色谱仪(GC 7890T)和TCD检测器(配备2 m TDX-01柱)分析产物组成。用皂泡流量计测量反应后气体流速,并结合气相色谱峰面积分析确定各气体组分的浓度。当反应达到稳态时,记录实验数据。
CH4和CO2的转化率计算式如式(4)、式(5)所示。
(4)
(5)
H2和CO的选择性计算式如式(6)、式(7)所示。
(6)
(7)
反应过程中能量利用率(η,mmol/kJ)计算式如下,式(8)所示。
(8)
式中:XCH4和XCO2分别表示CH4和CO2转化率,%;SCO和SH2分别表示CO和H2选择性,%;qCH4,in和qCH4,out分别表示反应前和反应后CH4的摩尔流量,mol/s;qCO2,in和qCO2,out分别表示反应前和反应后CO2的摩尔流量,mol/s;η表示反应过程的能量利用率,mmol/kJ;P为等离子体的输出功率,W。
2 结果与讨论
2.1 催化剂表征
Ni/SiO2和Ni3P/SiO2的XRD谱图如图2所示。由图2可知,Ni/SiO2和Ni3P/SiO2在2θ约为23°处均出现归属于无定形SiO2的特征峰[18]。Ni/SiO2在2θ为44.5°、51.8°和76.3°的特征峰归属于Ni的(111)、(200)和(220)晶面,峰形尖锐表明Ni颗粒尺寸较大,结晶度较好[19],说明浸渍法催化剂制备时得到金属Ni。而Ni3P/SiO2未观察到明显的Ni3P特征峰,这可能是由于Ni3P负载量低,且高度分散在SiO2表面,导致其衍射峰强度较弱造成的[20]。
Ni/SiO2和Ni3P/SiO2催化剂的XPS表征结果如图3所示。从图3(a)可以看出,Ni/SiO2在852.8和856 eV处出现了信号峰,其中852.8 eV处信号峰归属于金属Ni0,856 eV处信号峰归属于Ni2+[21]。Ni3P/SiO2在853.4和856.4 eV处分别出现归属于Niδ+(0<δ<2)[22]和Ni2+的信号峰[21]。在图3(b)中,Ni/SiO2中未检测到归属于P的2p信号峰;而Ni3P/SiO2在129.2和133.4 eV处的信号峰分别归属于Pδ-和氧化态的P(P5+或P3+)[23]。氧化态的Ni2+、P5+或P3+是由于Ni/SiO2和Ni3P/SiO2在钝化过程中其表面被氧化所致。Ni3P/SiO2中Niδ+(0<δ<2)和Pδ-信号峰表明得到了Ni3P物相。此外,由图3(a)可见,与Ni/SiO2相比,在Ni3P结构中P原子存在强烈的配位效应,导致Ni的外层电子云显著向P原子偏移,从而形成缺电子态的Ni原子——Niδ+,即Ni3P/SiO2中Ni元素电子结合能增大。

图3 Ni3P/SiO2和Ni/SiO2 X-射线光电子能谱图Fig.3 XPS spectra of Ni3P/SiO2 and Ni/SiO2 catalysts(a)Ni 2p;(b)P 2p
Ni/SiO2和Ni3P/SiO2催化剂的TEM及HRTEM表征结果如图4所示,其粒径分布分别见图4(a)和图4(b)。与Ni/SiO2相比,Ni3P/SiO2粒度分布窄,且粒径较小,这与XRD的结果一致。由图4(c)中可观察到属于Ni3P的晶格条纹,晶面间距约为0.200 nm,对应于Ni3P的(240)晶面。

图4 Ni/SiO2和Ni3P/SiO2的TEM和HRTEM表征Fig.4 TEM and HRTEM characterization of Ni/SiO2 and Ni3P/SiO2(a)TEM image of Ni/SiO2;(b),(c)TEM and HRTEM images of Ni3P/SiO2;(d)Particle size distribution of Ni/SiO2;(e)Particle size distribution of Ni3P/SiO2
Ni3P/SiO2和Ni/SiO2的N2物理吸附-脱附等温线及其孔径分布如图5所示。从图5可知,Ni3P/SiO2和Ni/SiO2吸附-脱附等温线均呈现出H4型滞回形状,这是介孔材料的典型特征[24]。表1 是Ni3P/SiO2和Ni/SiO2催化剂分别以BET和BHJ理论计算所得催化剂的比表面积、孔径、孔体积。从表1可以看出,Ni3P/SiO2的比表面积及孔体积均比Ni/SiO2的高,这可能是因为Ni3P在SiO2表面分散更好。

表1 Ni3P/SiO2和Ni/SiO2结构性质Table 1 Structural properties of Ni3P/SiO2 and Ni/SiO2

图5 Ni3P/SiO2和Ni/SiO2N2物理吸附-脱附等温线Fig.5 N2 adsorption-desorption isotherms of Ni3P/SiO2 and Ni/SiO2N2
Ni3P/SiO2和Ni/SiO2的CO2-TPD结果如图6所示。从图6可以看出,Ni3P/SiO2在80~140 ℃和300~450 ℃之间有2个CO2脱附峰,而Ni/SiO2仅在80~140 ℃出现很弱的CO2脱附峰,这表明,相较于Ni/SiO2,Ni3P/SiO2具有更强的CO2的吸附能力。结合XPS表征可知,Ni3P/SiO2优异的吸附活化CO2分子的能力应得益于P原子所诱导产生的Niδ+位点。

图6 Ni3P/SiO2和Ni/SiO2的CO2-TPD谱图Fig.6 CO2-TPD profiles of Ni3P/SiO2 and Ni/SiO2
2.2 催化剂性能
2.2.1 Ni3P/SiO2和Ni/SiO2催化剂甲烷干重整性能比较
在等离子体功率20 W、体积空速15000 mL/(gcat·h)、VCO2/VCH4为1条件下,对未添加催化剂的纯等离子体以及添加Ni3P/SiO2和Ni/SiO2等离子体进行甲烷重整反应性能评价,结果如图7所示。由图7可见,相较于纯等离子体,催化剂的加入显著提高了DRM反应的CH4及CO2转化率、产物H2和CO选择性以及能量利用率,说明催化剂的存在促进了甲烷干重整反应的正向进行。这是因为将催化剂置于DBD等离子体放电区中,一方面增强了表面电场,反应区内粒子运动速率加快,CH4易于解离生成碳氢自由基(CH3*、CH2*、CH*)和氢自由基(H*),CO2易于解离为碳氧自由基(CO*)和活性氧(O*),生成的活性自由基会吸附在催化剂表面,进而反应生成H2和CO;另一方面,等离子体中的高能粒子促进了CH4和CO2在催化剂表面发生解离反应,有利于DRM反应正向进行。由图7(a)可以看出,Ni3P/SiO2对应的CO2和CH4转化率、H2和CO选择性均高于Ni/SiO2。结合表征结果可知,Ni3P/SiO2较高的催化活性可能与其较小的颗粒直径、较大的比表面积和表面较多的Niδ+有关。高分散的Niδ+活性位有利于CO2的吸附和活化,降低反应能垒,提高CO2/CH4转化效率[25]。此外,无论是Ni/SiO2还是Ni3P/SiO2,对应CH4转化率均高于CO2转化率,这是因为CH4的C—H键解离能(4.5 eV)低于CO2的C=O键解离能(5.5 eV),更易被DBD等离子体解离。但Ni3P/SiO2催化的CH4转化率与CO2转化率差值较小,这也说明Ni3P/SiO2对CO2的吸附能力增强,促进了CO2的转化。并且,Ni3P/SiO2对应的CO选择性高于H2选择性,其原因可能是Ni3P/SiO2催化剂有强CO2吸附能力,吸附在催化剂表面的CO2发生DRM反应的同时,也会和H2发生逆水煤气反应(CO2+H2→CO+H2O)生成CO。从图7(b)可以看出,能量利用率由大到小的反应顺序为:Ni3P/SiO2>Ni/SiO2>无催化剂,反应过程中用红外测温枪测得反应管管壁温度均低于200 ℃,而该温度低于热法催化DRM反应的温度。此结果是因为在等离子体条件下,CH4和CO2被高能电子激发、解离为高活性物种,这些活性物种吸附在催化剂表面,进而反应生成H2和CO。此外,催化剂颗粒的填充使放电区的表面电场增强,有利于活性物种的形成,从而提高能量利用率。与Ni/SiO2相比,Ni3P/SiO2吸附活化CH4和CO2的活性更高,因而反应物转化率和能量利用率更高。

图7 催化剂与DBD等离子体协同催化甲烷干重整反应性能Fig.7 Performance of dry reforming of methane catalyzed by catalyst and DBD plasma (a)Conversion (X)and selectivity (S);(b)Energy efficiency (η)Conditions:0.2 g catalyst mixed quartz sand was packed in a 2.5 cm discharge range;Discharge power 20 W;Total flow rate 50 mL/min;Gaseous hourly space velocity 15000 mL/(gcat·h);VCO2/VCH4 =1
2.2.2 Ni3P/SiO2和Ni/SiO2稳定性
在等离子体功率18 W、体积空速15000 mL/(gcat·h)、VCO2/VCH4为1条件下,考察Ni3P/SiO2和Ni/SiO2稳定性,结果如图8所示。
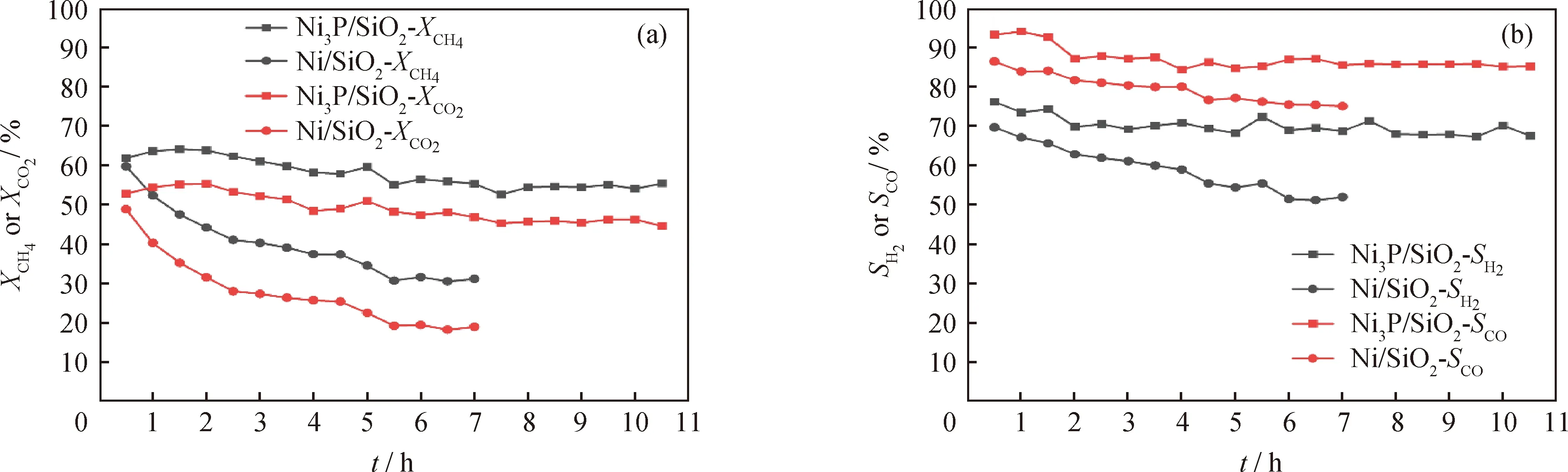
图8 Ni3P/SiO2和Ni/SiO2甲烷干重整稳定性Fig.8 Stability of Ni3P/SiO2 and Ni/SiO2 in methane dry reforming(a)Conversion (X)of CH4 and CO2;(b)Selectivity (S)of H2 and CO conditions:0.2 g catalyst mixed quartz sand was packed in a 2.5 cm discharge range;Discharge power 18 W;Total flow rate 50 mL/min;Gaseous hourly space velocity 15000 mL/(gcat·h);VCO2/VCH4=1
从图8可以看出,反应7 h内Ni/SiO2有明显失活,其CH4和CO2转化率分别从59.7%和48.8%下降到35.5%和18.3%,H2和CO选择性分别从69.7%和86.5%下降到51.9%和75.1%。而相较于Ni/SiO2催化剂,Ni3P/SiO2具有较高的稳定性。在10 h反应时间内,CH4和CO2转化率及H2和CO选择性基本稳定,没有明显下降。结合CO2-TPD表征可知,造成这一现象的原因是Ni3P/SiO2具有更强的CO2吸附性能,其表面可富集大量活性氧化物种,例如CO2*、O*等,并与CH4中间体进行反应,避免CHx*键合积碳,并且Ni3P/SiO2中,由于P的存在增加了Ni原子的分散度,因而表现出更好的抗积碳能力。
利用TG分析反应后Ni/SiO2和Ni3P/SiO2催化剂的积炭量,结果如图9所示。由图9可知,Ni/SiO2和Ni3P/SiO2均在450~700 ℃下发生质量损失,可归因于催化剂上沉积的碳的氧化。Ni/SiO2和Ni3P/SiO2催化剂活性下降的主要原因是沉积的碳覆盖了催化活性中心。根据TG曲线计算的Ni/SiO2和Ni3P/SiO2质量损失分别为68.1%和12.7%,由此可见Ni3P/SiO2催化剂抗积碳能力较强。
如今,城市高层建筑越来越多,其沉降引起的变形问题是一个值得关注的重点。对变形监测资料进行处理,建立数学模型进行预测分析,不同的模型有各自优缺点,但在众多模型中,灰色模型在沉降预测中有着独到之处[4]。针对传统GM(1,1)模型预测精度不高的情况,本文利用残差值进行修正,建立了残差GM(1,1)预测模型。通过实例分析发现,改进后的残差模型相比传统GM(1,1)模型,精度上有了更大的提高,预测结果更贴近真实值。因此,建立残差灰色模型对于判断建筑物的沉降变形,预测其沉降趋势有一定的意义。
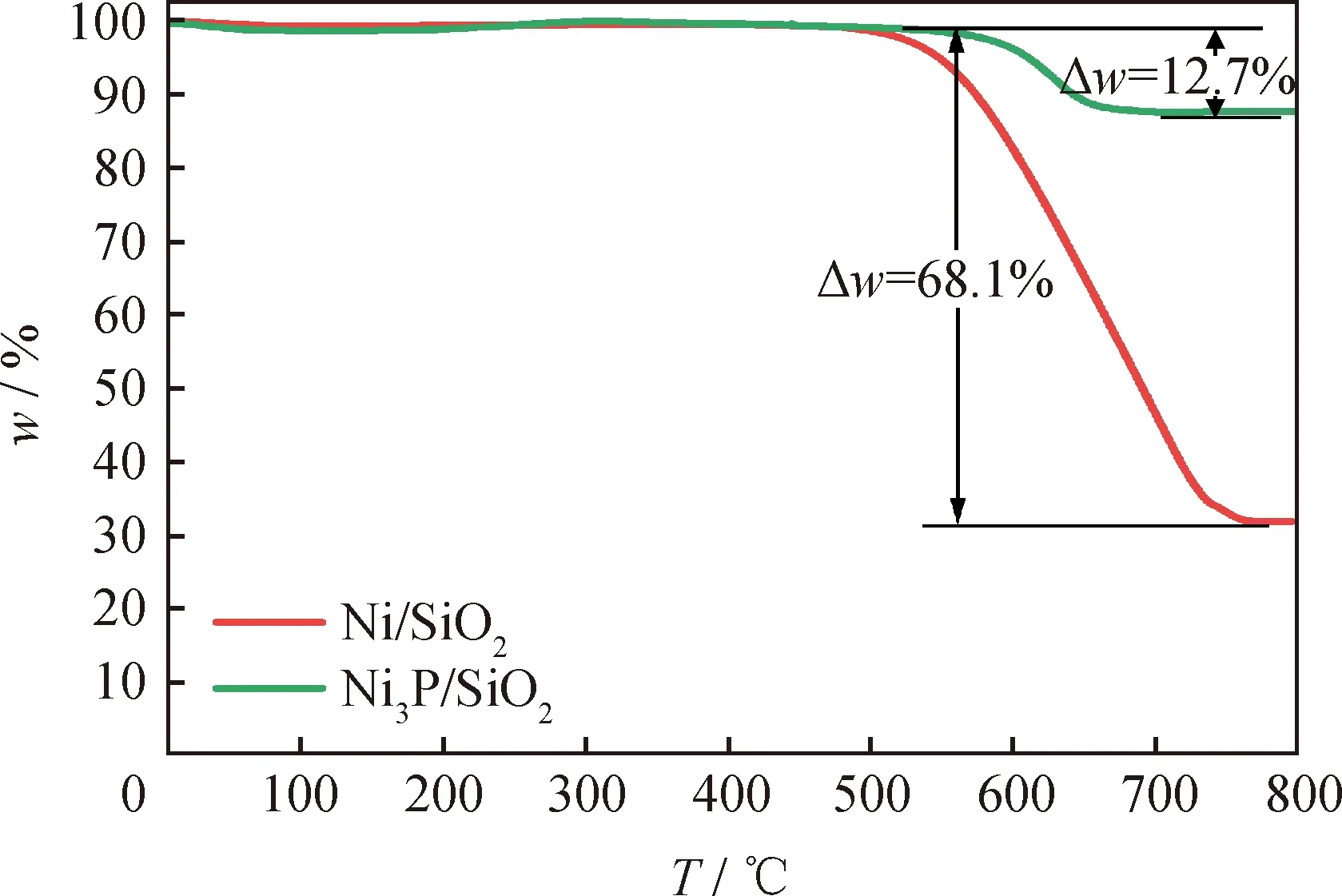
图9 反应后Ni/SiO2和Ni3P/SiO2催化剂的TG结果Fig.9 TG results of Ni/SiO2 and Ni3P/SiO2 catalysts after reaction
以上实验结果表明,Ni3P/SiO2作为DBD等离子体协同催化DRM反应催化剂,其反应物转化率和能量利用率均优于Ni/SiO2,且抗积碳能力较强。
2.3 Ni3P/SiO2制备条件优化
2.3.1 Ni负载量
Ni负载量对DBD等离子体协同Ni3P/SiO2催化DRM反应性能影响如图10所示。由图10可以看出,随着Ni负载量增加,CH4和CO2转化率先升高后降低,但产物选择性变化不大。当Ni负载量由10%增加至15%时,Ni3P/SiO2催化剂的活性位点增多,CH4和CO2转化率上升;而当Ni负载量增加至25%时,造成催化剂部分孔道堵塞和扩散阻力增大,降低了催化活性[26]。产物选择性随Ni负载量变化不大,说明Ni负载量不同,催化剂表面活性相均为Ni3P相,而活性相数量不同。
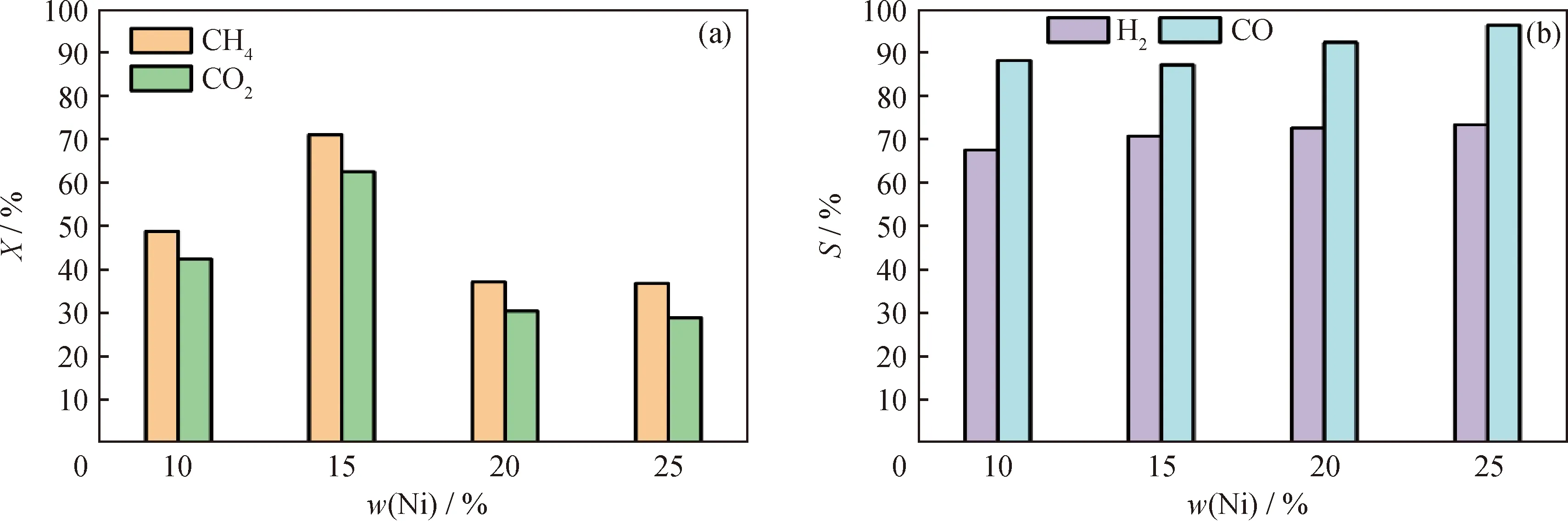
图10 Ni负载量对Ni3P/SiO2催化性能的影响Fig.10 Effect of Ni content on catalytic performance of Ni3P/SiO2(a)Conversion (X)of CH4 and CO2;(b)Selectivity (S)of H2 and COConditions:0.2 g catalyst mixed quartz sand was packed in a 2.5 cm discharge range;discharge power 20 W;Total flow rate 50 mL/min;Gaseous hourly space velocity 15000 mL/(gcat·h);VCO2/VCH4 =1
2.3.2 H2还原温度和还原时间
文献[27]研究表明,H2还原温度影响磷化物催化剂的颗粒大小,进而影响其催化性能。故在H2还原时间为2 h条件下,考察H2还原温度(300、400、500、600 ℃)对Ni3P/SiO2催化CH4/CO2干重整性能的影响,如图11所示。从图11(a)可以看出,400 ℃时H2还原所得的催化剂DRM反应转化率最优。而从图11(b)可以看出:H2还原温度低于600 ℃时,所得催化剂的产物选择性相差不大;但当H2还原温度达到600 ℃时,Ni3P/SiO2的产物选择性略有降低。这是因为H2还原温度较低(<300 ℃)时,H2还原反应速率低,得到的Ni3P活性相数量少,因此催化剂的活性低;随还原温度升高,Ni3P活性相数量增加;而当还原温度达到600 ℃,金属磷化物颗粒尺寸因高温团聚而增大,并且高温易造成催化剂孔道坍塌,降低催化剂的比表面积[26-27],导致催化活性降低。在300~500 ℃下还原制得的催化剂上,产物选择性差异很小,说明催化活性相相同,均为Ni3P相;在600 ℃还原制备的催化剂,H2及CO选择性降低,可能是因为催化剂因高温导致Ni3P颗粒团聚或者优先暴露晶面发生变化导致的。
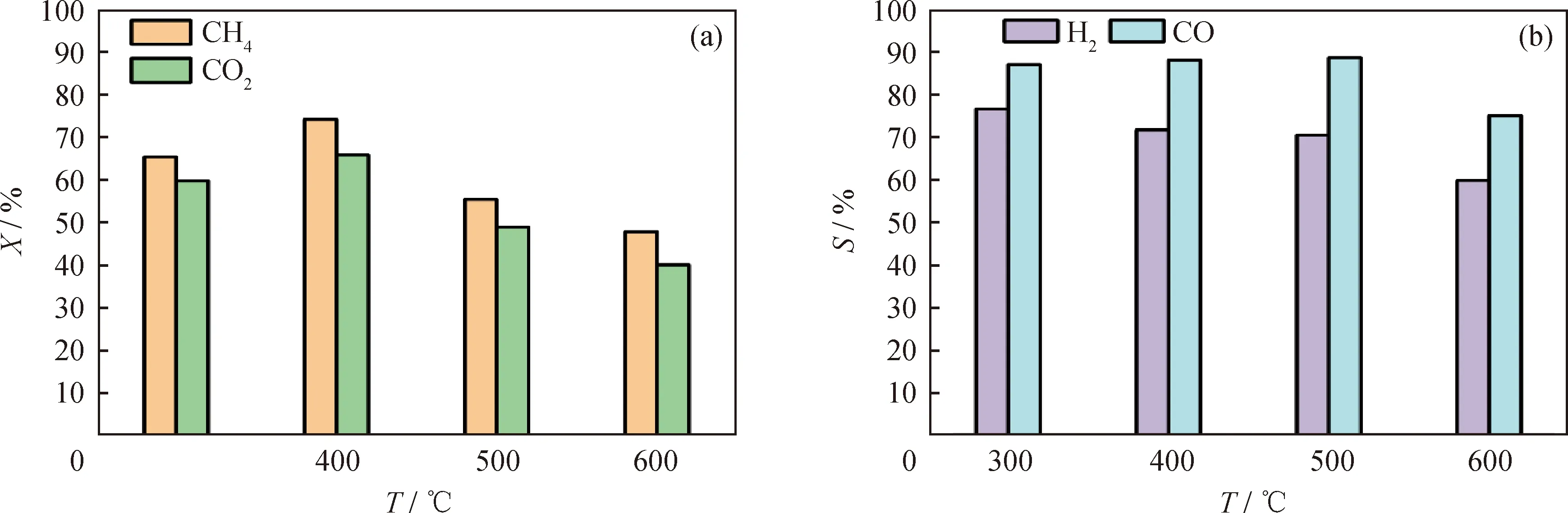
图11 H2还原温度对Ni3P/SiO2催化性能的影响Fig.11 Effect of hydrogen reduction temperature on catalytic performance of Ni3P/SiO2(a)Conversion (X)of CH4 and CO2;(b)Selectivity (S)of H2 and COConditions:0.2 g catalyst mixed quartz sand was packed in a 2.5 cm discharge range;Discharge power 20 W;Total flow rate 50 mL/min;Gaseous hourly space velocity 15000 mL/(gcat·h);VCO2/VCH4=1
当H2还原温度为400 ℃时,考察H2还原时间对Ni3P/SiO2催化性能的影响如图12所示。由图12可见,随着H2还原时间延长,CH4和CO2的转化率以及产物H2和CO选择性基本不变。当还原时间为0.5 h时,可合成出Ni3P活性相;而当还原时间过长(3 h)时,高温可能导致Ni3P晶粒烧结,使Ni3P/SiO2催化活性降低。综合考虑反应物转化率和产物选择性,制备Ni3P/SiO2催化剂的最佳H2还原时间为2 h。
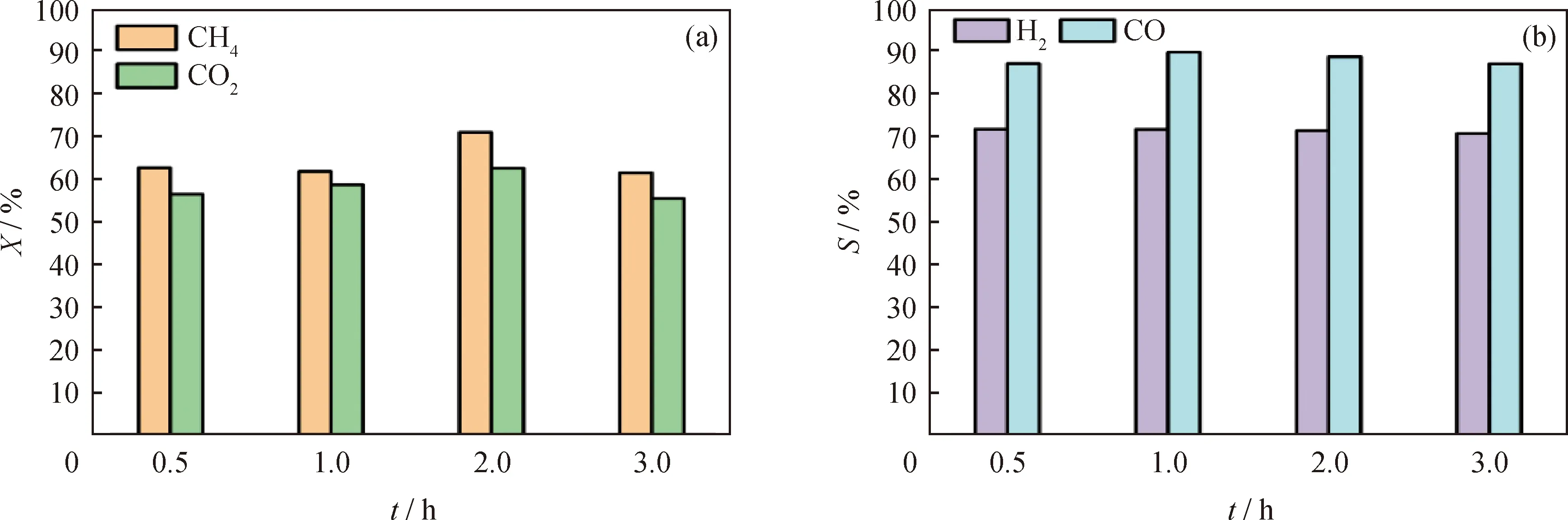
图12 400 ℃H2气氛下处理时间对Ni3P/SiO2催化性能的影响Fig.12 Effect of treatment time in hydrogen atmosphere at 400 ℃ on catalytic performance of Ni3P/SiO2(a)Conversion (X)of CH4 and CO2;(b)Selectivity (S)of H2 and COConditions:0.2 g catalyst mixed quartz sand was packed in a 2.5 cm discharge range;Discharge power 20 W;Total flow rate 50 mL/min;Gaseous hourly space velocity 15000 mL/(gcat·h);VCO2/VCH4 =1
2.4 Ni3P/SiO2催化反应条件优化
在体积空速15000 mL/(gcat·h)、VCO2/VCH4为1条件下,考察等离子体输出功率对Ni3P/SiO2催化性能影响,结果如图13所示。由图13可知,随着等离子体输出功率增大,CH4和CO2转化率增加,H2和CO选择性均增大。当功率从8 W增加到20 W时,CH4及CO2转化率分别从4.8%和0.2%增加到74.1%和65.8%,H2和CO选择性分别从5%和0增加到81%和90%。这是因为,功率增加可以增强放电区的电场和电子密度,促进碳氢自由基、碳氧自由基、氢自由基的产生[28],从而提升CH4和CO2转化率以及H2和CO选择性。
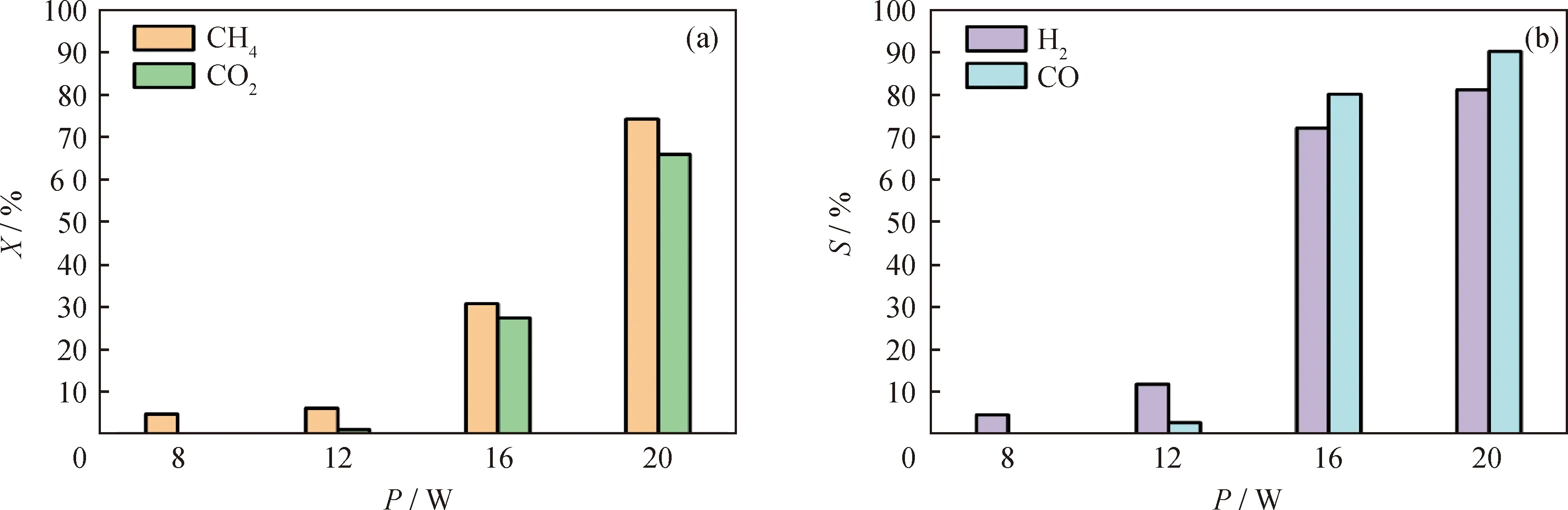
图13 等离子体输出功率对Ni3P/SiO2催化性能的影响Fig.13 Effect of plasma discharge power on catalytic performance of Ni3P/SiO2(a)Conversion (X)of CH4 and CO2;(b)Selectivity (S)of H2 and COConditions:0.2 g catalyst mixed quartz sand was packed in a 2.5 cm discharge range;Total flow rate 50 mL/min;Gaseous hourly space velocity 15000 mL/(gcat·h);VCO2/VCH4=1
2.4.2 进料气中CO2/CH4体积比
在体积空速15000 mL/(gcat·h)、等离子体输出功率20 W条件下,考察进料中CO2/CH4体积比对Ni3P/SiO2催化DRM反应性能影响,结果如图14所示。从图14(a)中可以看出:随着CO2/CH4体积比从1.00增大到1.25,CH4转化率降低;当CO2/CH4体积比大于1.25后,CH4转化率升高;当CO2/CH4体积比为2.00时,CH4转化率超过90%。但CO2转化率随CO2/CH4体积比增大一直降低。从图14(b)可见,随CO2/CH4体积比增大,H2选择性降低,而CO选择性先降低后升高。出现这一结果是因为,DRM是CO2和CH4化学计量比为1.00的反应,进料中CO2含量升高,与其反应的CH4不足,因此CO2转化率随CO2/CH4体积比增大一直降低。当反应气中CO2/CH4体积比从1.00增大到1.25时,过量的CO2会抢占CH4的活性位点,造成CH4转化率下降,CO选择性降低。当CO2/CH4体积比从1.25增加到2.00时,一方面,CO2产生的活性氧物种可以直接和CH4反应生成CO和H2,所以CH4转化率及CO选择性上升;另一方面,过量的CO2会和H2发生逆水煤气反应(CO2+H2→CO+H2O)生成CO,导致H2选择性降低。

图14 反应气CO2/CH4体积比对Ni3P/SiO2催化性能的影响Fig.14 Effect of volume ratio of reaction gas CO2 to CH4 on catalytic performance of Ni3P/SiO2(a)Conversion (X)of CH4 and CO2;(b)Selectivity (S)of H2 and COConditions:0.2 g catalyst mixed quartz sand was packed in a 2.5 cm discharge range;Discharge power 20 W;Total flow rate 50 mL/min;Gaseous hourly space velocity 15000 mL/(gcat·h)
表2将Ni3P/SiO2催化剂制备条件及反应条件优化后的结果与其他相关文献中等离子体和催化剂协同催化DRM反应结果对比。从表2可以看出,Ni3P/SiO2和等离子体协同催化DRM反应在反应物转化率,产物选择性以及能量利用率上展现了优势。高活性与Ni3P较高的分散度和Niδ+活性位点以及CO2的强吸附有关。
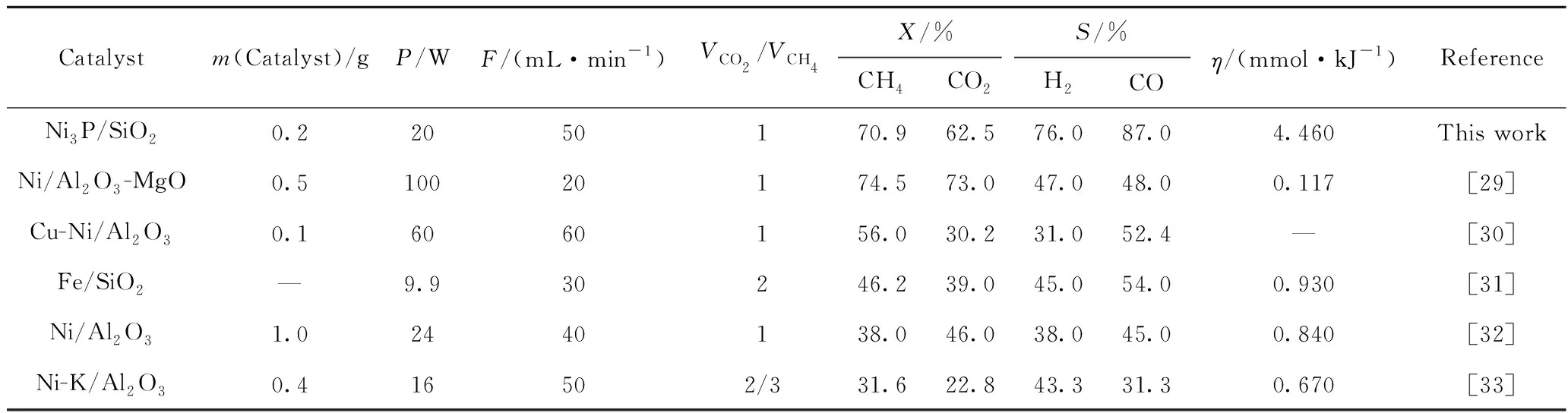
表2 不同催化剂作用下DBD等离子体DRM的实验性能研究对比Table 2 Comparative experimental study on performance of DBD plasma assisted DRM under the action of different catalysts
3 结 论
(1)在介质阻挡放电等离子体中,Ni3P/SiO2和等离子体在低温常压下存在明显的协同作用。纯介质阻挡放电等离子体在输出功率20 W反应条件下CH4、CO2转化率分别为5.6%、0,且未检测到目标产物。Ni3P/SiO2和等离子体协同催化提高了甲烷干重整的反应性能,CH4和CO2转化率分别为70.9%和62.5%,H2和CO选择性分别为76%和87%,能量利用率4.46 mmol/kJ。
(2)化学镀法制备的Ni3P/SiO2与介质阻挡放电等离子体协同催化CH4/CO2干重整性能优于浸渍法制备的Ni/SiO2。Ni3P/SiO2催化剂的高活性和稳定性与Ni3P较高的分散度和催化剂表面较多的Niδ+活性位点以及对CO2的强吸附有关。
(3)催化剂中Ni负载量、氢气还原温度和时间均会影响Ni3P/SiO2的催化活性。当Ni负载量为15%、还原温度为400 ℃、还原时间为2 h时,所制备催化剂的性能最佳。
(4)等离子体输入功率、进料流量和反应气CO2/CH4体积比会影响CH4/CO2干重整性能。优化反应条件为:DBD等离子体输出功率20 W,进料气体积空速15000 mL/(gcat·h),CO2/CH4体积比为1。

