水蒸气添加下介质阻挡放电CO2重整CH4反应研究
张 鹏,梅丹华,孙闵杰,刘诗筠,方 志
(南京工业大学 电气工程与控制科学学院,江苏 南京 211816)
CO2重整CH4反应能够有效降低大气环境中CO2和CH4这两种主要温室气体的浓度,缓解温室效应,并且生成合成气等高品质化工产品,降低对传统化石能源的依赖,在环境保护和能源开发利用等方面具有双重意义[1-2]。但由于CO2和CH4分子的高稳定性,CO2重整CH4反应需要高温高压的反应条件才能获得较为理想的反应效果,能量投入高;在传统的热催化反应中,苛刻的反应条件容易造成催化剂失活,影响反应稳定运行[3-5]。因此,发展可在温和条件下运行的CO2重整CH4反应方法,对于提高该反应的技术经济性并实现规模化应用具有重要意义。
低温等离子体技术作为一种新型有效的分子活化手段,具有易实现、化学反应活性高、能耗低等优势,可以使热力学条件下难以进行的化学反应在温和条件下得以发生,为高效CO2重整CH4反应提供了新的思路[6-9]。低温等离子体反应系统具有快速启停的优势,与传统热催化反应的预热和降温过程相比,具有更高的效率。截至目前,滑动弧放电、介质阻挡放电(Dielectric barrier discharge,DBD)、电晕放电和微波放电等低温等离子体形式被用于CO2重整CH4反应的研究[10]。其中,DBD由于其结构简单、放电稳定、易于工程化放大等优势,并且已经在废气处理等领域实现了成功的规模化应用[11],因而在CO2重整CH4领域受到了广泛地关注。
对于DBD CO2重整CH4反应,目前的研究主要集中在诊断反应过程放电特性、建模仿真微观反应过程、评估反应效果和效率、探索反应机制、调控反应性能等方面[12-15]。研究发现,无论是否添加催化剂,积炭是限制等离子体CO2重整CH4反应进一步发展的主要瓶颈之一。近年来,研究人员发现在等离子体CO2重整CH4反应体系中添加水蒸气能够有效抑制积炭的生成,并且能够调节产物分布。例如,Liu等[16]发现,在等离子体转化甲苯的反应体系中添加水蒸气能够显著改善反应的稳定性,改变甲苯转化路径,减少积炭的生成,提高甲苯转化率、H2和CO等产物的产率以及能量效率。Wang等[17]在DBD等离子体协同催化CO2重整CH4反应系统中添加水蒸气,发现一定量的水蒸气能够同时提高CO2和CH4的转化率,并且和未加水蒸气的工况相比,积炭量明显减少。虽然水蒸气添加能够在一定程度上改善等离子体含碳分子转化反应性能,但是由于水分子具有较强的电负性,过量水蒸气添加将吸附反应体系的高能电子,降低反应性能。针对特定的反应,如何确定最佳的水蒸气含量还需要进一步开展研究。目前,关于水蒸气添加及其含量对DBD CO2重整CH4反应过程放电特性和反应性能的系统性研究还不多,难以指导DBD CO2重整CH4反应过程优化设计与性能提升。鉴于此,笔者在添加水蒸气的情况下开展DBD CO2重整CH4反应研究,考察水/碳摩尔比对反应过程放电特性和反应性能的影响,为后续进一步技术推进奠定基础。
1 实验部分
1.1 原料
CO2、CH4,质量分数均为99.99%,南京特种气体厂股份有限公司产品;去离子水,南京晚晴化玻仪器有限公司产品。
1.2 实验装置及分析方法
图1所示为DBD CO2重整CH4反应的实验装置系统,主要包括反应器、激励电源、电学特性诊断系统、原料配置和输入系统、气相与液相产物收集和检测分析系统。反应器为自行设计的同轴单介质DBD反应器,采用石英玻璃管作为介质材料,其内、外径分别为20 mm和23 mm;采用直径为15 mm的不锈钢棒作为内电极;采用不锈钢网作为外电极,将其紧密缠绕在石英玻璃管外,其长度为100 mm。采用电压幅值和频率分别在0~30 kV、0~20 kHz范围内可调的交流电源作为激励电源,通过改变电压幅值来调节反应器放电功率,放电功率由Lissajous图形方法计算获得,实验过程中放电功率和频率分别固定在55 W和10 kHz;内电极与激励电源高压端相连接,外电极与一个外接电容串联后接地,该外接电容用于测量计算流过放电回路的电荷。采用高压探头(Tektronix P6015A)、电流线圈(Pearson 6585)和差分探头(Pintech N1070A)分别测量输入电压、总电流和外接电容两端的电压,上述信号通过四通道数字示波器(Tektronix TDS2014B)记录和保存。

DBD—Dielectric barrier discharge;GC—Gas chromatography;GC-MS—Gas chromatography-mass spectrometry图1 介质阻挡放电CO2重整CH4实验装置图Fig.1 Diagram of the experimental setup for CH4 reforming with CO2 using dielectric barrier discharge
CO2和CH4由压缩气瓶提供,通过质量流量计(北京七星华创流量计有限公司产品,MFC D07-19型)调节其流量,实验过程中流量(L)均固定在50 mL/min;采用注射泵将去离子水注入气体管路,由反应气流带入反应器,采用加热带将注入水后的管路加热保温至110 ℃以保证水能够以水蒸气的形态进入反应器,通过调节注射泵的流速来控制水蒸气含量以获得不同的水/碳摩尔比(R)。反应尾气首先通过置于冰水混合物中的U形管以收集可冷凝产物,随后气相产物流经数字式皂膜流量计以测量其总流量。采用气-质联用仪(安捷伦GC-MS,GC 7820A和MSD 5975C)对液相产物进行定性和定量分析;采用气相色谱仪(上海天美科学仪器有限公司产品,GC7900型)对反应后的气相产物各成分进行定量分析。水/碳摩尔比表示单位时间内进入反应器内水蒸气和碳总量的摩尔比,计算如式(1)所示。
(1)
式中:F(M)in为反应器进口各物质(M分别表示H2O、CO2、CH4)的流量,mol/s。
1.3 参数计算
水蒸气添加对DBD CO2重整CH4反应过程放电特性的影响主要通过电压电流波形和Lissajous图形分析获得。典型的DBD Lissajous图形一般为平行四边形[18],如图2所示,图2中A、B、C、D为平行四边形的4个顶点,平行的边DA和CB为未放电的时刻,其斜率是放电未形成时反应器的总电容(Ccell,pF),其值还可以通过式(2)计算获得。
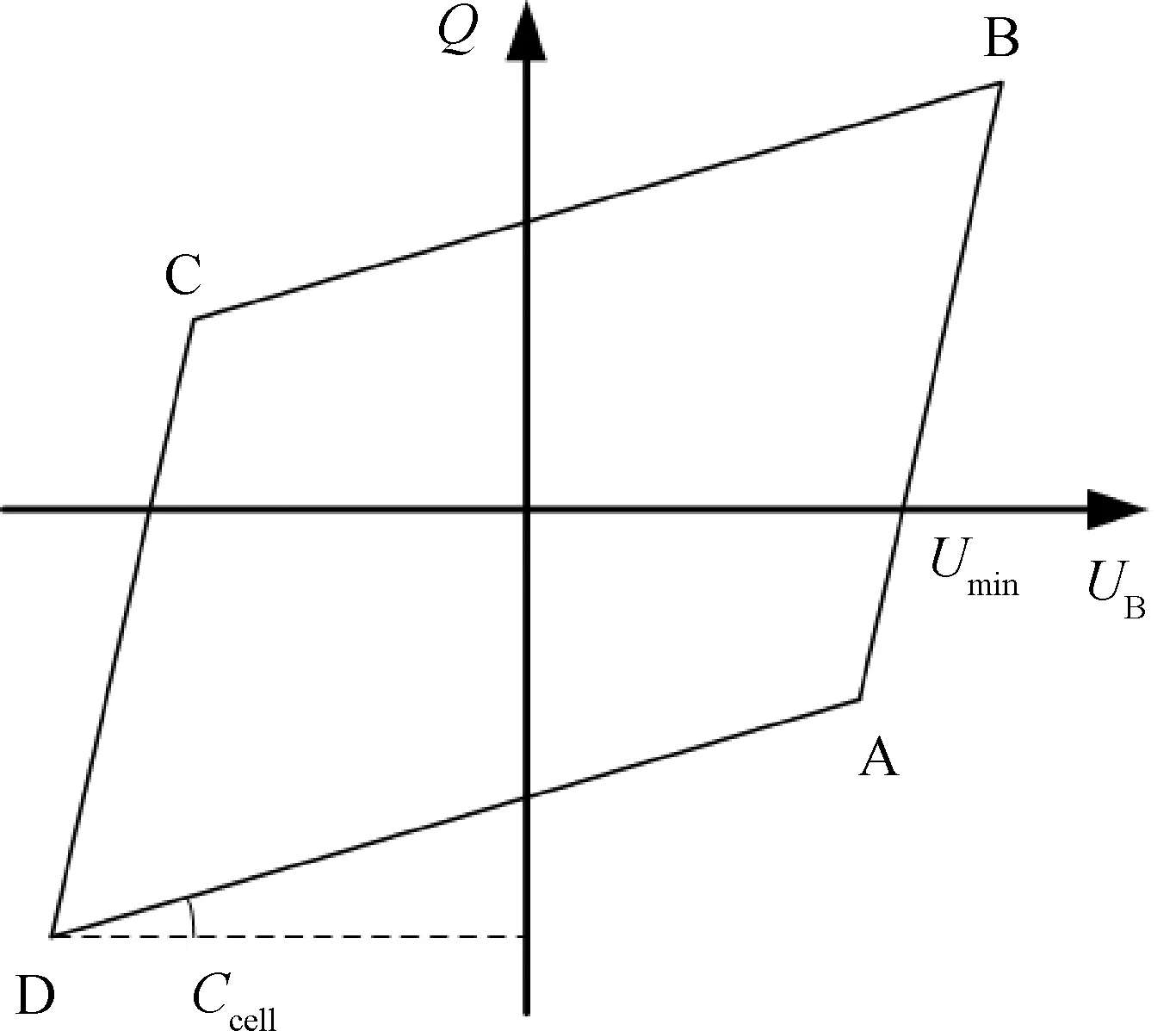
A,B,C,D represent the four vertices of the parallelogram.图2 典型的介质阻挡放电Lissajous图形Fig.2 Typical Lissajous figure for dielectric barrier discharge
(2)
式中:Cd和Cg分别为介质层和气体间隙的电容值[19],pF。
对于同轴DBD,介质层电容值可由公式(3)计算获得。
(3)
式中:ε0和εd分别为真空介电常数(8.854×10-12F/m)和石英介质的相对介电常数(3.70)[18];l、di和do分别为放电长度及石英介质管内径和外径,mm。
由式(3)和Lissajous图形获得Cd和Ccell之后,即可通过式(2)计算得到Cg。在此基础上,可通过式(4)计算得到起始放电时气隙电压,即击穿电压(UB,kV)[19]。
(4)
式中:Umin为如图2所示Lissajous图形与横坐标电压UB正方向的交点。
通过Lissajous图形还可进一步得到放电过程的传输电荷和放电功率,具体方法可参考前期研究[7,18]。
为评价水蒸气添加对DBD CO2重整CH4反应性能的影响,定义反应物转化率(x,%)、产物产率(y,%)和选择性(s,%)、能量效率(η,mmol/kJ)和碳平衡(BC,%)等反应性能指标,分别由式(5)~(15)计算获得。
(5)
(6)
x(TC)=φ(CO2)×x(CO2)+φ(CH4)×x(CH4)
(7)
(8)
(9)
(10)
(11)
(12)
(13)
(14)
BC=s(CO)+∑s(CxHyOz)
(15)
式中:φCO2和φCH4分别为未添加水蒸气时CO2和CH4的体积分数,%;F(M)in、F(M)out分别表示反应器进、出口各物质(M分别表示H2O、CO2、CH4、CO、H2、CxHyOz)的流量,mol/s;CxHyOz表示甲醇(CH3OH)和乙酸(CH3COOH)等液相产物,当z=0,则表示为乙烷(C2H6)、乙烯(C2H4)等烃类化合物;P为放电功率,W;TC表示总碳(Total carbon),ConRe表示转化反应物(Converting reactants),ProSyn表示生成合成气(Producing syngas),ProCxHyOz表示生成烃类化合物或者液相产物。
2 结果与讨论
2.1 水蒸气添加对DBD CO2重整CH4反应过程放电特性的影响
图3所示为不同水/碳摩尔比条件下DBD CO2重整CH4反应过程电压、电流波形图。由图3可以看出,在不同水/碳摩尔比条件下电流波形在电压的正负半周期上均呈现大量的微放电脉冲,这说明无论是否添加水蒸气,放电均表现为典型的丝状放电[18]。当添加少量水蒸气(水/碳摩尔比为0.5)时,输入电压的峰值由未添加水蒸气时(水/碳摩尔比为0)的8.6 kV降低至8.0 kV,而微放电脉冲的数目和幅值均明显提高,这表明添加少量水蒸气能增强放电并提高等离子体活性;当进一步增加水蒸气的含量(水/碳摩尔比为1.75)时,水分子的电负性致使放电区域电子密度急剧减小[20],表现为较低的微放电脉冲数目和幅值,反应活性明显降低,为获得相同的放电功率则需提高输入电压,因而此时输入电压为10.1 kV。

图3 不同水/碳摩尔比(R)条件下电压(UB)和电流(I)波形Fig.3 Voltage (UB)and current (I)waveforms under different steam-to-carbon molar ratios (R)R:(a)0;(b)0.5;(c)1.75
图4所示为DBD CO2重整CH4反应过程电压和电荷特性。从图4(a)可以发现:当水/碳摩尔比在0~1.75范围内增加时,Lissajous图形所呈现的平行四边形先变宽后变窄。随着水/碳摩尔比的增加,Lissajous图形中未放电边的斜率先增加后减小,说明Ccell值先增加后减小,对于结构固定的DBD,不同反应工况时Cd值基本不变,因而Cg值也呈现先增大后减小的变化趋势;从Lissajous图形与横坐标电压UB正方向交点的变化位置可以发现,Umin先减小后增大;上述两种因素共同作用致使击穿电压随着水/碳摩尔比的增加先减小后增加。与此同时,结合图2和图4(b)可以看出,当水/碳摩尔比由小到大变化时,传输电荷先增大后减小。由图4(b)可以看出,当水/碳摩尔比增加至0.5时,击穿电压和传输电荷分别达到最小值(3.3 kV)和最大值(1.6 μC);当进一步增加水/碳摩尔比至1.75时,击穿电压提高到4.1 kV,高于未添加水蒸气时的3.6 kV,此时传输电荷达到最小值1.2 μC。上述现象表明,存在最佳的水/碳摩尔比使更多的能量用于CO2重整CH4过程,而非击穿气体,从而提升反应性能[7]。

图4 不同水/碳摩尔比(R)条件下电压(UB)和电荷(q)特性Fig.4 Characteristics of voltage (UB)and charge (q)under different steam-to-carbon molar ratios (R)(a)Lissajous figures;(b)Transferred charge and breakdown voltage
2.2 水蒸气添加对DBD CO2重整CH4反应性能的影响
图5所示为在反应时间1 h条件下不同水/碳摩尔比对DBD CO2重整CH4过程反应性能的影响。由图5可知,当未添加水蒸气时,CO2和CH4转化率分别为16.6%和26.3%;当水/碳摩尔比增加至0.5时,其转化率达到了最大值19.3%和33.7%;继续增加水/碳摩尔比将降低反应物转化率。
反应物转化率随水/碳摩尔比的变化趋势与放电特性的变化趋势一致,这主要有两方面原因,添加少量水蒸气时,水蒸气在高能电子的作用下电离生成·OH自由基和H·自由基,如反应R1所示,这两种活性粒子分别通过反应R2和R3促进CH4和CO2分子转化。前期研究表明,在DBD环境下,CO2重整CH4反应链主要由电子激发CO2和CH4分子裂解引起(反应R4~R7),高能电子在整个反应体系中起着至关重要的作用[21]。水分子具有较强的电负性,可通过反应R8吸附电子,降低反应体系的高能电子密度。当水蒸气含量较少时,H2O分子电离生成·OH自由基和H·自由基所起的积极作用弥补了水分子吸附高能电子所产生的负面效应,从而使反应物转化率随着水/碳摩尔比的增加而提升;进一步增加水/碳摩尔比将显著降低高能电子密度,反应体系活性减弱,从而降低反应物转化率。
e+H2O→e+H· + ·OH
(R1)
CH4+ ·OH→CH3+H2O
(R2)
CO2+H· →CO+ ·OH
(R3)
CO2+e→CO+O·e
(R4)
CH4+e→CH3+H· +e
(R5)
CH4+e→CH2+H2+e
(R6)
CH4+e→CH+H· +H2+e
(R7)
e+H2O→H2O-
(R8)
反应过程所产生的气体产物主要含有H2、CO、C2H6、C3H6、C3H8和C2H4,同时也检测到少量的C2H2和C4H10,由于其含量较低,故未进行定量分析。产物CO主要由CO2分子分解(反应R4)及加氢(反应R3)反应生成,而H2则主要由甲烷裂解脱氢(反应R6和R7)及甲烷和水分子分解生成的H原子复合而成。CO和H2产率与CO2和CH4转化率表现出相近的变化趋势,这说明产物H2中的H原子来自于水分子的比例较小。与反应物转化率随水/碳摩尔比的变化趋势一致,各气相产物的选择性均在水/碳摩尔比为0.5时达到最大值。C2H6和C2H4主要由CH4裂解产生CH3和CH2复合而成,如反应式R9和R10所示[22]。C2H6通过电子或者CH3碰撞发生反应也可生成C2H4及C2H5(反应R11至R13),生成的C2H5通过自身复合(反应R14)或者与CH3复合(反应R15)生成C4H10和C3H8。生成的C3H8再通过系列电子碰撞反应生成C2H4、C3H6和C2H2。由于检测到的C2H2和C4H10含量很少,因而反应体系中R14和R18所占的比重很小。在水/碳摩尔比较大(大于0.5)时,由于水分子电负性吸附电子导致反应R4至R7发生的概率降低,致使后续生成其他烃类化合物的几率减小,从而降低选择性。
CH3+CH3→C2H6
(R9)
CH2+CH2→C2H4
(R10)
e+C2H6→e+C2H4+H2
(R11)
e+C2H6→e+C2H5+H·
(R12)
CH3+C2H6→C2H5+CH4
(R13)
C2H5+C2H5→C4H10
(R14)
C2H5+CH3→C3H8
(R15)
e+C3H8→e+C2H4+CH4
(R16)
e+C3H8→e+C3H6+H2
(R17)
e+C3H6→e+C2H2+CH4
(R18)
反应过程检测到的主要液相产物有甲醇、乙醇、乙酸和丙酸等,还有少量的甲醛、丙酮、丙醇和丁酸等,因其含量少未进行定量分析。在未添加水蒸气时,液态产物主要为甲醇和乙醇,其选择性分别为21.6%和9.6%。甲醇主要有以下3种生成途径:①由CO2转化生成的CO经过一系列加氢反应生成甲醇(反应R19)[23];②CH4裂解生成的CH3与CO2加氢生成的OH直接复合(反应R20);③CH3与OH复合形成CH2OH,进一步加氢生成甲醇(反应R21和R22)[24]。乙醇则主要由反应中间体C2H5和OH复合反应生成(反应R23)。添加水蒸气之后,随着水/碳摩尔比的增加,甲醇和乙醇的选择性逐渐减小,而乙酸和丙酸的选择性逐渐升高。乙酸和丙酸的生成路径主要包括以下3个路径[25]:①CO和OH复合(R24)生成COOH,CH3和C2H5分别与COOH反应生成乙酸和丙酸(R25和R26);②CH3和C2H5分别与CO反应形成CH3CO和C2H5CO(R27和R28),这两种中间体与OH反应生成乙酸和丙酸(R29和R30);③CH3和C2H5分别与CO2反应形成CH3COO和C2H5COO(R31和R32),这两种中间体与H反应生成乙酸和丙酸(R33和R34)。增加水/碳摩尔比提高反应体系中OH和H的浓度,使得更多的CH3和C2H5参与到反应R24至反应R34中,从而提高这两种酸的选择性。图6所示为含有水蒸气条件时等离子体CO2重整CH4生成气相和液相产物可能的机理图。

图6 含有水蒸气时CO2重整CH4生成气相和液相产物可能的机理图Fig.6 Diagram of possible mechanism for the formation of gaseous and liquid products from CH4 reforming with CO2 in the presence of H2O
(R19)
CH3+ ·OH→CH3OH
(R20)
CH2+ ·OH→CH2OH
(R21)
CH2OH+H· →CH3OH
(R22)
C2H5+ ·OH→C2H5OH
(R23)
CO+ ·OH→COOH
(R24)
CH3+COOH→CH3COOH
(R25)
CH3CH2+COOH→CH3CH2COOH
(R26)
CH3+CO→CH3CO
(R27)
CH3CH2+CO→CH3CH2CO
(R28)
CH3CO+ ·OH→CH3COOH
(R29)
CH3CH2CO+ ·OH→CH3CH2COOH
(R30)
CH3+CO2→CH3COO
(R31)
CH3CH2+CO2→CH3CH2COO
(R32)
CH3COO+H· →CH3COOH
(R33)
CH3CH2COO+H· →CH3CH2COOH
(R34)
图7所示为DBD CO2重整CH4过程反应转化反应物和生成各类产物的能量效率的变化情况。由图7可以看出,转化反应物、生成合成气和烃类化合物的能量效率均在上述最佳水/碳摩尔比(0.5)时取得最大值,进一步提高水/碳摩尔比,上述能量效率则明显降低。而生成液相产物的能量效率随着水/碳摩尔比的提高而逐渐降低,这主要是由于当水/碳摩尔比超过最佳值后,随着水/碳摩尔比的增加CO2和CH4转化率明显降低,转化掉的反应物用于生成液态产物的总量逐渐减小,因而在相同放电功率条件下能量效率逐渐降低。对比现有研究,生成烃类化合物和液态产物的能量效率还不理想,后续考虑采用合适的催化剂以提高生成这些高品质产物的能量效率[12-13,26-27]。
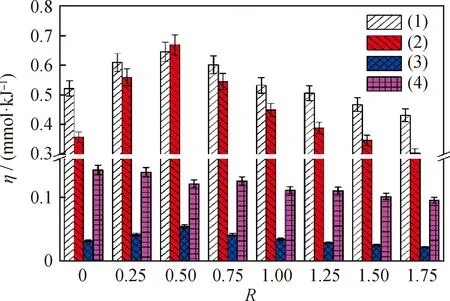
(1)Energy efficiency for converting reactants; (2)Energy efficiency for producing syngas; (3)Energy efficiency for producing CxHy hydrocarbons; (4)Energy efficiency for producing CxHyOz liquid compounds图7 不同水/碳摩尔比(R)条件下DBD CO2重整CH4过程能量效率(η)Fig.7 Energy efficiency (η)of CH4 reforming with CO2 in DBD reactor under different steam-to-carbon molar ratios (R)Conditions:P=55 W;n(CO2)/n(CH4)=1;L=50 mL/min;p=0.1 MPa;t=1 h
图8所示为DBD CO2重整CH4过程反应进行1 h之后的碳平衡及持续进行7 h反应过程总碳转化率随时间的变化。由图8可知:在未添加水蒸气的情况下,当反应进行1 h之后,内电极表面和介质管内表面出现了较为明显的灰褐色物质和淡黄色黏稠油状小液滴,这些物质为反应过程中生成的积炭和高分子液态产物,在统计碳平衡时未考虑上述物质,因而这种情况下碳平衡很低,仅为84.0%;此外,积炭和黏稠状物质对放电稳定性造成不利影响,使得当反应进行4 h之后总碳转化率明显降低。当添加少量水蒸气时,水分子电离分解产生的·OH和H·使得CH4和CO2转化生成更多的高品质气相化合物和液态产物,而非积炭和黏稠油状物质,从而提高反应过程的碳平衡;在最佳水/碳摩尔比0.5时,碳平衡达到最大值96.7%。当水/碳摩尔比超过最佳值时,则会生成更多相对分子质量高于乙醇和丙酸的液态产物,这部分物质未包括在碳平衡计算中,因而碳平衡有所降低;但可以发现,由于添加水蒸气之后没有明显的积炭生成,未对放电造成明显的影响,因此碳平衡维持在90%附近,这种稳定性也可以反应过程总碳转化率随时间的变化规律得到证实,可以发现,当水/碳摩尔比为0.5和1.75时,总碳转化率均保持良好的稳定性。
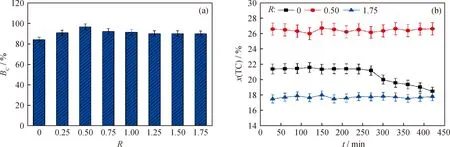
图8 不同水/碳摩尔比(R)条件下DBD CO2重整CH4过程反应稳定性评价Fig.8 Reaction stability evaluation of CH4 reforming with CO2 in DBD reactor under different steam-to-carbon molar ratios (R)(a)Carbon balance (BC);(b)Variation of total carbon conversion (x(TC))with reaction time (t)Conditions:P=55 W;n(CO2)/n(CH4)=1;L=50 mL/min;p=0.1 MPa;t=1 h
3 结 论
(1)在DBD CO2重整CH4反应中添加水蒸气,存在最佳水/碳摩尔比(0.5)能够降低放电击穿电压,增强电荷传输能力,提高等离子体环境活性,使更多的放电功率用于激发活化反应物分子,从而提升反应性能。
(2)反应物转化率、CO和H2产率、CO和烃类化合物选择性以及转化反应物、生成合成气和烃类化合物的能量效率均在最佳水/碳摩尔比时取得最大值;提高水/碳摩尔比可降低主要醇类产物的选择性,但是提高主要酸类产物的选择性;在相同的放电功率条件下,提高水/碳摩尔比可减少主要液态产物的生成量,从而降低对应的能量效率。
(3)添加水蒸气能够抑制积炭的生成,并提高液态产物的品质,即使当水/碳摩尔比超过最佳值时也能保持良好的反应稳定性。

