新型冠状病毒感染后获得性凝血因子Ⅴ抑制物一例
王 蕾,张 澍,张 琳,崔立坤,刘 娜,朱孟蝶,王正斌
郑州大学第一附属医院急救中心 郑州 450052
获得性凝血因子Ⅴ抑制物(acquired factor Ⅴ inhibitor, AFVI)是一种极其罕见的疾病,通常发生在60岁以后,可导致严重的出血[1]。黏膜(如泌尿生殖道、胃肠道及呼吸道等)是最常见的出血部位,约占62%;血尿最为常见,颅内出血相对少见(约占8%),但致死率高[2]。感染、药物、外科手术、输血、肿瘤以及自身免疫性疾病与AFVI风险高度相关,目前尚无明确的治疗策略[2-3]。新型冠状病毒(新冠病毒)感染除可导致肺部损伤外,患者全身多个系统都可能受到影响,其中值得重视的病理特征之一是凝血功能异常[4-8],主要表现为D-二聚体以及纤维蛋白原升高等,多数患者呈现高凝状态,但出血极少。现报道新冠病毒感染后AFVI患者一例,以供临床参考。
1 病例资料
患者女,67岁,于2023年1月以“血尿6 d,加重1 d”收入郑州大学第一附属医院急诊科,自诉半月前曾因新冠病毒感染在当地医院住院治疗,好转后出院;出院3 d后出现血尿,在当地治疗效果不佳,遂转入我院。患者“高血压病3级(极高危)”病史2年余,“陈旧性脑梗死”病史2年余。入院后查血常规(全自动血液分析仪法):白细胞计数7.83×109个/L,红细胞计数2.95×1012个/L,血红蛋白92.0 g/L,血小板计数144×109个/L,均在正常范围内。尿常规(尿液自动分析仪法):红细胞计数18 571 个/μL,隐血3+。凝血功能(凝固法和免疫比浊法):凝血酶原时间(PT)90.1 s(参考值范围9.0~14.0 s),凝血酶原时间活动度8.5%(参考值范围70.0%~140.0%),国际标准化比值(INR)9.04(参考值范围0.80~1.20),活化部分凝血活酶时间(APTT)115.8 s(参考值范围22.2~32.5 s)。凝血因子全套(凝固法):凝血因子Ⅴ(FⅤ)活性1.0%(参考值范围62.0%~139.0%),FⅤ抑制物17.6 BU/mL,血管性血友病因子(vWF)活性193.3%(参考值范围40.3%~163.4%),其他均在正常范围。狼疮抗凝物阴性,抗心磷脂抗体和抗β2糖蛋白阴性。常见毒物检测(质谱法),中段尿培养,肝肾功能,肿瘤标记物(电化学发光法,包括CA125/15-3/19-9/72-4、甲胎蛋白、癌胚抗原、细胞角蛋白19片段、神经元特异性烯醇化酶、胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ、胃泌素释放肽前体、人绒毛膜促性腺激素),结缔组织病全套(间接免疫荧光和免疫印记法,包括抗核抗体、抗双链DNA抗体、抗核糖体抗体、抗组蛋白抗体、抗核小体抗体、抗着丝点抗体、抗JO-1抗体、抗Scl-70抗体、抗SSA抗体、抗SSB抗体、抗Ro52抗体、抗Sm抗体、抗nRNP/Sm抗体)等均正常。影像学检查:泌尿系超声示膀胱内弱回声,考虑积血块;胸加全腹CT未见明显肿瘤征象。
入院后因诊断不明,故给予酚磺乙胺(2 g/d)、卡络磺钠(80 mg/d)、维生素K1(40 mg/d)等药物止血,并联合输注血浆(多次,总量6 540 mL)及冷沉淀(总量8 U)以补充凝血因子;应用5 d后血尿无明显好转,尿中仍有较多血块,血红蛋白低至66 g/L,给予悬浮红细胞4 U纠正贫血,后经多学科会诊考虑为AFVI。排除感染、肿瘤及结缔组织病且确认无禁忌后,给予大剂量[0.4 g/(kg·d)]丙种球蛋白冲击联合小剂量(5 mg/d)地塞米松5 d,患者自觉血尿颜色较前变浅(图1),尿中红细胞较前减少;5 d后停用丙种球蛋白,地塞米松继续应用2 d后改为泼尼松32.5 mg口服,逐渐减量。由于未追踪随访至完全减停,故停药时间不确切,整个疗程需4~6周。患者出院前尿色恢复正常,尿常规中无红细胞,但凝血功能仍未恢复正常(表1)。
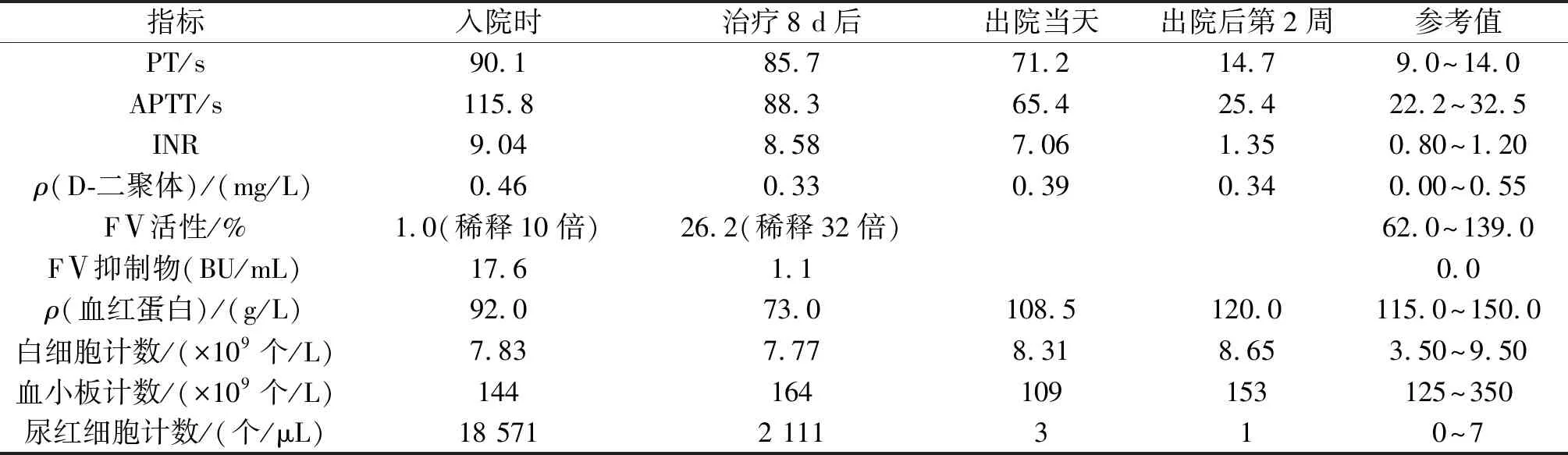
表1 患者凝血功能及血、尿常规检查结果

图1 治疗前后及出院前尿色变化
患者出院后继续维持小剂量泼尼松口服,第1周泼尼松减量至27.5 mg,复查尿常规白细胞3+,无隐血及红细胞,凝血功能变化不大,嘱其多饮水,注意局部卫生,预防泌尿系感染;出院后第2周泼尼松减量至22.5 mg,尿常规白细胞1+,凝血功能基本恢复正常。患者凝血功能及尿常规变化情况见表1。
2 讨论
AFVI通常是一种针对FⅤ轻链的第二个C型结构域的免疫球蛋白IgG,它是磷脂酰丝氨酸的结合位点,可导致促凝和抗凝功能不平衡[9]。1955年,Horder等[10]在先天性FⅤ缺乏症患者体内发现FⅤ抑制物,考虑为长期输注FⅤ诱导抗体生成所致,这是第一例有关FⅤ抑制物的报道,局部应用牛凝血酶被认为与FⅤ抑制物关系密切。牛凝血酶是一种广泛用于各种手术操作的止血药物,随着重组人凝血酶应用的越来越广泛,牛凝血酶所致的FⅤ抑制物病例数已逐渐减少。Franchini等[3]对78例非牛凝血酶所致AFVI病例进行了总结,发现最为常见的诱因是抗生素使用(42%),包括β内酰胺类、氨基糖甙类(尤其是链霉素)等;其次是手术操作,感染性疾病(包括细菌、结核、病毒感染)等,肿瘤和自身免疫性疾病。
本例为老年女性患者,既往有脑梗死病史,入院前未使用过β内酰胺类及氨基糖甙类抗生素;因持续血尿入我科,复查新冠病毒核酸阴性,根据凝血功能、凝血因子活性及抑制物检测结果诊断为AFVI。由于患者发病年龄较晚,输入血浆及冷沉淀补充凝血因子效果不佳,且否认近亲结婚,家族中类似症状或疾病者,遂考虑先天性可能性不大。在积极排除感染、药物、肿瘤及自身免疫性疾病后,现病因仍不明确,推测可能与新冠病毒感染引起的自身免疫功能紊乱和凝血功能障碍有关。
本例是报告的第3例新冠病毒感染后AFVI。第1例是美国堪萨斯大学医学中心报告[11]的1名87岁白人女性,发病前2周及发病后4周鼻咽拭子检测新冠病毒RNA阳性,严重贫血,左腰肌和腹膜后有血肿,FⅤ活性<1%,FⅤ抑制物31.6 BU/mL,静脉注射免疫球蛋白和地塞米松无明显疗效,3个周期的血浆置换才使凝血障碍得到纠正。第2例是意大利那不勒斯大学报告[12]的1名62岁白人女性,因反复发作性血尿1周而就诊,实验室检查显示凝血功能障碍并存在FⅤ抑制物,两周前接受过新冠病毒感染治疗(包括吸氧、小剂量激素及低分子肝素);新冠病毒抗体阳性,给予7.5 mg/d地塞米松治疗后,血尿很快停止,2周内PT和APTT恢复正常。本例起病时间、症状和治疗措施及预后与上述两例均较为相似;本例确诊AFVI时新冠病毒核酸已转为阴性,并且凝血功能恢复时间也稍慢。
新冠病毒感染与自身免疫凝血异常(如狼疮抗凝血剂、抗心磷脂抗体和静脉血栓栓塞)有关[13]。凝血功能异常、血栓形成、内皮功能障碍在新冠病毒感染患者中较为常见,且凝血功能异常严重程度与不良预后明显相关,血栓在重症感染患者中很常见,而出血倾向却并不常见[8]。这3例AFVI应被纳入已报告的新冠病毒感染相关获得性凝血因子Ⅷ缺乏(获得性血友病A)病例库中[14-15],从而为相关患者凝血功能监测提供临床依据。虽然本例很难明确新冠病毒感染与AFVI的因果关系,但可以合理推测新冠病毒感染与凝血功能障碍之间存在时间关系。
总之,新冠病毒感染后AFVI仍属于个例。已报道的3例均为老年女性,均在治疗2周左右起病,对免疫抑制及血浆置换治疗有效,但是FⅤ抑制物的产生是新冠病毒感染直接导致的,还是某种新冠病毒感染治疗药物诱发的,还有待大量临床病例分析加以证实。