荧光PCR 技术在麝香壮骨膏控制菌检查中的应用
李宏铎,李亚楠,沙 淼,夏 天,崔 迎,杨晓莉
(1.西安市食品药品检验所,陕西 西安 710054;2.国家药品监督管理局药品微生物检测技术重点实验室,陕西 西安 710065;3.陕西省食品药品检验研究院,陕西 西安 710065)
2020 年版《中国药典》 四部0122 贴膏剂规定贴膏剂包括凝胶贴膏(原巴布膏剂或凝胶膏剂) 和橡胶贴膏(原橡胶膏剂)[1]。2005 年版《中国药典》 二部微生物限度检查法引入验证理念,使得检测结果更科学准确[2]。在微生物限度检查项下规定,凝胶贴膏和橡胶贴膏的控制菌为每10 cm2不得检出金黄色葡萄球菌和铜绿假单胞菌。
金黄色葡萄球菌(Staphylococcusaureus) 在自然界中广泛存在,30%~80% 的人为该病原菌的携带者[3],约32%的食品中含有该菌[4],金黄色葡萄球菌也是最常见的化脓性感染致病菌[5]。而铜绿假单胞菌 (Pseudomonas aeruginosa) 为条件致病菌,可引起伤口、呼吸道、泌尿道的感染[6-7]。目前药品微生物检查的生化方法,操作繁琐,时间长[8],需要建立更加准确、快速的检测方法。
药品控制菌检验的技术有实时荧光PCR 技术、变性梯度凝胶电泳、随机引物扩增多态性技术、基因芯片技术、核酸分子杂交技术等[9-10]。实时荧光PCR 灵敏度高,特异性好,是目前微生物检验重要手段[11]。多重荧光PCR 通过使用多对引物、探针,能同时对多个目标序列检测,结果更快速、准确[12]。刘婷婷等[13]建立了实时荧光PCR 技术检验金黄色葡萄球菌。申应德等[14]建立了药品中沙门菌荧光PCR 方法。柯振华等[15]建立了金黄色葡萄球菌、沙门氏菌和副溶血性弧菌的多重PCR 方法。张静等[16]提出了食源有害微生物DNA 快速提取与多重PCR 检测初探。胡兴娟等[17]进行了四重荧光定量PCR 法对肠炎、鼠伤寒以及伤寒沙门氏菌的鉴定。
1 材料
1.1 仪器与试剂 LC480 荧光定量PCR 仪(瑞士罗氏公司);5430R 高速冷冻离心机、Biospectrometer 紫外/可见光/荧光分光光度计(德国艾本德公司)。细菌基因组DNA提取试剂盒[天根生化科技(北京) 有限公司];荧光定量PCR 反应试剂盒(日本TaKaRa 公司);胰酪大豆胨琼脂培养基(北京三药科技开发公司)。水为超纯水。
1.2 菌株 见表1。

表1 菌株样品信息
1.3 引物及探针 参考文献[18] 报道,金黄色葡萄球菌根据femB基因序列,铜绿假单胞菌根据ETA基因序列设计引物及探针,见表2。
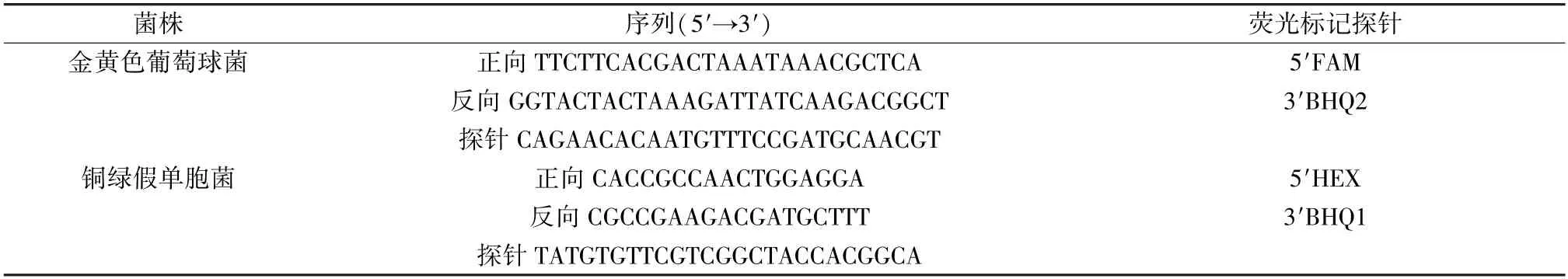
表2 引物与TaqMan 探针
1.4 药物 本实验样品为2021 年国家药品评价性抽验品种麝香壮骨膏,共计全国40 个生产厂家,260 批。按照2020 年版《中国药典》 四部检查控制菌后,均为未检出,作为阴性样品。
2 方法
2.1 细菌培养及模板DNA 的提取 分别吸取1 mL 菌株的纯培养液,细菌基因组DNA 提取试剂盒提取DNA,Biospectrometer 紫外/可见光/荧光分光光度计测定核酸浓度。建立DNA 模板库,保存于-20 ℃备用。
2.2 荧光定量PCR 检测方法 双重荧光定量PCR 反应体系为25 μL,体系组成为10×Probe qPCR mix 12.5 μL,正向、反向引物(10 mol/L) 各1 μL,探针0.5 μL,模板DNA 2 μL,加水至25 μL。实时荧光定量PCR 仪反应参数为95 ℃预变性1 min;95 ℃变性15 s,60 ℃退火并延伸45 s,共40 个循环,在每个循环的60 ℃退火并在延伸阶段收集荧光信号。设立培养基提取阴性对照,无菌水为空白对照。
2.3 灵敏度 按“2.2” 项下反应体系对金黄色葡萄球菌和铜绿假单胞菌进行双重荧光PCR 反应,将DNA 模板10倍系列稀释,同时用胰酪大豆胨琼脂培养基对其进行菌落计数。选取10-1~10-6DNA 浓度,其对应的初始菌浓度对数值与Ct 值作标准曲线。
2.4 特异性 按“2.2” 项下反应体系将24 株菌的DNA同时添加为模板,进行双重荧光定量PCR 反应。此24 种菌为日常药品检测中常见菌种、革兰氏阳性菌、革兰氏阴性菌、球菌、杆菌的典型代表,同时加入模板可以范围更广的证明所用引物特异性的优劣。
2.5 重复性 选取不同浓度金黄色葡萄球菌和铜绿假单胞菌DNA 模板混合后,进行3 次PCR 分析,比较重复性。
2.6 控制菌检查方法 取供试品100 cm2,加5 mL 聚山梨酯80,再加pH 7.0 无菌氯化钠-蛋白胨缓冲液至100 mL,混匀,静置,取水相为1 ∶10 的供试液,分别取10 mL 供试液接种至胰酪大豆胨液体培养基中混匀,一份按照《中国药典》 规定方法进行检验,另一份将菌液浓度为10 cfu/mL 金黄色葡萄球菌和铜绿假单胞菌加入到培养基中,35 ℃培养24 h,取增菌液1 mL,按细菌基因组DNA提取试剂盒提取DNA 作模板,进行荧光定量PCR 检测。
3 结果
3.1 灵敏度试验结果 金黄色葡萄球菌和铜绿假单胞菌基因组DNA 梯度稀释至10-6。金黄色葡萄球菌和铜绿假单胞菌最低检测限分别为20、10 cfu/mL,结果见图1~2。以DNA 稀释倍数为横坐标(X),Ct 值为纵坐标(Y) 进行回归,得到金黄色葡萄球菌方程为Y=3.536X+13.77 (R2=0.998 7),铜绿假单胞菌方程为Y=3.325X+15.68 (R2=0.997 2)。表明Ct 值与DNA 浓度的对数值的线性关系良好,检测体系准确可靠。
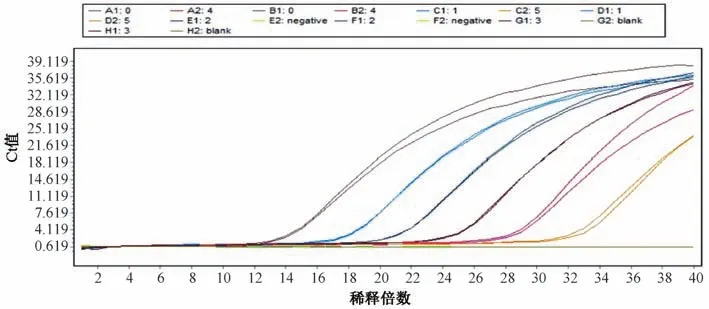
图1 金黄色葡萄球菌灵敏度试验结果
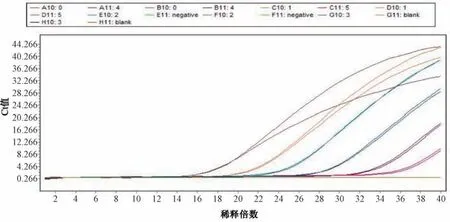
图2 铜绿假单胞菌灵敏度试验结果
3.2 特异性试验结果 双重荧光定量PCR 反应对24 株菌株的结果见图3~4。金黄色葡萄球菌和铜绿假单胞菌Ct 值分别为16、17,其他菌株均为阴性反应。表明对金黄色葡萄球菌、铜绿假单胞菌的双重荧光PCR 反应特应性好,能够同时用来检测贴膏剂中的金黄色葡萄球菌和铜绿假单胞菌这2 种控制菌。
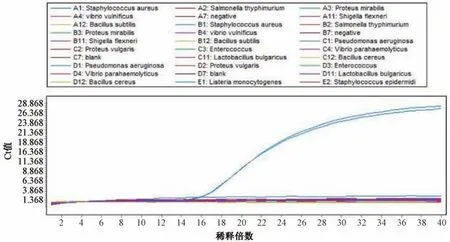
图3 金黄色葡萄球菌特异性试验结果
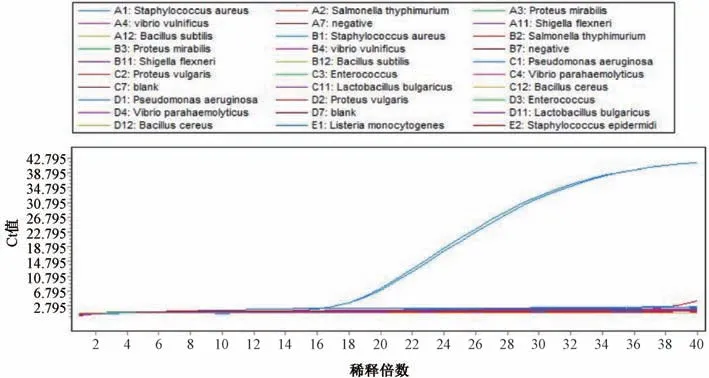
图4 铜绿假单胞菌特异性试验结果
3.3 重复性试验结果 相同浓度每次扩增曲线基本吻合。金黄色葡萄球菌的Ct 值分别为15.43、15.36、15.39,变异系数为0.19%,铜绿假单胞菌的Ct 值分别为18.22、18.31、18.27,变异系数为0.20%,均小于2%,表明该方法重复性良好。结果见图5~6。
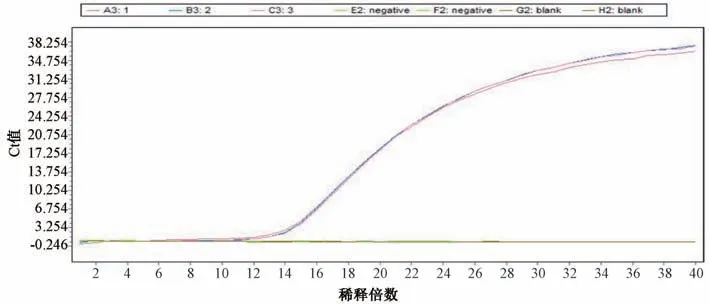
图5 金黄色葡萄球菌重复性试验结果
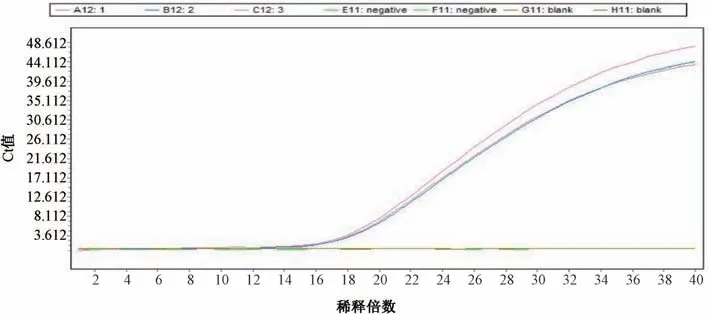
图6 铜绿假单胞菌重复性试验结果
3.4 控制菌检查方法结果 采用建立的双重荧光PCR 方法和药典规定的控制菌检验方法,对来自40 个药厂的271份国家药品评价性抽验麝香壮骨膏同时进行检验,2 种方法均未检出金黄色葡萄球菌和铜绿假单胞菌,结果一致。
4 讨论
药品中污染微生物是评价药品质量和安全性的重要指标,药品控制菌检查是对微生物污染进行定性检测[19],随着GMP、《中国药典》 和相关技术指南的不断提高,对于药品及其生产过程中微生物的检测、鉴定和溯源的要求,分子生物学方法开始应用于药品微生物检验中来。
本研究建立的双重实时荧光PCR 方法,确定了反应体系和反应参数,通过对金黄色葡萄球菌、铜绿假单胞菌与样品和环境中污染概率较大,一些生化反应相同的干扰菌株同时进行检验,表明该方法特异性高,满足日常检验需求。实时荧光PCR 检测下限为10~100 cfu[20]。本研究建立的金黄色葡萄球菌、铜绿假单胞菌检测限分别可达到20、10 cfu/mL,具有良好的灵敏度。但荧光PCR 法也存在不足,传统的生化检验方法,活菌能够被培养,进而被分离鉴别,而死菌不能够被培养,也就无法被检测到。由于灭菌工艺的不同,死菌可能残留在样品中,通过荧光PCR 方法死菌也会被检测到而判定为阳性。这也可能是荧光PCR方法没有被广泛应用于的药品控制菌检验中的原因之一。
麝香壮骨膏工艺中虽无灭菌工艺,但由于制法中药品原料都经过熬制微生物污染可能小,辅料与包装过程可能存在污染。虽然没有阳性结果数据,通过阴性结果数据表明荧光PCR 方法具有灵敏、快速特点,提高了药品日常检验工作的效率,对日常的药品微生物检验工作中,大批量相同样品的金黄色葡萄球菌、铜绿假单胞菌的污染的初筛,双重荧光PCR 法能够提供有效的帮助,也为今后建立不同组合和更多控制菌的同步检测打下了良好基础。

