基于网络药理学探讨化瘀软肝胶囊对肝纤维化大鼠的肝脏保护作用
牛媛媛,汪龙德,毛兰芳,胥文娟,张 萍,符博雅
(1.甘肃中医药大学中医临床学院,敦煌医学与转化重点实验室,甘肃 兰州 730000,2.甘肃中医药大学附属医院消化科,甘肃 兰州 730020,3.甘肃省中医院针灸科,甘肃 兰州 730050)
肝纤维化是肝脏应对组织损伤后自我调节性的保护反应,被认为是慢性肝病发展到肝硬化、肝癌、甚至肝衰竭的前期可控阶段,现已成为各种急慢性肝病诊断治疗的重点关注事件。公认的肝纤维化发病机制为细胞外基质(extracellular matrix,ECM) 产生过度与降解不及时的动态平衡受扰,在肝组织窦周间隙内进行性形成病理堆积[1-2]。若感染、病毒、寄生虫等因素持续存在,肝纤维化可进一步恶化为肝癌、肝衰竭等晚期肝病事件,因此抗纤维化的基础研究对于临床治疗疾病具有积极意义,同时也是当前肝病领域的重点与难点。
课题组前期的临床研究发现,化瘀软肝胶囊立法契合本病病位在肝,涉及脾肾的病位概括,尤其在改善患者的乏力、上腹胀满、恶心、呕吐、纳差等临床症状方面具有显著优势[3-6]。此外,实验研究也证实,该方药能够有效地调节纤维化的四项指标及促纤维化细胞因子,并对CCl4诱导的肝纤维化模型大鼠显示出良好的纤维化改善效果。然而由于肝纤维化的复杂致病性及研究单个细胞因子的局限性,目前对于该方药论治肝纤维化的分子机制仍有待进一步明确。因此,本研究借鉴网络药理学等技术手段,预测该中药复方抗肝纤维化的活性组分、靶标蛋白与信号通路,进一步结合前期研究基础,通过构建肝纤维化大鼠模型,分析该药物治疗肝纤维化的深层原理以及相关信号途径的参与情况,以期为该制剂临床潜在应用价值的开发提供理论参考,同时也为后续进行更深层次的实验研究提供支持。
1 材料
1.1 药物 化瘀软肝胶囊(原名化纤保肝方,由醋鳖甲、龟板、柴胡、枳壳、丹参、赤芍、炒白术组成),由甘肃中医药大学附属医院制剂中心提供。阳性对照药物秋水仙碱(规格0.5 mg/片,国字准药H53021369,西双版纳药业有限责任公司)。
1.2 动物 40 只SD 大鼠,体质量(180±20) g,雄性,购自兰州大学动物实验中心[实验动物生产许可证号SCXK(甘) 2018-0003,动物合格证号62000800000058]。饲养条件为温度22~25 ℃,相对湿度40%~60%,自然光照,动物实验经兰州大学生命科学学院伦理委员会批准执行。
1.3 试剂 LC3B、Beclin 1、Akt、p-Akt、GAPDH 一抗(美国ImmunoWay 公司,货号B8101、B2601、YT0178、YP006、B1501);α-SMA 一抗(武汉赛维尔生物科技有限公司,货号 GB11044);mTOR、p-mTOR 一抗 (美国GeneTex 公司,货号GTX132803、GTX101557);山羊抗IgG二抗(英国Abcam 公司,货号ab6721)。
1.4 仪器 Eclipse Ci-L 型显微镜(日本Nikon 公司);PANNORAMIC DESK/MIDI/250/1000 型全景切片扫描仪(匈牙利3DHISTECH 公司);DYCZ-40G 型转膜仪(北京六一生物科技有限公司);5424R 型高速冷冻离心机(德国Eppendorf 公司)。
2 方法
2.1 网络药理学
2.1.1 化瘀软肝胶囊活性成分筛选 利用中药系统药理学分析平台数据库 (https://tcmspw.com/tcmsp.php) 和BATMAN 数据库 (http://bionet.ncpsb.org.cn/batmantcm/index.php),以“鳖甲”“龟板” “柴胡” “枳壳” “丹参” “赤芍” “炒白术” 为关键词,生物利用度(OB) ≥30%、类药性(DL) ≥0.18 为标准,检索化瘀软肝胶囊活性成分。
2.1.2 预测化瘀软肝胶囊作用靶点与肝纤维化疾病靶点采用TCMSP、BATMAN 数据库进行药物成分靶点的预测,将所得结果存入“target.txt” 文件。使用Uniprot 数据库将所选的靶点基因转换为简称,删除重复或不匹配的基因名,得到“alltargetSymbol.txt” 基因注释文件。利用GeneCards数据库 (http://www.genecards.org/),OMIM 数据库(https://omim.org/) 检索“hepatic fibrosis” 相关信息,得到“Disease.txt” 疾病基因文件,构建药物与疾病靶点交集,获得化瘀软肝胶囊与肝纤维化的交集靶点文件“Drug-Disease”。
2.1.3 构建“药物-成分-靶点-疾病” 网络 将“2.1.2”项中筛选得到的药物和疾病的交集基因输入Cytoscape 3.7.2 软件中,构建“药物-成分-靶点-疾病” 网络图,借助cytoNCA 插件进行分析,同时通过相应的type 文件来标注节点属性,对于能够起到治疗作用的药物分子,则调整输出为molLists 文件。
2.1.4 蛋白相互作用网络的构建与分析 将“2.1.3” 项获得的药物-疾病交集靶基因数据导入STRING 11.0 软件(http://string-db.org),并将物种限定为“homosapiens”。选取置信度高于0.95 的数据,构建化瘀软肝胶囊的蛋白相互作用(PPI) 网络,依据网络的连通性、节点度等指标来评判相关基因的重要性;基于网络中基因与邻接基因的数目,准确筛选出拥有最多邻接基因的几个基因,这些基因即为目标核心基因。
2.1.5 GO 和KEGG 富集分析 将上述PPI 网络中的靶点蛋白汇总,使用R 语言bioconductor 包 (http://www.bioconductor.org/) 分别进行GO 功能分析与KEGG 通路富集分析,筛选结果进行可视化。
2.2 动物实验
2.2.1 造模 大鼠适应性喂养1 周后,随机分为空白组(6 只) 与造模组(34 只),造模组参考文献[7] 报道,采用复杂多因素方法复制肝纤维化大鼠模型。大鼠皮下注射40%四氯化碳(CCl4) 花生油溶液,首次注射量为0.5 mL/100 g,之后每次注射量为0.3 mL/100 g,每周2 次,持续8 周,同时给予高脂饲料和5%乙醇溶液;空白组大鼠则自由饮食(普通饲料)、饮水(纯水)。第8 周末,随机选取并处死模型组大鼠4 只,取出肝脏组织进行HE 染色、天狼猩红染色及病理程度评分,评价模型复制是否成功。
2.2.2 分组及给药 将造模成功的大鼠按随机数字表法分为模型组、秋水仙碱组和化瘀软肝胶囊低、中、高剂量组,每组6 只。各组大鼠给药剂量参照人与动物按体表面积折算[8],即化瘀软肝胶囊低、中、高剂量组灌胃给予0.031 5、0.063 0、0.094 5 g/mL (临床等效剂量的0.5、1、1.5 倍)化瘀软肝胶囊混悬液;秋水仙碱组灌胃给予0.2 mg/kg 秋水仙碱混悬液;空白组和模型灌胃给予1 mL/100 g 生理盐水,每天1 次,连续6 周。
2.2.3 取材与指标检测 给药结束后,大鼠禁食不禁水12 h,用0.3%戊巴比妥钠腹腔注射(1 mL/100 g) 进行麻醉,充分暴露腹腔,生理盐水肝脏灌注,肉眼观察组织变化为灰白色即可,取肝左叶外1/4 组织于4%多聚甲醛中固定,梯度乙醇脱水,石蜡包埋,切片,HE 染色观察肝脏组织形态学病理变化,采用Metavir 评分系统评价肝组织纤维化程度,评分标准见表1。Western blot 法检测肝组织p-Akt/Akt、p-mTOR/mTOR、Beclin-1、LC3B 蛋白表达。免疫荧光染色法检测肝组织α-SMA 蛋白表达。

表1 Metavir 评分标准
2.2.4 统计学分析 通过SPSS 24.0 软件进行处理,正态分布的计量资料以(±s) 表示,两组间比较采用t检验,多组间比较采用单因素方差分析,方差齐时选择LSD 法,方差不齐时选择Dunnett T3 法;不服从正态分布的数据采用非参数检验进行比较。计数资料以百分比表示,组间比较采用卡方检验,等级资料比较采用秩和检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 网络药理学分析
3.1.1 化瘀软肝胶囊活性成分筛选 通过TCMSP、BATMAN 数据库筛选得到化瘀软肝胶囊活性成分128 个,其中柴胡17 个,赤芍29 个,枳壳5 个,丹参65 个,鳖甲1 个,龟板6 个,炒白术5 个。
3.1.2 化瘀软肝胶囊与肝纤维化交集基因 经Uniprot 数据库基因注释后得到化瘀软肝胶囊活性成分靶点注释基因558 个;通过GeneCards 和OMIM 数据库检索得到5 301 个与肝纤维化相关的基因,取化瘀软肝胶囊与疾病的交集靶点,共获得367 个交集基因,见图1。

图1 药物成分与疾病的交集基因
3.1.3 “药物-成分-靶点-疾病” 网络 利用Cytoscape 3.7.2 绘制“药物-成分-靶点-疾病” 网络图,共含有664个节点和2 106 条边,涉及98 种活性成分和药物与疾病共有靶点367 个。通过CytoNCA 分析发现化瘀软肝胶囊排名前十的活性成分为苯丙氨酸、槲皮素、甲硫氨酸、β-谷甾醇、天冬氨酸、亮氨酸、豆甾醇、山柰酚、木犀草素、丹参酮ⅡA。
3.1.4 PPI 网络构建 PPI 网络图见图2,将结果导出并输入Cytoscape 3.8.0 软件进行拓扑参数分析,得出PPI 网络共23 个节点,111 条边,其中度值排名前十的靶蛋白为STAT3、JUN、MAPK1、MAPK3、TP53、IL6、RELA、TNF、FOS、MYC。
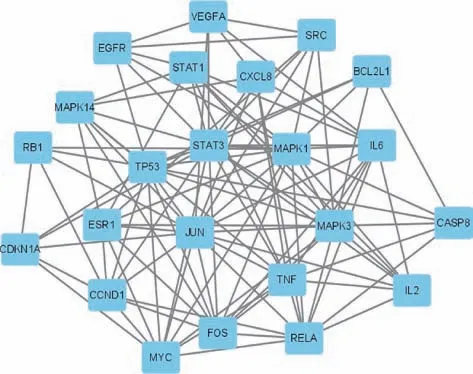
图2 化瘀软肝胶囊-肝纤维化共有靶点PPI 网络
3.1.5 GO 富集分析 将药物-疾病共同靶点输入R 语言bioconductor 包中,分别进行分子功能(molecular functions,MF)、生物途径功能(biological processes,BP)、细胞成分(cellular components,CC) 富集分析,取排名前十的条目制作条形图,见图3。可见靶点蛋白分子功能主要体现在儿茶酚胺键合、血红素结合、氧化还原酶活性,转录因子活性、核受体活性配体激活、有机酸结合、羧酸结合等方面;细胞成分主要包含囊腔、突触后膜、质膜筏、小凹、膜微结构域等;生物过程主要涉及活性氧代谢过程、腺发育、氧化应激反应、细菌源分子反应、营养水平反应、脂多糖反应、类固醇激素反应、金属离子反应等途径。
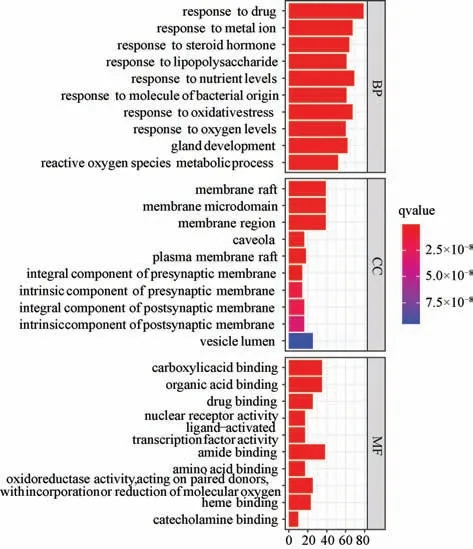
图3 “化瘀软肝胶囊-肝纤维化” 共同靶点的GO 分析
3.1.6 KEGG 通路分析 将药物-疾病共同靶点输入R 语言bioconductor 包中,选取P值较小,count 数较大的前30条通路,利用气泡图进行可视化,见图4,由此可知,化瘀软肝胶囊干预肝纤维化的作用途径主要涉及PI3K-Akt 信号通路、MAPK 信号通路及糖尿病并发症中的AGE-RAGE信号通路等。

图4 “化瘀软肝胶囊-肝纤维化” 共同靶点的KEGG 分析
3.2 动物实验
3.2.1 化瘀软肝胶囊对肝纤维化大鼠胶原纤维的影响 光镜下观察血管壁胶原纤维呈红色,细胞核呈绿色,其他成分呈黄色。如图5 所示,空白组少量红色胶原纤维仅局限于汇管区位置,属正常含量范围;模型组各型血管壁胶原纤维自汇管区向外扩展,已逐渐形成假小叶,破坏正常肝组织构架与血流分布。

图5 各组大鼠肝组织天狼猩红染色
3.2.2 化瘀软肝胶囊对肝纤维化大鼠肝组织病理改变的影响 如表2 所示,空白组大鼠全部处于病变程度0 分区域;模型组大鼠半数以上处于病变程度3 分区域,病理损伤明显;秋水仙碱组大鼠多数处在1 分区域;化瘀软肝胶囊组大鼠病变程度缓解情况散在分布于2、3 分区域,以高剂量组效果为佳,提示化瘀软肝胶囊能够不同程度改善肝纤维化模型大鼠纤维化程度。

表2 各组大鼠肝组织纤维化程度分级分布
如图6 所示,空白组肝组织被膜由厚薄均匀的富含弹性纤维致密结缔组织构成,肝小叶中央为中央静脉,周围是大致呈放射状排列的肝细胞和肝血窦;与空白组比较,模型组大鼠肝组织中央静脉周围大量肝细胞脂肪变性,胞质内可见微小的圆形空泡,静脉周围结缔组织增生,不同静脉间互相连接,形成纤维桥接,并可见炎性细胞浸润;与模型组比较,各给药组大鼠肝脏胶原纤维增生不同程度减轻,伴见少量淋巴细胞浸润,以化瘀软肝高剂量组改善明显。

图6 各组大鼠肝组织HE 染色(×200)
3.2.3 化瘀软肝胶囊对肝纤维化大鼠肝组织PI3K/Akt/mTOR 信号通路相关蛋白表达的影响 如图7 所示,与空白组比较,模型组p-Akt/Akt、p-mTOR/mTOR 蛋白表达降低(P<0.01);与模型组比较,化瘀软肝胶囊低剂量组p-Akt/Akt、p-mTOR/mTOR 蛋白表达无明显变化(P>0.05),秋水仙碱组和化瘀软肝胶囊中、高剂量组p-Akt/Akt、pmTOR/mTOR 蛋白表达升高(P<0.01)。

图7 各组大鼠肝组织p-Akt/Akt、p-mTOR/mTOR 蛋白表达(±s,n=6)
3.2.4 化瘀软肝胶囊对肝纤维化大鼠肝组织α-SMA 蛋白表达的影响 如图8 所示,与空白组比较,模型组大鼠肝组织中肝星状细胞活化标志物α-SMA 表达升高;与模型组比较,各给药组大鼠肝组织α-SMA 表达有不同程度降低,表明化瘀软肝胶囊干预肝纤维化大鼠的作用机制与阻碍HSC 活化有关。

图8 各组大鼠肝组织α-SMA (红色) 蛋白表达(×400)
3.2.5 化瘀软肝胶囊对肝纤维化大鼠肝组织肝组织Beclin-1、LC3B 蛋白表达的影响 如图9、表3 所示,与空白组比较,模型组大鼠肝组织自噬相关蛋白Beclin-1、LC3B 表达升高(P<0.01),提示模型组大鼠体内存在高通量自噬;与模型组比较,各给药组大鼠肝组织Beclin-1、LC3B 蛋白表达降低(P<0.01),尤其以高剂量组改善最明显。

图9 各组大鼠肝组织Beclin-1、LC3B 蛋白条带图
表3 各组大鼠肝组织Beclin-1、LC3B 蛋白表达比较(±s,n=6)

表3 各组大鼠肝组织Beclin-1、LC3B 蛋白表达比较(±s,n=6)
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01。
组别LC3-B/GAPDHBeclin-1/GAPDH空白组1.00±0.001.00±0.00模型组1.97±0.07##2.66±0.02##秋水仙碱组1.20±0.11**1.31±0.04**化瘀软肝胶囊低剂量组1.73±0.16**2.32±0.04**化瘀软肝胶囊中剂量组1.46±0.08**1.56±0.03**化瘀软肝胶囊高剂量组1.12±0.17**1.09±0.03**
4 讨论
中医药论治肝纤维化注重“整体观念” 与“辨证论治” 相结合,基于生物信息系统观的网络药理学,打破传统单一作用成分-个别作用靶点-某个细胞因子的研究局限,丰富了中药复方制剂“多点显效、协同增效” 的科学内涵[9]。本研究通过检索与整合特定数据库,筛选出化瘀软肝胶囊有效成分128 个,药物与疾病共有靶点367 个,蛋白相互作用PPI 网络筛选出核心靶点23 个。富集分析结果表明,化瘀软肝胶囊抗肝纤维化作用主要通过调控PI3KAkt 信号通路、MAPK 信号通路等途径实现,这与中药复方制剂多成分、多途径及多靶点的疾病干预性特点高度契合。
肝纤维化是肝硬化的病理改变基础,肝硬化是肝纤维化形成典型假小叶的结果[10]。通过调节肝星状细胞的增殖、分化、炎症、自噬及凋亡,来逆转或阻断这一进程对于肝病的防治研究具有重要意义。细胞自噬一词最早来源于古希腊语,即细胞发生自我吞噬以维持细胞内稳态[11]。Mizushima[12]研究发现HSC 的自噬可以促进肝纤维化的进程。另外HSC 细胞质中含有大量脂滴[13],HSC 自噬可能促进了脂滴分解成游离脂肪酸,为其激活、分化及分泌ECM提供足够的能量,进而促进肝纤维化。以上研究提示,通过调控自噬,抑制HSC 的激活和增殖,可作为抗肝纤维化的有效策略之一。
自噬过程可分为自噬体的形成、延长、自噬体与溶酶体融合以及降解4 个阶段,且这一进程受到多种自噬相关基因的调节[14]。自噬关键分子酵母Atg6 同系物(Beclin-1)与微管相关蛋白1 轻链3 (LC3B) 均参与自噬体的形成过程,并对自噬的启动及进展发挥重要调控作用,越来越多的证据指出Beclin-1 与LC3-B 是自噬的标志性蛋白,可以反应自噬水平[15]。α-平滑肌肌动蛋白(α-SMA) 作为HSC激活的标志性蛋白且与肝纤维化有高度的相关性[16]。本实验结果显示,与空白组比较,模型组大鼠肝组织病理改变,纤维胶原沉积,组织纤维化程度严重。HSC 是肝纤维化的细胞学基础,是肝纤维化的效应细胞,其激活和增殖介导了肝纤维化的病理发展。本实验结果显示,模型组大鼠肝组织中HSC 活化标志物α-SMA 蛋白高表达,间接表明HSC发生表型转化并启动过度激活效应;模型组大鼠肝组织LC3-B、Beclin-1 蛋白表达升高,提示肝纤维化大鼠体内存在高通量自噬,进一步证明病理状态下的自噬诱导HSC 活化,促进细胞外基质沉积并造成肝纤维化。而经各药物干预后,这一结果得到不同程度的逆转,可见化瘀软肝胶囊干预肝纤维化的作用与阻碍HSC 活化、抑制细胞自噬有关。安祯祥等[17]研究发现,扶脾柔肝方能干预纤维组织增生,改善肝功能,其抗肝纤维化机制可能与下调Beclin-1、LC3-B 蛋白的表达,抑制细胞自噬功能相关。
PI3K/Akt/mTOR 是调控自噬相关通路中最经典的一条且主要起负调节作用[18]。Akt 是一种丝氨酸(Ser)/苏氨酸(Thr) 蛋白激酶,Akt 磷酸化主要受到上游蛋白激酶PI3K 的调控,而活化的Akt 进一步激活下游靶蛋白mTOR,启动细胞自噬抑制效应[19]。已有研究表明,采用炎症诱导剂脂多糖(LPS) 诱导HSC-T6 细胞发生自噬与PI3K/Akt/mTOR 信号通路有关,而人参皂苷Rg3 抑制HSC-T6 细胞存活的机制可能与其激活了这一信号级联反应有关[20]。因此,本研究结合网络药理学KEGG 分析结果,探索PI3K/Akt/mTOR 信号通路是否为化瘀软肝胶囊通过调控细胞自噬来发挥抗肝纤维化的作用途径。本研究结果表明,与空白组比较,模型组大鼠肝组织p-Akt/Akt、p-mTOR/mTOR 蛋白表达降低,可见这一信号级联反应处于功能抑制状态;而各药物干预后,该信号通路关键分子的蛋白磷酸化水平不同程度升高,进一步激活下游靶蛋白发挥生物效应并开放信号反馈通路,提示化瘀软肝胶囊发挥抑制细胞自噬的作用可能与激活这一自噬负调节器有关。
综上所述,本研究基于网络药理学预测化瘀软肝胶囊干预肝纤维化的多成分-多靶点-多通路的效应机制;进一步结合动物实验模型验证发现,化瘀软肝胶囊干预肝纤维化大鼠的作用主要与激活PI3K/Akt/mTOR 信号通路,抑制细胞自噬,阻碍HSC 活化有关,揭示了“疏肝化瘀法” 的微观分子生物学基础,为中药复方制剂论治肝纤维化提供新思路与新方法。

