中华蹄盖蕨黄酮提取纯化工艺优化及其成分分析
郭春燕,胡建燃,李 平,安 婕,张峰碧
(1.晋中学院生物科学与技术系,山西 晋中 030619;2.晋中学院山西特色植物资源应用研究中心,山西 晋中 030619)
中华蹄盖蕨AthyriumsinenseRupr.为蹄盖蕨科、蹄盖蕨属植物,生于海拔1 500~2 000 m 山谷林下,在我国华北、东北、西北等地均有分布,以其根茎及叶柄残基入药,具有清热解毒、止血、杀虫等功效[1]。随着人们对蕨类植物化学成分的深入研究,发现其主要活性成分为酚类,其中黄酮类化合物具有极强的抗氧化活性,可以清除人体内的自由基,延缓衰老、预防疾病,除此之外,还具有抗病毒、抗肿瘤、免疫激活等多种药理作用,其在药品、食品行业开发应用潜力巨大[2-3]。
目前,有关蹄盖蕨科植物的研究报道相对较少,主要集中在物种分类、区系、资源调查、形态结构与栽培方面,其中仅对猴腿蹄盖蕨[4-5]等少数蹄盖蕨科植物进行了活性成分提取与分析,还未见中华蹄盖蕨黄酮提取及其组分分析的相关研究。因此,本研究以黄酮得率作为指标,利用单因素和正交试验对中华蹄盖蕨黄酮进行提取,获得最佳的提取条件,并在对提取到的黄酮进行最佳纯化的基础上,采用UPLC-Q-TOF-MS 法对其黄酮成分进行检测与分析,以期为中华蹄盖蕨的深度开发利用提供技术支撑。
1 材料
中华蹄盖蕨采自山西省吕梁市交城县庞泉沟国家级自然保护区,经晋中学院生物科学与技术系植物实验室专家鉴定为正品,阴干至恒重后经微型植物粉碎机粉碎,过60目筛,装入密封袋中备用。芦丁对照品(纯度>98%,中国食品药品检定研究院)。60~90 目聚酰胺树脂(江苏长丰化工有限公司);NaNO2、Al (NO3)3、NaOH、无水乙醇、α-萘酚、镁粉、盐酸为分析纯(天津市申泰化学试剂有限公司);甲酸、乙腈、甲醇为色谱纯(美国Thermo Fisher公司);水为超纯水。
XS105 分析天平(瑞士梅特勒-托利多公司);AK-060S超声波清洗机(深圳市钰洁清洗设备有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);RE-300V 旋转蒸发仪(上海亚荣生化仪器厂);ROB50 纯水仪;Neofuge 13R 高速冷冻离心机[力康国际贸易(上海)有限公司];Evolution 260 Bio 紫外分光光度计 (美国Thermo 公司);安捷伦1290 Infinity 超高效液相色谱仪、安捷伦6545 UHD and Accurate-Mass Q-TOF 质谱仪(美国安捷伦公司)。
2 方法
2.1 黄酮含量测定
2.1.1 对照品溶液制备 准确称取芦丁对照品20 mg,95%乙醇定容至100 mL,摇匀,得到质量浓度为200 μg/mL 的溶液,即得。
2.1.2 吸光度测定 吸取对照品溶液2 mL 至10 mL 试管中,加纯净水至5 mL,向试管中加入0.3 mL 5% NaNO2溶液,摇匀,静置6 min,加入0.3 mL 10% Al (NO3)3溶液,摇匀,静置6 min,加入4.4 mL 4% NaOH 溶液,摇匀,静置12 min,以溶剂为空白,在400~600 nm 波长范围内扫描,确定最大吸收波长510 nm 作为检测波长。
2.1.3 标准曲线绘制 向20 mL 试管中加入0、1、2、3、4、5 mL 芦丁对照品,依次加入纯净水、NaNO2溶液、Al (NO3)3溶液、NaOH 溶液,在510 nm 波长处测定吸光度。以对照品质量浓度为横坐标(X),吸光度为纵坐标(A) 进行回归,得方程为A=0.002 9X+0.003 (R2=0.999 2),在0~100 μg/mL 范围内线性关系良好。
2.2 黄酮提取 称取1.000 g 中华蹄盖蕨粉末至三角瓶中,按比例加入一定体积分数乙醇,超声(功率380 W) 处理一定时间,待三角瓶中溶液冷却后,用布氏漏斗抽滤保留滤液,离心弃去沉渣,记录所得上清液的体积,测定吸光度,计算得率,公式为得率=(提取液中黄酮质量浓度×体积×稀释倍数/质量) ×106×100%。
2.2.1 单因素试验 在预实验基础上,设定单因素固定水平为料液比1 ∶20,乙醇体积分数60%,超声温度50 ℃,超声时间30 min;单因素不同水平为料液比1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30,乙醇体积分数40%、50%、60%、70%、80%,超声温度40、50、60、70、80 ℃,超声时间10、20、30、40、50 min。
2.2.2 正交试验 根据单因素试验结果,以乙醇体积分数(A)、超声温度(B)、超声时间(C)、料液比(D) 为影响因素,每个因素3 个水平,釆用L9(34) 正交表,因素水平见表1。

表1 因素水平
2.2.3 验证试验 取中华蹄盖蕨60 目干燥粉末3 份,按正交试验所得最优工艺进行提取,测定提取液中黄酮质量浓度,计算得率。
2.3 黄酮纯化
2.3.1 纯化步骤 按照最优工艺提取黄酮,将提取液制成2 mg/mL 溶液。取2.0 g 己预处理好的60~90 目聚酰胺树脂,湿法装入层析柱中,使树脂表面平齐。缓慢加入上样液,用纯净水清洗至流出液不带有颜色,采用Molish 反应判断清洗终点;再用乙醇洗脱,采用盐酸-镁粉反应判断洗脱终点[6],收集洗脱液,在510 nm 波长处测定吸光度,计算黄酮回收率,公式为回收率=[(洗脱液中黄酮质量浓度×洗脱液体积)/(上样液中黄酮初始质量浓度×上样液体积)] ×100%。
2.3.2 纯化条件 取2.0 g 己预处理好的60~90 目聚酰胺树脂,湿法装柱,取2 mg/mL 上样液25 mL,pH 值为5,缓慢上样,控制体积流量为2.0 BV/h,接取流出液,每5 mL为1 份,共5 份,在紫外分光光度计上测定吸光度,计算黄酮含量[7]。
在预实验基础上,设定单因素固定水平为上样液pH值5,上样液质量浓度2 mg/mL,洗脱溶剂60%乙醇,洗脱体积流量2.0 BV/h;单因素不同水平为上样液pH 值3、4、5、6、7,上样液质量浓度1、2、3、4、5 mg/mL,洗脱溶剂50%、60%、70%、80%、90%乙醇,洗脱体积流量1.0、1.5、2.0、2.5、3.0 BV/h。
2.3.3 验证试验 取上样液3 份,按最优工艺进行分离纯化,计算回收率。
2.4 黄酮成分测定
2.4.1 样品提取方法 取100 μL 纯化后的黄酮提取液至EP 管中,加入300 μL 甲醇(含5 μg/mLL-2-氯-苯丙氨酸作为内标),涡旋1 min,4 ℃、13 000 r/min 离心10 min,取上清液。
2.4.2 UPLC-Q-TOF-MS 分析条件
2.4.2.1 色谱 Waters XSelect HSS T3 色谱柱(2.1 mm×100 mm,2.5 μm);流动相0.1%甲酸水(A)-0.1%甲酸乙腈 (B),梯度洗脱 (0~2 min,95% A;5.0 min,65%A;15~17 min,35% A;25~30 min,0);体积流量0.35 mL/min;柱温40 ℃;进样量5 μL。
2.4.2.2 质谱 气体温度325 ℃;干燥气体积流量10 L/min;雾化器压力20 psi (1 psi=6.895 kPa);毛细电压3 500 V;碎裂电压120 V;skimmer 电压45 V;采集范围m/z100~3 000。
2.4.3 化合物定性与定量分析 基于自建数据库及化合物信息公共数据库,对质谱检测的一级谱、二级谱数据进行定性分析。化合物结构解析参考HMDB[8]、PubChem、METLIN[9]等已有的质谱公共数据库。
化合物定量是在获得不同样本的化合物质谱分析数据后,在R 软件平台下,使用XCMS 程序包进行峰的识别,对所有物质质谱峰进行峰面积积分,并对其中同一代化合物在不同样本中的质谱出峰进行积分校正[10]。
2.5 数据处理 采用SPSS 17.0 软件对数据进行ANOVA显著性差异分析(P<0.05),平行3 次,数据以(±s)表示。
3 结果
3.1 黄酮提取单因素试验 结果见图1。

图1 单因素试验结果
当料液比为1 ∶10~1 ∶25 时,随着乙醇体积增加,黄酮溶解度、得率升高;当料液比小于1 ∶25 时,黄酮得率提高缓慢,说明乙醇过多时可能造成水溶性大极性杂质大量析出,从而影响其得率[11]。
黄酮得率随着乙醇体积分数增加而升高,为60%时最高。虽然乙醇体积分数增加有利于黄酮的浸出,但过高时会降低极性大的化合物溶解度,并且有可能将脂溶性物质提取出来,从而影响其得率[12]。
黄酮得率随着超声温度增加而升高,为60 ℃时最高,超过60 ℃时反而逐渐降低,说明温度对黄酮化合物的影响很大,当温度过低时,黄酮浸出率低,会造成提取不完全;温度过高时,会破坏黄酮类化合物的结构,从而影响其得率[13]。
随着超声时间延长,黄酮得率先升后降,为30 min 时最高。虽然延长提取时间有利于植物细胞壁的分解,黄酮会大量浸出而提高得率,但过长时会导致植物细胞中多糖、蛋白质析出,导致黄酮分解,从而影响其得率[14]。
3.2 黄酮提取正交试验 结果见表2,各因素影响程度依次为D>A>C>B,即料液比最大,超声温度最小;最优工艺为A2B2C1D3,即料液比1 ∶35,乙醇体积分数60%,超声温度60 ℃,超声时间20 min。
表2 试验设计与结果(±s)
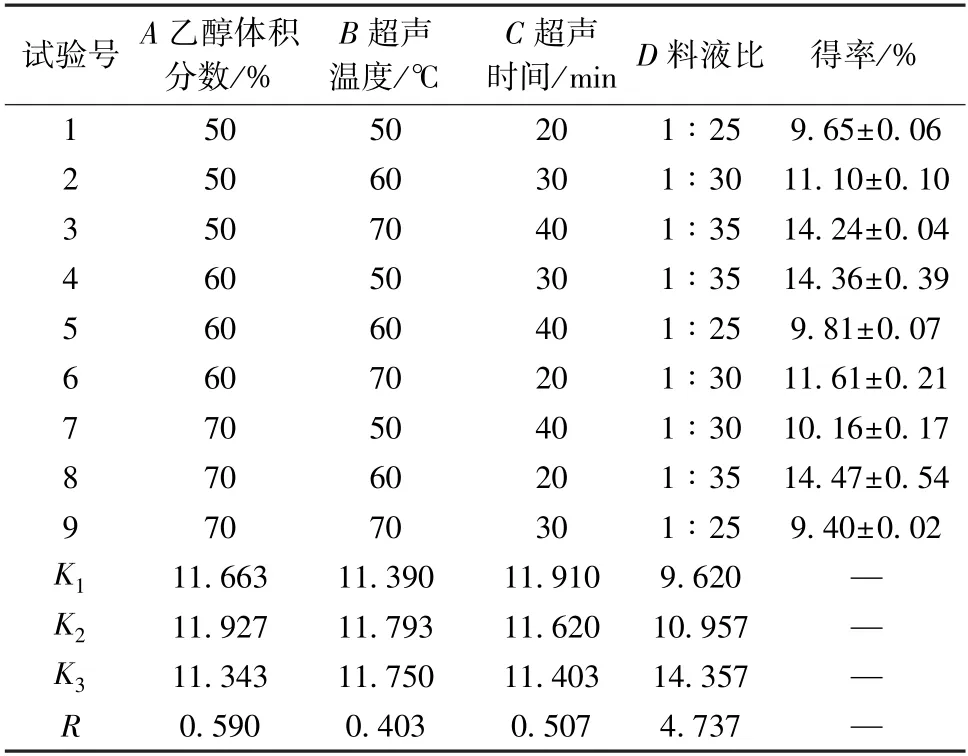
表2 试验设计与结果(±s)
试验号 A 乙醇体积分数/%B 超声温度/℃C 超声时间/min D 料液比 得率/%15050201 ∶259.65±0.06 25060301 ∶30 11.10±0.10 35070401 ∶35 14.24±0.04 46050301 ∶35 14.36±0.39 56060401 ∶259.81±0.07 66070201 ∶30 11.61±0.21 77050401 ∶30 10.16±0.17 87060201 ∶35 14.47±0.54 97070301 ∶259.40±0.02 K111.66311.39011.9109.620—K211.92711.79311.62010.957—K311.34311.75011.40314.357—R0.5900.4030.5074.737—
3.3 验证试验 精密称取中华蹄盖蕨60 目干燥粉末1.000 g各3 份,按优化工艺进行提取,测得其黄酮得率为15.01%,可知该工艺稳定可行,重复性好,见表3。

表3 提取工艺验证试验结果(n=3)
3.4 黄酮纯化 首先对其黄酮水溶液(上样液) 在层析柱上的泄露情况进行初步试验,测定流出液中黄酮质量浓度,进而计算泄漏量。如图2 所示,当上样量达到10 mL时,流出液中含有微量黄酮,说明2.0 g 处理好的60~90目聚酰胺树脂已达到饱和状态,如果继续增加上样量会造成其大量损失。因此,2 mg/mL 黄酮溶液在该条件下的最佳上样量为10 mL。
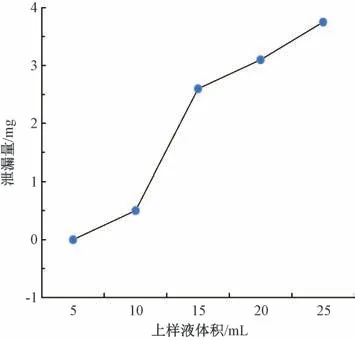
图2 黄酮泄露曲线
在上样液体积10 mL,处理好的聚酰胺树脂用量2.0 g条件下,分别对上样液pH 值、上样质量浓度、乙醇体积分数、洗脱体积流量进行考察,结果见图3。
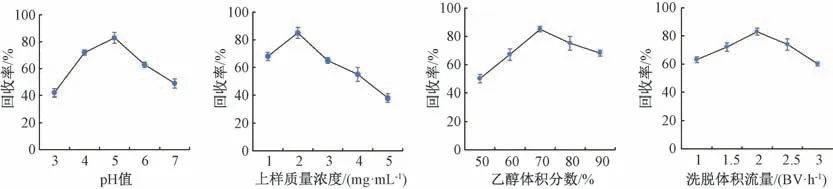
图3 各因素对中华蹄盖蕨黄酮回收率的影响
黄酮回收率随上样液pH 值增加而先升后降,当pH 值为3~4 时,由于黄酮类化合物在强酸条件下可能会转变为佯盐,不利于聚酰胺树脂的吸附[15],因此其回收率较低。当pH 值(pH>5) 高于黄酮类化合物的pKa值时,它大多以盐的形式存在,不易被吸附,回收率降低;当pH 值为5时,黄酮类化合物以游离形式存在,易被吸附,回收率高。
当上样质量浓度低于2 mg/mL 时,黄酮被充分吸附在聚酰胺树脂上,不利于后期洗脱,导致其回收率较低;为2 mg/mL时,聚酰胺树脂吸附饱和,黄酮回收率最高;大于2 mg/mL 时,黄酮不能完全被吸附[16],用纯净水冲洗时不仅除去了上样液中的杂质,也会将未被吸附的该成分除去,致使其回收率下降。
黄酮回收率随着乙醇体积分数增加而升高,为70%时最高,此时黄酮极性与70%乙醇相近,有利于其从聚酰胺树脂上解吸下来[17];但超过70% 时会将大量杂质洗脱下来,导致黄酮回收率有所下降。
当洗脱体积流量为2.0 BV/h 时,黄酮回收率最高;当其加快或减慢时,该成分回收率较低。体积流量缓慢时,洗脱力度不够;体积流量太快时,洗脱时间缩短,黄酮未能被乙醇洗脱下来,导致其回收率降低[18]。
综上所述,最优纯化工艺为上样液pH 值为5,上样质量浓度2 mg/mL,70%乙醇洗脱,洗脱体积流量2.0 BV/h。
3.5 黄酮纯化条件的验证 取10 mL 2 mg/mL 上样液各3份,按优化工艺在装有2.0 g 处理好的聚酰胺树脂层析柱上进行验证试验,结果见表4,可知该工艺稳定可行。另外,纯化后的溶液经减压浓缩、冷冻干燥后,粉末中黄酮含量为70.32%,比纯化前提高25.64%。

表4 纯化工艺验证试验结果(n=3)
3.6 黄酮成分分析 在负离子模式下,黄酮类化合物得到了较好的分离,见图4,结合质谱数据鉴定出其中9 个色谱峰所对应的化合物。由表5 可知,中华蹄盖蕨含有针依瓦菊素、没食子儿茶素、樱桃苷-4″,6″-二-O-没食子酸酯、槲皮素-7-O-葡萄糖苷、黄芪黄酮、棕鳞矢车菊黄酮素、洋槐黄素、3-羟基-8,9-二甲氧基香豆雌酚、肉豆蔻酚C 这9 种黄酮类化合物,其中黄芪黄酮、针依瓦菊素、槲皮素-7-O-葡萄糖苷含量较高。

图4 中华蹄盖蕨黄酮TIC 色谱图
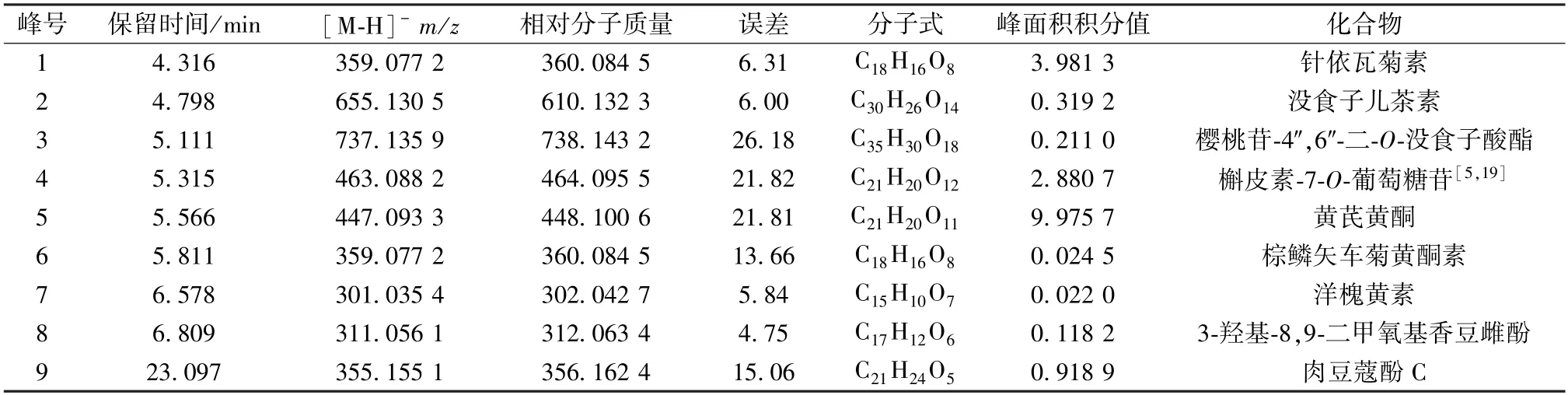
表5 中华蹄盖蕨黄酮鉴定结果
4 讨论
本研究采用超声波辅助乙醇法对中华蹄盖蕨黄酮进行提取,在最佳提取条件下,中华蹄盖蕨黄酮的得率为15.01%。本实验结果与同属猴腿蹄盖蕨黄酮得率接近[20],表明该提取方法及条件准确、可行。黄酮提取液经聚酰胺树脂层析纯化后,所得干粉中黄酮纯度提高了25.64%,说明聚酰胺树脂对中华蹄盖蕨黄酮具有良好的吸附性,可有效纯化其黄酮。超声波辅助乙醇提取法与聚酰胺树脂纯化法不仅具备操作简单、设备成本低、效率高、稳定性佳等优点,而且所得黄酮产品纯度高,无重金属、有机溶剂等毒性物质的残留[21]。从结果来看,这2 种方法是目前黄酮提取纯化较好的方法。
UPLC-Q-TOF-MS 法对复杂样品具有高分离能力、高选择性、高灵敏度、可提供相对分子质量与结构信息等优点,被广泛应用于化学成分的解析中[22-23]。本研究首次采用该技术分析中华蹄盖蕨黄酮的主要成分。通过色谱的分离及质谱的检测,鉴定出中华蹄盖蕨9 个色谱峰的化学成分,其中黄芪黄酮、针依瓦菊素、槲皮素-7-O-葡萄糖苷含量较高。由于蕨类植物活性成分相关研究较少,目前仅发现猴腿蹄盖蕨、剑叶凤尾蕨和阔叶凤尾蕨含有槲皮素-7-O-葡萄糖苷,其他8 种黄酮类化合物未见报道。中华蹄盖蕨黄酮成分复杂,还有待于进一步的深入解析。

