健脾祛湿膏对肝郁脾虚型腹泻型肠易激综合征大鼠的作用
谢翔雨,卢 琴,甘剑峰,卢淑婷,熊 维,杨惠霏,何国栋,黄育生,唐洪梅
(1.广州中医药大学第一临床医学院,广东 广州 510405;2.广州中医药大学岭南医学研究中心,广东 广州 510405;3.广州中医药大学第二临床医学院,广东 广州 510120;4.广州中医药大学青蒿研究中心,广东 广州 510405;5.广州中医药大学第一附属医院,广东 广州 510405)
肠易激综合征(diarrhea-predominant irritable bowel syndrome,IBS-D) 临床表现为腹痛腹泻伴随情绪失调,病情迁延难愈,我国患病率约10%,在医学生、护士等人群中患病率甚至高达30%[1-2],严重降低了患者的生活质量,增加了医疗负担。IBS-D 病因复杂,通常认为它与情志失调、肠道菌群改变、肠道通透性提高、肠道低度免疫激活[1,3]等相关。
健脾祛湿膏是由四君子汤、四逆散、葛根芩连汤等经典名方加减化裁而来的经验方,具有健脾祛湿、疏肝解郁之效。该膏方疗效确切,是广州中医药大学第一附属医院临床上常用于治疗肝郁脾虚泄泻的经验方。课题组前期研究表明,健脾祛湿膏能够改善脾虚腹泻模型大鼠的脾虚状态,降低结肠炎症水平[4-5]。本研究通过复制肝郁脾虚型IBS-D 大鼠模型,观察健脾祛湿膏对IBS-D 大鼠的作用,及其对5-HT 受体、紧密连接蛋白表达和cGAS-STING通路的影响,探讨其可能的作用机制,以期为健脾祛湿膏临床应用提供实验依据。
1 材料
1.1 动物 SPF 级SD 大鼠,购于广州中医药大学动物实验中心 [实验动物生产许可证号SCXK(粤) 2018-0034],饲养于广州中医药大学第一附属医院SPF 级动物房[实验动物使用许可证号SYXK (粤) 2018-0092],实验经动物伦理委员会审批通过(伦理号TCMF1-2021042)。饲养环境为温度(24±2)℃,相对湿度55%~68%,昼夜节律12 h/12 h,自由进食进水。
1.2 药物与试剂 健脾祛湿膏(广州中医药大学第一附属医院,批号20210707),加适量蒸馏水于研钵中研匀,配成237 g/L 的溶液;匹维溴铵(法国Abbott Healthcare SAS 公司,批号714641);补脾益肠丸 (华润三九医药股份有限公司,批号2109004H)。冰醋酸(天津市大茂化学试剂厂,货号DJDM000091);舒泰[法国维克公司,进口兽药注册证号(2015) 外兽药证字43 号];大鼠β干扰素ELISA 试剂盒(江苏酶免实业有限公司,货号MM-61514R1);RIPA 裂解液、PMSF、BCA蛋白浓度测定试剂盒、BSA 封闭液、一抗稀释液、二抗稀释液、二抗羊抗兔/羊抗鼠(北京兰杰柯科技有限公司,货号BL504A、BL507A、BL521A、BL535A、BL506A、BL536A、BL003A/BL001A);STING、p-TBK1 抗体[艾比玛特医药科技(上海)有限公司,货号TD12090、T58364S];Claudin-1、TBK1 抗体(美国Proteintech 公司,货号28674-1-AP、67211-1-Ig);ZO-1 抗体(武汉博士德生物工程有限公司,货号PB9234);β-tubulin、GAPDH抗体 (美国 Affinity 公司,货号 AF7011、AF7021);彩色预染蛋白质marker、超敏ECL 化学发光试剂盒(上海碧云天生物技术有限公司,货号P0068、P0018S);RNA 提取试剂 (TRIzol)、RNA 逆转录试剂盒、SYBR Green q-PCR 试剂盒(湖南艾科瑞生物工程有限公司,货号AG21102、AG11706、AG11701)。
1.3 仪器 Multiskan GO 型全波长酶标仪、QuantStudioTM5 型实时荧光定量PCR 仪、Veriti 型梯度PCR 仪(美国Thermo Fisher Scientific 公司);ChemiDoc MP 型全能型凝胶成像系统、165-8001 型垂直板电泳槽 (美国Bio-Rad 公司);GeneSpeed冷冻离心机 (香港基因有限公司);Pannoramic MIDI 型数字病理切片扫描仪(匈牙利3Dhistech 公司);TS-2 型摇床(海门市其林贝尔仪器制造有限公司);AL1240 型电子天平(瑞士梅特勒-托利多公司)。
2 方法
2.1 IBS-D 模型复制 参照课题组前期研究[6-7]复制IBS-D 模型大鼠,第1~14 天,将SD 大鼠乳鼠每日上午9 时与母鼠分离3 h。第15~28 天,将乳鼠倒置,把润滑后的直肠给药管伸入乳鼠肛门4 cm处,以0.087 mol/L 醋酸0.2 mL 灌肠,每隔1 d 增加0.1 mL,直至灌肠体积为0.5 mL 后保持不变。灌肠后随即用医用胶带束缚大鼠上肢,每天束缚2 h。第29 天后停止醋酸刺激2 周,但仍每天束缚大鼠2 h,直至第43 天。
2.2 分组与给药 第43 天(大鼠6 周龄时),将模型复制成功的大鼠随机分为模型组、补脾益肠丸组(1.89 g/kg)、匹维溴铵组(15.8 mg/kg) 和健脾祛湿膏低、高剂量组(2.1、4.2 g/kg,分别相当于临床等效剂量1、2 倍),连同实验最初随机抽取的空白组(灌肠时以等量生理盐水代替,但不进行母婴分离和束缚操作) 一共6 组,每组8只,雌雄各半,按照10 mL/kg 给药量进行灌胃,共给药14 d (空白组给予蒸馏水)。
2.3 动物行为学考察
2.3.1 粪便含水量测定 参照文献[6] 报道方法,末次给药2 h 后,用5 mL EP 管收集每只大鼠粪便,称定质量,即为湿重;置于60 ℃烘箱中干燥至恒重,称定质量,即为干重,计算粪便含水率,公式为粪便含水率=[(粪便湿重-粪便干重)/粪便湿重] ×100%。
2.3.2 大鼠肠道疼痛阈值测定 将大鼠置于自制的玻璃容器内,将6F 导尿管一端用润滑油擦拭后,插入大鼠肛门约6 cm 处,用医用胶带将导尿管与大鼠尾巴根部固定,另一端与充满水的1 mL 注射器相连接。待大鼠情绪稳定后,缓慢推动注射器,当大鼠腹部肌肉强烈收缩并抬离桌面时,停止推动,并记录此时的注水量。
2.3.3 糖水偏好值测定 参照文献[6] 报道方法,在给药的第12~14 天,于前1 天晚上将大鼠禁食禁水12 h,第2 天早上9 时给予每笼大鼠已称重的1%蔗糖水和蒸馏水各1 瓶,1 h 后取下再次称重,计算糖水偏好值,公式为糖水偏好值=[消耗的糖水重/(消耗的糖水+消耗的蒸馏水)] ×100%。
2.4 样本收集 给药结束后,使用20 mg/mL 舒泰(0.3 mL/kg) 麻醉大鼠,随后颈椎脱臼处死。收集各组大鼠远端结肠,剪取约1 cm 结肠组织置于4%多聚甲醛溶液中常温放置,其余结肠组织装于冷冻管中,于-80 ℃冰箱中保存;另取脾脏,称重,计算脾脏系数,公式为脾脏系数=(脾脏质量/大鼠质量) ×100%。
2.5 HE 染色观察结肠组织病理形态 取于4%多聚甲醛溶液中固定的结肠组织,PBS 冲洗,依次在浓度梯度的乙醇中脱水,二甲苯透明,于石蜡中包埋,切片,二甲苯脱蜡,苏木素-伊红 (HE) 染色,脱水后用中性树胶封片,在切片扫描仪下进行扫描和观察。
2.6 ELISA 法检测结肠组织IFN-β 水平 取结肠组织50 mg,加入预冷的PBS 450 μL,于冰上剪碎后匀浆,4 ℃、12 000 r/min 离心20 min,取上清液,按照BCA 试剂盒说明书测定结肠组织蛋白浓度,再按照ELISA 试剂盒说明书检测结肠组织IFN-β 水平。
2.7 RT-qPCR 法检测结肠组织5-HT1A、5-HT2A、TNF-α、Claudin-1、ZO-1、cGAS、STINGmRNA 表达 取结肠组织100 mg,加TRIzol 1 mL,剪碎后匀浆,以TRIzol 法提取总RNA,测定RNA 浓度后,按照逆转录试剂盒说明书操作步骤将总RNA逆转录为cDNA,置于-20 ℃保存备用。临用时将cDNA 加DEPC 水稀释20 倍后备用,反应体系为10 μL (SYBR Green 5 μL,正向引物、反向引物、ROX 各0.2 μL,稀释后的cDNA 4.4 μL),按照说明书设定程序进行qPCR 反应。所有引物通过NCBI 网站进行设计,由广州昂科生物技术有限公司合成,引物序列见表1。以β-actin为内参,通过2-ΔΔCT法计算各基因的mRNA 相对表达量。

表1 引物序列Tab.1 Primer sequences
2.8 Western blot 法检测结肠组织Claudin-1、ZO-1、cGAS-STING 通路相关蛋白表达 取结肠组织100 mg,加入RIPA 裂解液(含PMSF) 200 μL,剪碎后匀浆,后将裂解液补足至1 mL,于冰上裂解30 min,4 ℃、12 000 r/min 离心10 min,取上清液,按照BCA 试剂盒说明书测定蛋白浓度,取部分上清液加入Loading Buffer 配成3 μg/μL 的蛋白样品,于-20 ℃保存,其余上清液于-80 ℃保存。每孔上样10 μL,进行SDS-PAGE 凝胶电泳,冰浴条件下湿转至0.45 μm PVDF 膜上,TBST 洗膜后使用BSA 封闭液室温封闭1 h,分别加入Claudin-1 (1 ∶1 000)、ZO-1 (1 ∶1 000)、p-TBK1(1 ∶1 000)、TBK1 (1 ∶1 000)、STING (1 ∶1 000)、GAPDH (1 ∶3 000) 一抗4 ℃孵育过夜,次日TBST 洗膜,室温孵育二抗(1 ∶4 000) 1 h,滴加化学发光显影液,于凝胶成像系统下显影,使用Image J 软件进行分析。
2.9 统计学分析 通过SPSS 24 和GraphPad Prism 8.0 软件进行处理,计量资料以(±s) 表示,组间比较采用单因素方差分析;计数资料以百分比表示,组间比较采用χ2检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 大鼠一般状况观察 空白组大鼠毛色洁白光泽,肛周干净,四肢及尾部温热,体质量增长迅速,精神状态良好;模型组皮毛光泽暗淡,大便不成型,肛周污秽,四肢及尾部体温较低,体质量增长缓慢,平时静卧少动,喜好扎堆,刺激后烦躁不安,相互撕咬,提示模型复制成功;给药结束后,各给药组毛色洁白有光泽,大便成型,肛周干净,提示各给药组可改善IBS-D 模型大鼠的一般状况。
3.2 健脾祛湿膏对IBS-D 大鼠体质量的影响 如图1 所示,与空白组比较,模型组和各给药组雄性大鼠体质量均降低(P<0.01),模型组和补脾益肠丸组雌性大鼠体质量降低(P<0.05);与模型组比较,各给药组大鼠体质量均有上升趋势,但差异无统计学意义(P>0.05)。

图1 健脾祛湿膏对IBS-D 大鼠体质量的影响(±s,n=8)Fig.1 Effects of Jianpi Qushi Paste on the weight of IBS-D rats (±s,n=8)
3.3 健脾祛湿膏对IBS-D 大鼠粪便含水率、脾脏系数、肠道疼痛阈值、糖水偏好值的影响 如表2所示,与空白组比较,模型组大鼠粪便含水率、脾脏系数升高(P<0.01),疼痛阈值、糖水偏好值降低(P<0.01),提示模型复制成功。与模型组比较,各给药组大鼠大鼠粪便含水率降低(P<0.05,P<0.01),疼痛阈值升高(P<0.05,P<0.01),内脏敏感得到改善;补脾益肠丸组和健脾祛湿膏各剂量组脾脏系数降低(P<0.05);补脾益肠丸组和健脾祛湿膏低剂量组糖水偏好值升高(P<0.05)。
表2 健脾祛湿膏对IBS-D 模型大鼠粪便含水率、肠道疼痛阈值、脾脏指数、糖水偏好值的影响(±s,n=6~8)Tab.2 Effects of Jianpi Qushi Paste on fecal water content,intestinal pain threshold,spleen index level and preference value of sugar water in IBS-D model rats (±s,n=6-8)

表2 健脾祛湿膏对IBS-D 模型大鼠粪便含水率、肠道疼痛阈值、脾脏指数、糖水偏好值的影响(±s,n=6~8)Tab.2 Effects of Jianpi Qushi Paste on fecal water content,intestinal pain threshold,spleen index level and preference value of sugar water in IBS-D model rats (±s,n=6-8)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别粪便含水率/%肠道疼痛阈值/mL脾脏系数/%糖水偏好值/%空白组57.488±4.8450.763±0.0740.226±0.02285.523±2.705模型组69.194±4.367**0.375±0.071**0.365±0.053**66.277±6.509**补脾益肠丸组56.513±3.266##0.663±0.106##0.290±0.030#83.617±4.512##匹维溴铵组61.410±4.083#0.600±0.076##0.326±0.06164.673±11.347健脾祛湿膏低剂量组57.988±2.378##0.613±0.099##0.276±0.034#79.452±3.912#健脾祛湿膏高剂量组63.251±3.495#0.550±0.093#0.293±0.042#73.428±5.243
3.4 健脾祛湿膏对IBS-D 大鼠结肠组织病理形态的影响 如图2 所示,各组大鼠结肠上皮细胞排列齐整,黏膜完整,腺体结构正常,未见明显肠道水肿、肠黏膜损坏、炎症细胞因子浸润的情况,均不存在器质性病变,符合IBS 模型病理学表现。
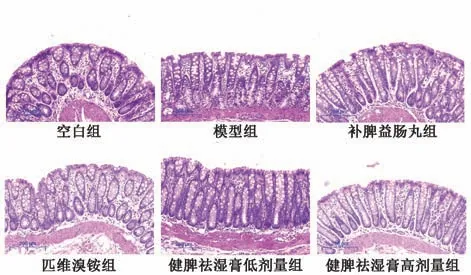
图2 各组大鼠结肠组织HE 染色(×50)Fig.2 HE staining of rat colon tissue for each group(×50)
3.5 健脾祛湿膏对IBS-D 大鼠结肠组织IFN-β 水平的影响 如图3 所示,与空白组比较,模型组大鼠结肠组织IFN-β 水平升高(P<0.01);与模型组比较,各给药组大鼠结肠组织IFN-β 水平均降低(P<0.01)。

图3 健脾祛湿膏对IBS-D 大鼠结肠组织IFN-β 水平的影响(±s,n=8)Fig.3 Effects of Jianpi Qushi Paste on IFN-β level in colon tissue of IBS-D rats (±s,n=8)
3.6 健脾祛湿膏对IBS-D 大鼠结肠组织5-HT1A、5-HT2A、TNF-αmRNA 表达的影响 如图4 所示,与空白组比较,模型组大鼠结肠组织5-HT1A、5-HT2A、TNF-αmRNA 表达升高(P<0.01);与模型组比较,各给药组大鼠结肠组织5-HT2A、TNF-αmRNA 表达均降低(P<0.05,P<0.01),补脾益肠丸组和健脾祛湿膏各剂量组大鼠结肠组织5-HT1AmRNA 表达均降低(P<0.01)。

图4 健脾祛湿膏对IBS-D 大鼠结肠组织5-HT1A、5-HT2A、TNF-α mRNA 表达的影响(±s,n=8)Fig.4 Effects of Jianpi Qushi Paste on 5-HT1A,5-HT2A and TNF-α mRNA expressions in colon tissue of IBS-D rats (±s,n=8)
3.7 健脾祛湿膏对IBS-D 大鼠结肠组织Claudin-1、ZO-1 mRNA 及蛋白表达的影响 如图5~6 所示,与空白组比较,模型组大鼠结肠组织Claudin-1、ZO-1 mRNA 及蛋白表达均降低(P<0.01);与模型组比较,各给药组大鼠结肠组织Claudin-1、ZO-1 mRNA 和Claudin-1 蛋白表达均升高(P<0.05,P<0.01),补脾益肠丸组和健脾祛湿膏各剂量组大鼠结肠组织ZO-1 蛋白表达升高 (P<0.05,P<0.01)。
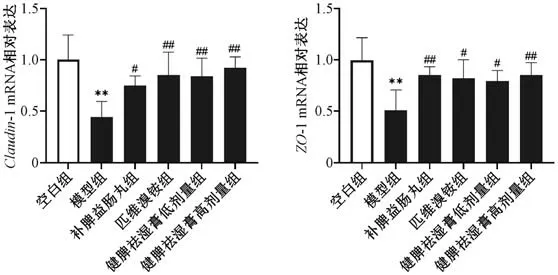
图5 健脾祛湿膏对IBS-D 大鼠结肠组织Claudin-1、ZO-1 mRNA 表达的影响(±s,n=6)Fig.5 Effects of Jianpi Qushi Paste on Claudin-1 and ZO-1 mRNA expressions in colon tissue of IBS-D rats (±s,n=6)
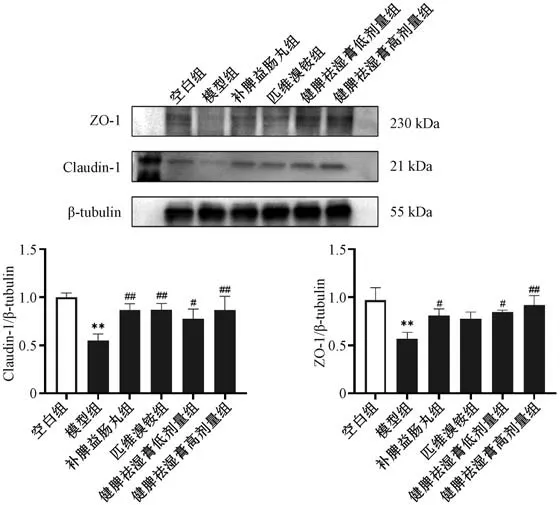
图6 健脾祛湿膏对IBS-D 大鼠结肠组织Claudin-1、ZO-1 蛋白表达的影响(±s,n=3)Fig.6 Effects of Jianpi Qushi Paste on Claudin-1 and ZO-1 protein expressions in colon tissue of IBS-D rats (±s,n=3)
3.8 健脾祛湿膏对IBS-D 大鼠结肠组织cGASSTING 信号通路相关靶点mRNA 和蛋白表达的影响 如图7~8 所示,与空白组比较,模型组大鼠结肠组织cGAS、STINGmRNA 和STING、TBK1、p-TBK1 蛋白表达升高(P<0.01);与模型组比较,各给药组大鼠结肠组织cGAS、STINGmRNA 和STING、TBK1、p-TBK1 蛋白表达降低(P<0.01)。

图7 健脾祛湿膏对IBS-D 大鼠结肠组织cGAS、STING mRNA 表达的影响(±s,n=8)Fig.7 Effects of Jianpi Qushi Paste on cGAS and STING mRNA expressions in colon tissue of IBS-D rats (±s,n=8)

图8 健脾祛湿膏对IBS-D 大鼠结肠组织STING、TBK1、p-TBK1 蛋白表达的影响(±s,n=4)Fig.8 Effects of Jianpi Qushi Paste on protein expressions of STING,TBK1 and p-TBK1 in colon tissue of IBS-D rats (±s,n=4)
4 讨论
中医理论认为IBS-D 属于“泄泻” “腹痛” 范畴,肝郁脾虚被认为是IBS-D 的基本病机[8]。本实验结果表明,健脾祛湿膏能够增加IBS-D 大鼠体质量,减轻腹泻程度,使脾脏系数恢复至正常水平,并改善行为学表现,提示健脾祛湿膏能够改善IBSD 大鼠腹泻和脾虚肝郁的状态。
5-HT 属于脑肠肽的一种,胃肠道是体内5-HT最丰富的来源,它对肠道运动、肠道分泌和内脏敏感性有着重要的调节作用[9]。5-HT1A、5-HT2A受体拮抗剂因其在内脏疼痛模型中具有镇痛作用,被认为是治疗IBS-D 的靶点[10-11]。本实验结果表明,模型组大鼠5-HT1A、5-HT2AmRNA 表达均高于空白组,这与先前相关报道的研究结果一致[10];健脾祛湿膏给药后5-HT1A、5-HT2AmRNA 表达降低,提示健脾祛湿膏治疗IBS-D 可能与其解郁止痛的功效相关。
紧密连接(TJs) 是一种多蛋白复合物,负责调节细胞间的通透性[12]。TJs 控制抗原通过肠上皮屏障的传递,并在维持屏障的完整性方面起着关键作用。TJs 蛋白表达降低,导致肠道屏障功能受损,进而引发肠道通透性的改变,细菌及其代谢物“渗漏” 进入肠道内部和全身循环,导致黏膜甚至全身免疫激活被放大,而免疫的激活又有可能反过来加重肠道屏障的损害程度[12]。因此肠道屏障功能的受损可能是导致IBS-D 患者和模型动物粪便含水率升高和肠道低度炎症的重要原因[12-14]。本实验结果表明,Claudin-1 和ZO-1 作为紧密连接蛋白家族代表性成员,其在模型组中mRNA 和蛋白表达均降低;经健脾祛湿膏干预后,Claudin-1 和ZO-1 表达有所上升。
IBS-D 的肠道屏障完整性受损可能导致微生物穿过肠道屏障进入固有层而激活免疫应答。有研究报道称,IBS-D 患者体内TNF-α 水平提高,并与腹泻程度相关[3,15],提示肠道内存在炎性应答。cGAS-STING 信号通路属于固有免疫,在维持肠道稳态中起着重要作用,但其过度激活会促进炎症细胞因子的释放破坏肠道免疫稳态[16-18]。cGAS 可以识别细胞质中细菌所泄露的游离DNA,合成第二信使环鸟苷酸-腺苷酸 (cyclin GMP-AMP,cGAMP),以激活下游的STING 受体蛋白[4]。STING 作为此通路的枢纽,还能被细菌环二核苷酸(cyclic dinucleotides,CDNs) 直接激活,促进TBK1 募集和磷酸化,从而促使I 型干扰素(如IFN-β) 的转录和表达。在生理状态下,肠道分泌一定水平的IFN-β 能使肠道及时应对入侵的微生物,但其过度表达会加剧免疫细胞的激活,引起免疫微环境失衡[19-20]。本实验结果表明,IBS-D 大鼠结肠组织cGAS-STING 通路被激活;给予健脾祛湿膏干预后,cGAS-STING 通路受到抑制。
综上所述,本研究表明,健脾祛湿膏具有疏肝健脾止泻的功效,能够改善IBS-D 大鼠情志不调、腹泻、内脏高敏感,上调紧密连接蛋白Claudin-1、ZO-1 表达。同时,本研究表明IBS-D 大鼠结肠组织cGAS-STING 通路被激活,促炎因子IFN-β 释放增加,健脾祛湿膏干预可抑制cGAS-STING 通路活化。

