中药治疗慢性阻塞性肺疾病机制的研究进展*
贾蓓,何家琛,李佳玮,刘志东
(1.天津中医药大学,现代中药发现与制剂技术教育部工程中心,天津 301617;2.天津中医药大学,组分中药国家重点实验室,天津 301617)
慢性阻塞性肺疾病(COPD)是一种常见的以持续气流受限为临床特征的疾病,表现为慢性支气管炎、肺实质病变、肺气肿、大气道炎症和重塑等病理特征[1]。COPD 患病率高、致残率高、病死率高,全球患病人数3.84 亿人,每年死亡人数350 万人,是世界死亡主要原因之一[2]。COPD 的发病诱因与肺部对有害颗粒或气体的异常炎症反应相关,吸烟是最主要的危险因素,COPD 与肺部对香烟烟雾等有害气体的异常炎症反应有关[3]。目前,治疗COPD 常采用药物治疗的方式,如糖皮质激素类或支气管扩张剂等,但其易出现耐药性,不良反应(皮疹、心动过速、头晕、代谢紊乱、精神障碍等)较多,仅缓解疾病症状,而不可预防疾病发展[4-5]。中药在临床治疗COPD中发挥着越来越重要的作用[6]。研究发现,中药在改善COPD 患者肺功能、临床症状及生活质量方面均优于西药,可显著减少COPD 疾病的加重或复发,降低药物对机体所造成的毒副作用[7-8]。本文从COPD的发病机制、中药治疗COPD 的药理作用与治疗机制进行归纳总结,对中药资源开发成为活性明确、安全性好的COPD 药物具有重要意义。
1 COPD 的发病机制
COPD 的发病主要由两种因素影响:外界因素(吸烟、空气污染、粉尘等刺激)与内部因素(遗传因素等),其通过影响炎症反应、氧化应激反应、细胞凋亡、蛋白酶/抗蛋白酶失衡、气道重塑等多种调节机制影响机体反应。见图1。
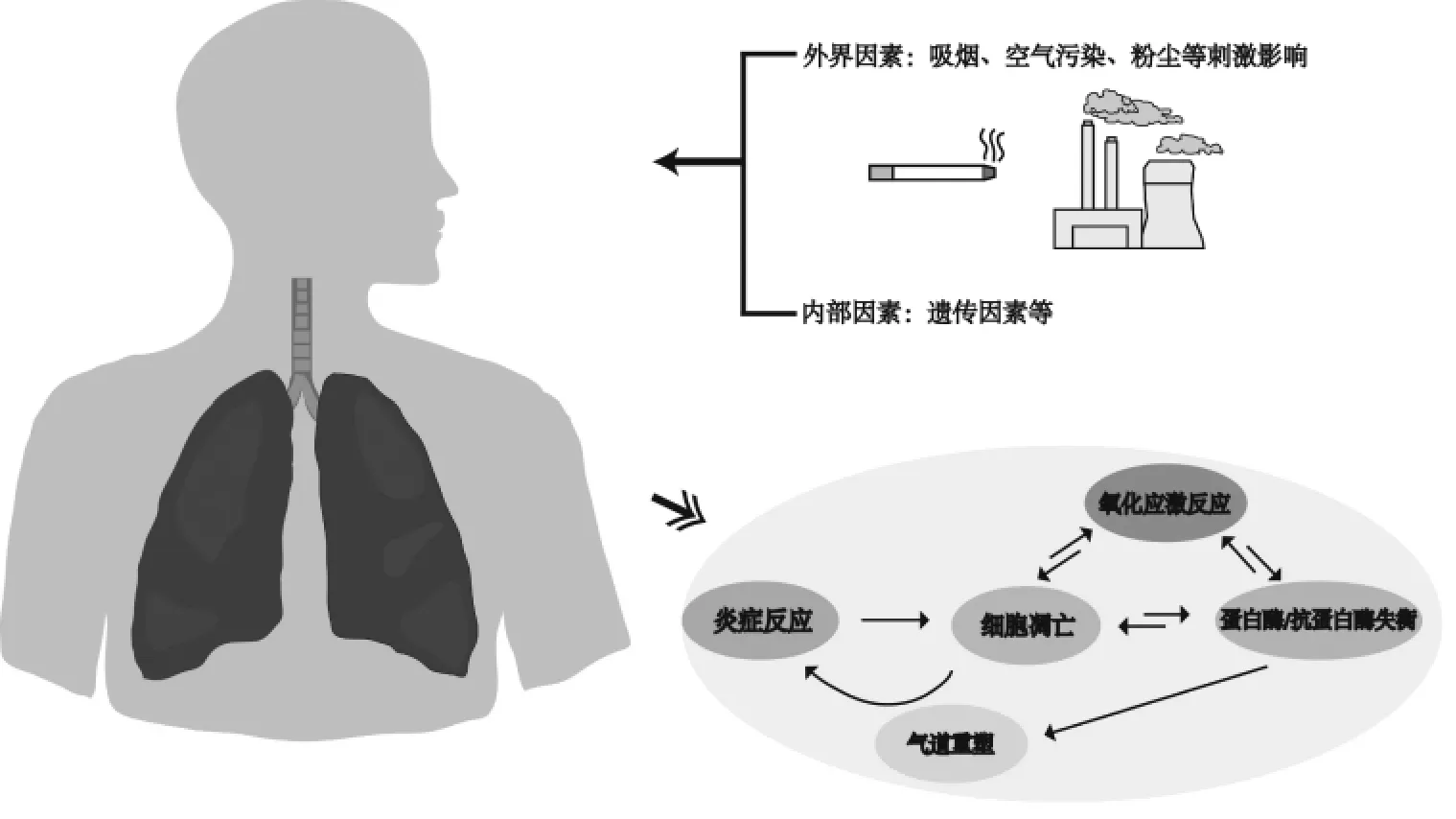
图1 COPD 的发病机制Fig.1 Pathogenesis of COPD
1.1 炎症反应 COPD 是由气道的重塑和肺实质性破坏所引起,气管内存在大量的炎症因子与炎性细胞浸润,中性粒细胞、巨噬细胞、淋巴细胞、树突细胞等炎症细胞参与炎症反应释放炎性介质,刺激肺细胞发生炎症反应,破坏肺结构。巨噬细胞常出现于肺泡损伤部位,其数量与肺损伤严重程度呈相关性存在。香烟烟雾(CS)可激活巨噬细胞,释放肿瘤坏死因子-α(TNF-α)、转化生长因子-β(TGF-β)趋化因子(CXCL)、活性氧(ROS)等炎性介质[9]。TNF-α、白介素-1β(IL-1β)、白介素-6(IL-6)等炎性因子的增加可促进核因子-κB(NF-κB)的有效激活,常释放ROS,诱导炎症因子向受损部分聚集,促进内皮细胞的过度增生并破坏其结构,引起严重的气道炎症与重塑[10]。同时,中性粒细胞可分泌多种丝氨酸蛋白酶,如中性粒细胞弹性蛋白酶(NE)、基质金属蛋白酶(MMPs)以及髓过氧化物酶(MPO)等将影响肺泡组织结构变化[11]。NE 是黏膜下腺体与杯状细胞黏液分泌的一种刺激性较强的物质,刺激气道内黏液的高度分泌,促进成纤维细胞的增殖,造成支气管小气道阻塞出现[12]。此外,T 淋巴细胞的增加促使CD4+与CD8+细胞数量的上调,且发现CD8+细胞是吸烟和气道阻塞之间的连接纽带[13]。
1.2 氧化应激反应 CS 中的大量氧化刺激物会直接影响到上皮细胞、巨噬细胞和水肿的基底膜等产生高水平的内源性ROS,促使气道平滑肌显著增加,激活巨噬细胞释放多种趋化因子,诱导I 型肺细胞凋亡,从而导致肺气肿[14]。产生过多的ROS 促使机体会启动内源性的抗氧化机制抑制氧化应激反应,这也是COPD 的发病和进展中起着关键的驱动作用。核因子红系2 相关因子(Nrf2)是细胞保护蛋白的关键调控因子,可通过调控Nrf2,促进血红素加氧酶-1(HO-1)、超氧化物歧化酶(SOD)和髓过氧化物酶(MPO)等抗氧化剂提供一种内源性的生物防御,防止由ROS 引起的细胞或器官损伤[15]。ROS同样可导致促炎性转录因子NF-κB 的激活、促进释放TNF-α、TGF-β1、IL-1β 和IL-6 等炎性因子分泌增加,炎性因子的产生ROS 进一步激活NF-κB,形成恶性循环[16]。此外,氧化应激可激活磷脂酰肌酸3激酶(PI3K),导致组蛋白脱乙酰基酶2(HDAC2)的磷酸化和失活,导致COPD 患者出现皮质类固醇耐药性[17]。
1.3 蛋白酶与抗蛋白酶失衡 COPD 是一种具有气流阻塞特征的慢性支气管炎和(或)肺气肿。简单来说,肺气肿是由蛋白酶和抗蛋白酶的不平衡引起的,从而导致肺实质的破坏。蛋白酶可消化肺泡或弹性蛋白上的其他蛋白结构,如NE 和MMPs。抗蛋白酶主要是对抗蛋白酶的作用,如α1 抗胰蛋白酶(α1AT)、分泌型白细胞蛋白酶抑制剂(SLPI)和基质金属蛋白酶抑制剂(TIMPs)[18]。ROS 的过度暴露引起内源性抗蛋白酶失活,引发急性肺部反应激活巨噬细胞,促进中性粒细胞流入肺部。NE 是通过降解细胞外基质(ECM)对肺组织造成破坏,其同时诱导内皮细胞释放IL-6、IL-8、TGF-β 等多种炎性介质,反向促进中性粒细胞的释放[19]。此外,MMPs 可清除ECM 中所有结构。其中,MMP-2、MMP-8 和MMP-9均可破坏肺泡结构并激活机体免疫反应。同时,研究发现MMP-12 基因敲除小鼠可以免受CS 引起的肺气肿[20]。
1.4 细胞凋亡 细胞凋亡是指细胞对环境发出的生理或病理刺激信号,常见的凋亡基因包括肿瘤坏死因子(如Fas 配体、TNF-α)、B 淋巴细胞瘤-2(Bcl-2)、天冬氨酸特异性半胱氨酸蛋白酶(Caspase)和肿瘤抑制基因P53。在COPD 模型中常发现肺泡上皮细胞与内皮细胞均发生增殖,血管内皮生长因子(VEGF)是内皮细胞存活的主要调控因子之一,VEGF 表达的增加可减少肺血管内皮细胞凋亡[21]。研究发现,Smad3 基因敲除小鼠暴露于CS后,VEGF 的表达降低,从而加速肺气肿和COPD 的发展[22]。口服N-乙酰半胱氨酸可通过部分增加VEGF 分泌和蛋白表达来减少肺气肿和CS 诱导的肺泡间隔细胞凋亡[23]。研究表明,对小鼠气管进行给药Caspase3 后,增多的促凋亡蛋白表达,肺泡上皮细胞发生凋亡,肺泡灌洗液中弹性蛋白酶活性增高,小鼠最终发生肺气肿,而Caspase 抑制剂可以阻止肺间隔细胞的凋亡和肺气肿的进展[24]。
1.5 气道重塑 气流阻塞是COPD 疾病的主要特征,其主要是受到炎症反应、ECM 沉积和上皮间质转化(EMT)所造成的支气管小气道重塑。当有害物质刺激气管时,气管释放TNF-α、IL-8、CXC 等趋化因子发生炎性细胞浸润,同时上调MMP-2、MMP-9、MMP-12 等蛋白酶表达,参与气道的炎症反应与重塑[10]。同时,ECM 的合成与降解的失衡将会引起气道结构的异常、肺实质等生理变化,是气流阻塞的主要原因之一。MMPs/TIMPs 的失衡致使ECM 的降解增加,肺组织与弹性纤维遭到破坏从而参与气管的重塑[25]。此外,TGF-β 是构建EMT 主要诱导细胞因子,可通过激活Smad 信号通路,上调上皮间质转化(EMT)相关转录因子。其引起连接蛋白和上皮细胞标志物表达的降低,增加N-钙黏蛋白(N-CAM)、α-平滑肌蛋白(α-SMA)、MMP-9 等间质细胞标志物的表达,促进EMT 的形成与发展[26]。
2 中药化学成分治疗COPD 的研究
2.1 黄酮类化合物 黄酮类化合物多以苷类形式广泛的存在于植物中,具有较好的抗炎、抗氧化、抗病毒、抗衰老等药理作用,在治疗COPD、肺纤维、急性肺炎等肺部疾病具有较好的应用[27]。研究发现,黄芩苷在CS 诱导的大鼠模型中可以通过HDAC2/NF-κB/PAI-1 信号通路抑制炎症的表达,HBE 细胞模型也可抑制CSE 暴露所释放的TNF-α 和IL-1β表达[28]。HU 等[29]研究发现淫羊藿苷显著增加抗炎性因子IL-10 的蛋白量,同时降低促炎性因子IL-8、TNF-α,减少细胞基质构建所需要的MMP-9/TIMP1水平,从而缓解ROS 的释放。同时,发现淫羊藿苷可调节糖皮质激素耐药性相关因子HADC2、Nrf2 和NF-κB 的表达,其可能通过改善糖皮质激素耐药性及氧化作用,从而提高COPD 的治疗疗效。Yang等[30]研究发现,持续暴露于CS 可以显著增加氧化应激、促炎因子释放、杯状细胞增生、黏蛋白5ac(Muc5ac)mRNA 和蛋白表达、表皮生长因子(EGFR)磷酸化和NF-κΒ 通路激活,其大鼠肺组织通常伴有支气管周围炎性细胞浸润、杯状细胞增生及抗氧化应激标记物的减少。此外,在NCIH292 细胞和大鼠模型中,槲皮素可能通过抑制EGFR 的酪氨酸磷酸化和NF-κΒ 通路的激活来减少Muc5ac 表达,从而阻断氧化应激、炎症反应对气道的影响。
Yu 等[31]研究发现异甘草素可减少炎症细胞的浸润和炎性细胞的产生,逆转CS 诱导的肺病理性损伤,降低肺组织中总细胞、中性粒细胞和巨噬细胞的数量,通过剂量依赖性的上调Nrf2 和减少NF-κB信号通路的表达抑制CS 诱导的COPD。Li 等[32]研究发现紫花牡荆素可调节NF-κB 和iNOS 通路,减少TNF-α、IL-1β 和IL-6 等促炎性因子表达,通过抑制氧化应激和炎症来保护COPD 模型损伤。Zhang等[33]在治疗LPS/CS 诱导的水通道蛋白1(AQP1)缺陷小鼠时发现,柚皮苷可减少血液中淋巴细胞、中性粒细胞、血小板计数和MDA 的数量,上调肺组织中的AQP1,减轻LPS/CS 诱导的气道炎症和肺高通透性。
2.2 萜类化合物 萜类化合物是指具有(C5H8)n通式以及其含氧衍生物(如醇、醛、酮、羧酸、酯等),具有抗炎、抗过敏、抗病毒、祛痰止咳、祛风发汗等多种药理作用。Zhou 等[34]研究发现,黄芪甲苷可通过抑制JAK3/STAT3/NF-κB 通路的相关蛋白表达,降低促炎症因子TNF-α、IL-6 和IL-1β 的水平,提高SOD 和减少MDA 活性,改善肺组织的病理性损伤。Zhang 等[35]在研究中发现穿心莲内酯可以通过调节SIRT1/ERK 信号通路来影响巨噬细胞,增加SIRT1 的转录,减少p-ERK 磷酸化水平,从而降低促炎性因子(即TNF-α 和IL-1β)、SOD、GSH/GSSG、HO-1、MMP-9 和MMP-12 的等表达,从而改善线粒体功能和线粒体膜障碍、炎症反应和氧化应激反应作用于COPD 的治疗。研究发现,熊果酸可通过抑制UPR 信号通路,上调磷酸化需肌醇酶1(p-IRE1)与X-框结合蛋白1(XBP1)分子表达,降低磷酸化胰腺内质网激酶(P-PERK)、转录激活因子4(ATF4)和人内质网应激相关蛋白(CHOP)含量,控制下游凋亡通路,显著改变CS 所导致的肺气肿及气道重塑病理特征[36]。Pan 等[37]研究发现青蒿琥酯治疗以剂量依赖的方式抑制CS 诱导的气道炎症和氧化应激,上调氧化物酶体增殖物激活受体(PPAR-γ)表达,通过siRNA 转染下调PPAR-γ,激活TGF-β1/Smad2/3 信号通路,抑制α-SMA 和细胞周期蛋白D1 的表达来减少气道重构。
Dianat 等[38]研究发现藏花素对CS 介导的氧化应激、炎症过程、Nrf2 修饰和大鼠心功能损伤的保护作用,可显著降低炎症参数,调节Nrf2 介导的HO-1、PKC、PI3K 和MAPK 基因表达的激活,改善肺损伤导致的心电图和血流动力学参数心脏异常。研究发现,雷公藤红素可抑制Ednrb/Kng1 信号通路,降低炎症细胞因子IL-8、TNF-α 和单核细胞趋化蛋白-1(MCP-1)含量,增加氧化应激因子SOD 和CAT 活性,减少小鼠肺损伤和Beas-2B 细胞的凋亡[39]。近年来,肺部吸入制剂在治疗肺部疾病中的应用广泛[40]。另有研究发现桉树醇经肺部吸入后,可通过降低NF-κB 炎症表达和氧化还原标志物(MDA)水平,增加SOD 活性,提高弹性蛋白和TIMP-1 蛋白表达,减少NE 水平,调节蛋白酶/抗蛋白酶比率,从而促进细支气管周围区域的胶原沉积恢复和肺泡形成,改善CS 对肺组织的刺激[41]。
2.3 酚类化合物 酚类化合物常指含有酚的化合物,其羟基具有高反应性和吞噬自由基的能力,自身具有较好的抗氧化活性[42]。Yuan 等[43]研究发现,姜黄素可通过抑制NF-κB 激活,减少BLAF 中的中性粒细胞、淋巴细胞及炎症的浸润,抑制IκBα 和COX-2 蛋白表达,减轻气道炎症和气道重塑,对支气管上皮细胞介导的进行性气道重塑和炎症反应有预防作用。研究发现,白藜芦醇可通过激活SIRTl和PPARγ 共激活因子-1α(PGC-1α)对调节氧化应激和炎症的影响,其可减少MDA 活性,增加SOD 活性,降低血清中IL-6 和IL-8 的水平,实现炎症减轻和肺小气道重建的治疗作用[44]。同时,在猪胰腺弹性蛋白酶(PPE)诱导的COPD 大鼠模型中,没食子酸可通过调控NF-κB 与Nrf2 信号通路,减少MDA 表达,增加SOD、HO-1、GSH、CAT 等氧化应激指标,保护肺免受弹性蛋白酶诱导的肺气肿的影响[45]。此外,颜贵明等[46]研究发现丹皮酚可降低MDA、IL-8、TNF-α、层黏连蛋白(LN)、Ⅳ型胶原、羟脯氨酸(Hyp)的表达,上调GSH、SOD 的含量,通过抑制炎症反应和氧化应激反应,改善气道上皮细胞重塑。
2.4 醌类 醌类化合物是中药中一类具有醌式结构的化学成分,具有抗癌、抗病毒、解痉平喘等药理作用[47]。Wu 等[48]在实验中发现大黄酚可减少凋亡标志物、Caspase3 的表达,抑制CYP1A1 表达,降低磷酸化胰腺内质网激酶(pPERK)、转录激活因子4(ATF4)和转录激活因子6(ATF6)表达,通过抑制细胞凋亡、氧化应激及内质网应激等达到治疗COPD的效果。研究发现,乙酰紫草素[49]具有较好的抗氧化和抗炎作用,其可减轻烟雾诱导的肺病理改变、TNF-α、IL-1β、IL-6 和MCP-1 的产生,促进Nur77介导的COX-2 在巨噬细胞中的表达发挥抗炎作用。同时,其可通过提高巨噬细胞的细胞核内Nrf2 积累,降低GSH 和增加SOD、CAT 等部分抗氧化分子的表达来抑郁氧化应激反应,发挥抗氧化作用。此外,研究发现丹参在治疗肺部疾病时具有改善微循环、抗氧化、抗炎、抑制胶原蛋白(COL)的产生等作用[50]。在体内外COPD 模型中,实验发现丹参酮ⅡA可通过降低ERK1/2 和NF-κB 的激活,减少总细胞、中性粒细胞、巨噬细胞和淋巴细胞总数、IL-6 和IL-8 的释放,改善小鼠的肺部炎症反应、黏液分泌过多和肺功能下降[51]。
2.5 生物碱 生物碱是含氮有机化合物,有显著的生物学活性,是中草药中的有效成分。Yu 等[52]研究发现苦参碱可引起中性粒细胞凋亡,显著抑制CS诱导小鼠BALF 的中性粒细胞增多和中性粒细胞弹性蛋白酶的活性。同时,增加巨噬细胞的标记物MMP-12 mRNA 表达,减少炎症介质释放。同时,研究发现黄连素可抑制IL-1β、IL-6 和TNF-α 基因的表达,降低细胞总ROS 和相关基因(Gpx2、Nqo1)的激活,减少p213 基因/蛋白的表达[53]。提示从抗炎、抗氧化和抗衰老活性方面治疗慢性肺部疾病可能具有一定前景。
2.6 其他 皂苷类、三萜类等其他多种类型化合物,具有祛痰止咳、祛风湿、抗炎、抗菌等广泛功效。Chen 等[54]研究发现柴胡皂苷a 可通过调节NF-κB/Nrf2/HO-1 信号通路,抑制NF-κB 的激活,并上调Nrf2 和HO-1 的表达,减少炎症细胞浸润、NO、TNF-α和IL-1β 的产生,缓解MPO 和MDA 的释放,从而治疗CS 诱导的肺部炎症。Gao 等[55]研究时同样发现桔梗皂苷D 也可通过调节NF-κB/Nrf2/HO-1 信号通路,减少MDA 和NO 的产生,显著减弱CS 诱导的肺病理改变、炎症细胞浸润以及TNF-α 和IL-1β的产生。小气道纤维化是伴随慢性阻塞性肺疾病COPD 的一个关键病理过程。Guan 等[56]在研究中发现人参皂苷Rg1 可能通过抑制TGF-β1/Smad 信号通路,显著降低TGF-βI、p-Smad2 和p-Smad3 的上调,减少α-SMA、Ⅰ型胶原和MMP-9 的表达,调节MMP-9 与TIMP-1 比率抑制CS 诱导的肺成纤维细胞和COPD 大鼠气道纤维化。此外,研究发现红景天苷可能通过调节MAPK/NF-κB 通路,抑制NF-κB和IκBα、p-ERK、p-JNK 和p-p38 的表达,增加SOD 表达,抑制血清和肺中促炎细胞因子的产生,从而有效改善COPD 的进展[57]。中药化学成分治疗COPD 总结表见OSID 标识码。
3 中药提取物治疗COPD 的研究
中药提取物是将中药材进行加工与处理,利用不同提取技术提取其中有效成分,主要有效成分由糖类、蛋白质、油脂、有机酸、挥发油、生物碱、苷类等组成。中药成分的多样性决定其作用靶点、功效的多样性。王玲玲等[58]在研究发现泽漆水提物可通过改善大鼠肺功能与肺组织病理变化,调节IL-12/STAT4、IL-4/STAT6 信号通路对COPD 模型大鼠发挥保护作用。李慧等[59]发现鱼腥草提取物可有效改善COPD 急性加重期大鼠肺功能,可能通过抑制TLR4/NF-κB 信号通路发挥作用。研究表明,仙鹤草乙醇提取物可通过降低STAT3 信号通路的表达,上调Foxp3 水平,减少ROR-γt 的释放,缓解Th17/Treg 的失衡[60]。叶向丽等[61]在对鼠曲草治疗COPD大鼠气道炎症研究中发现,鼠曲草乙醇提取物可显著降低大鼠肺组织中炎症因子与低p-IκB、IKK 蛋白、NF-κB mRNA,以及相关蛋白相对表达量。唐艳芬等[62]在实验中发现金荞麦的不同提取物均可降低COPD 大鼠模型肺组织炎症反应,改善肺组织的病理损伤。此外,陈剑波等[63]研究发现吉祥草水提物可通过改善小鼠肺功能,降低血清中IL-1β、IL-6、COX-2、PGE2 及MMP-9 的表达,有效治疗COPD小鼠模型症状。见表1。

表1 中药提取物治疗COPD 的作用机制Tab.1 Mechanism of action of traditional Chinese medicine herbal extracts in COPD treatment
4 中成药治疗COPD 的研究
中成药是在中医药理论的指导下,以中药材为原料,按照规定处方与制剂工艺将其加工成一定剂型的中药制品,如中药颗粒剂、中药胶囊剂、中药注射剂等。实验发现,六味补气胶囊可抑制JNK、c-JUN、c-FOS 的表达,降低IL-1β、TNF-α、NF-κB 的释放,增加IκBα 蛋白表达,其可能通过靶向多种免疫细胞亚群发挥免疫调节作用[64]。董克州等[65]研究发现河车虫草胶囊可改善COPD 模型所出现的纤毛紊乱、肺泡上皮细胞变形、肺泡腔内碎片以及内质网线粒体肿胀等病理特征。施静等[66]在研究中发现疏风解毒胶囊可提高CD3+、CD4+、CD4+/CD8+的水平及SOD、GSH-Px 的活性,降低CD8+、TNF-α、hs-CRP、MDA 的表达,达到缓解COPD 模型中所出现的肺损伤与肺功能障碍现象。郝英等[67]在研究发现参蛤益肺胶囊可通过调节TGF-β1/Smads 信号通路达到减轻气道重塑、缓解COPD 疾病发展的药效。Yang 等[68]研究证实肺康颗粒可通过调控TLR2/4 与NF-κB 信号通路,改善肺功能和预防肺部炎症问题。同时,陈晔等[69]研究发现温肾益气颗可通过调节PI3K/AKT/mTOR 信号通路,抑制肺组织中增殖细胞核抗原(PCNA)的表达,改善模型大鼠气道重塑症状。Liu 等[70]研究发现参附注射液可通过抑制高迁移率族蛋白B1(HMGB1),增加toll 样受体(TLR4)和IκB-α 的产生,减少P65、P50 和TNF-α 的表达,降低促炎细胞因子的分泌,从而防止细胞因子风暴的产生和肺组织的损伤。研究发现,痰热清注射液可通过调控PI3K/AKT 通路,降低TNF-α、IL-8、IL-1β、中性粒细胞水平,上调IL-4、淋巴细胞、单核细胞水平,显著改善COPD 模型肺组织中的纤毛结构、黏液分泌及炎症反应[71]。此外,黄纯美等[72]在研究中发现喘可治注射液可通过增加STAT6 蛋白表达量和降低STAT4 的表达量,影响其相应的L-12/STAT4 和IL-4/STAT 6 信号通路,降低Th1 极化,改善Thl/Th2 失衡。见表2。

表2 中成药治疗COPD 的作用机制Tab.2 Mechanism of action of traditional Chinese medicine patent prescription in COPD treatment
5 结论
COPD 是一种持续性、慢性且不可治愈的肺部疾病,其具有气流阻塞的病理特征,进而可发展为肺部心脏病或呼吸衰竭等严重疾病。传统中药的成分组成丰富,对于治疗COPD 的研究具有重要意义。在中药治疗COPD 的研究中,其通过调节NF-κB、PI3K/Akt、SIRT1/ERK、TGF-β1/Smad、Nrf2/HO-1 等信号通路,抑制炎症反应、氧化应激反应、细胞凋亡,逆转糖皮质激素类药物的耐药性,改善蛋白酶/抗蛋白酶失衡、气道重塑达到治疗COPD 的效果。研究证实中药对COPD 均具有较好的治疗作用,但对中药活性成分的提取与纯化是1 项复杂的过程,且缺乏对中药活性成分或组分配伍中是否具有多通路、多靶点机制的探究。基于中医辨证论治理论,应用现代分子生物技术对中药活性成分或组分配伍的药理活性及作用机制进行探索,为开发活性明确、安全性好、成药率高的COPD 药物具有重要意义。

