矢志方激活Sirt1-Foxo1 通路调控内质网应激相关蛋白改善高尿酸血症小鼠肾损伤*
杨枫,王传旭,吴志远,张栩铭,高建东
(上海中医药大学附属曙光医院,上海中医药大学中医肾病研究所,上海中医药大学肝肾疾病病证教育部重点实验室,上海市中医临床重点实验室,上海 201203)
高尿酸血症(HUA)是由于嘌呤代谢紊乱导致血清尿酸(UA)升高的代谢综合征,对人体心脑血管、关节、肾脏等器官造成损害[1-2]。随着人们生活水平的提高,HUA 的发病率逐年升高,UA 长期堆积在肾脏会引起肾小管间质纤维化,从而引发UA 性肾病[3]。临床一线降UA 药物如黄嘌呤氧化酶抑制剂非布司他、别嘌呤醇,促进UA 排泄药物苯溴马隆等,长期服用存在一定副作用、血清UA 控制不佳等问题[4]。
沉默信息调节因子1(Sirt1)/叉头转录因子1(Foxo1)信号通路与肾脏病理生理发展密切相关。Sirt1 在肾脏中广泛存在,激活Sirt1 可抑制Foxo1 乙酰化水平,对肾脏起保护作用。Sirt1 表达增加可减轻草酸钙晶体诱导的肾损伤[5],缓解脂多糖所导致的氧化应激引起的肾损伤[6]。内质网应激(ERS)是维持细胞内稳态的重要细胞器,肾小管上皮细胞损伤是一种病理和生理的改变,在HUA 早期和进展期发挥关键作用[7]。在正常情况下,适度ERS 能保护细胞活性,如果长时间高UA 刺激则会超出内质网代偿能力,造成细胞损伤[8]。
矢志方是上海中医药大学附属曙光医院肾病科临床经验方。临床疗效较好,能显著降低痰浊瘀阻型HUA 的UA 水平[9]。前期大量基础实验研究表明,矢志方能降低HUA 小鼠和HUA 大鼠UA 水平、改善HUA 小鼠和HUA 大鼠肾功能[10-13]。基于本课题组前期研究基础,本实验通过建立HUA 小鼠模型,观察基于Sirt1-Foxo1 通路矢志方对HUA 小鼠肾组织和高UA 诱导HK2 细胞ERS 相关蛋白表达的影响,以期为矢志方的临床应用提供更多实验依据。
1 实验材料
1.1 动物 选取32 只8 周龄SPF 级雄性BALB/c小鼠,体质量12~22 g,购自上海斯莱克实验动物,动物许可证号SCXK(沪)2017-0005,伦理证号PZSHUTCM211227011。在上海中医药大学实验动物中心饲养,温度25 ℃左右,湿度45%左右,12 h 光照,普通饮食饮水喂养。
1.2 实验细胞 人肾小管上皮细胞HK2,购自中国科学院细胞库。
1.3 实验药物 动物用药:矢志方(车前子30 g,芥子15 g,王不留行15 g,冬葵子15 g),饮片购自上海中医药大学附属曙光医院,并委托国家中药制药工程技术研究中心制备成中药复方颗粒剂(1 g 颗粒相当于原方20 g),用蒸馏水配制成70 mg/mL 药液。非布司他片,40 mg/片,江苏恒瑞医药股份有限公司,批号H20130081,用蒸馏水配制成0.75 mg/mL药液。
矢志方冻干粉制作流程:称取炒王不留行、炒芥子各3.6 kg,炒车前子7.2 kg,冬葵子3.6 kg,混合均匀,打粉,粉碎后加入药材10 倍体积纯净水包煎,先煮1 h,过滤,再加8 倍水浸泡1 h,加热回流提取2 次,每次1 h。最终得到冻干粉0.9 kg。
细胞用药矢志方溶液配制:50 mL 试管中加入10 mL 含10%胎牛血清(FBS)、1%P/S 的F12/DMEM完全培养基,称取矢志方干粉600 mg,加入到试管中,细胞裂解仪30%功率5 min 促进干粉溶解,矢志方溶液终浓度为60 mg/mL。
UA 配置:称取100 mg UA 加入10 mL 双蒸水,震荡混匀充分溶解后滤过使用,UA 溶液终浓度为10 mg/mL。
1.4 主要试剂与仪器 氧嗪酸钾、羧甲基纤维素钠(CMCC-Na),上海麦克林生化科技有限公司,货号分别为P831461、C10097951;UA,美国Sigma 公司,货号u2875-5 g;Sirt1,美国CST 公司(货号8469s);内质网跨膜蛋白肌醇酶1α(IRE1α),美国CST 公司(货号3294s)、武汉Abclonal 公司(货号A17940);天冬氨酸特异性半胱氨酸蛋白酶(Caspase)12,美国Signalway Antibody 公司(货号48277)、武汉Abclonal 公司(货号A22864);增强子结合蛋白同源蛋白(Chop),美国CST 公司(货号2895s)、武汉Abclonal 公司(货号A113466);Foxo1,美国CST 公司(货号2880s);GAPDH,美国Proteintech 公司(货号60004-I-Ig);α-Tubulin,上海碧云天公司,货号AF2827;HRP 标记山羊抗小鼠IgG、HRP 标记山羊抗兔IgG,上海碧云天公司,货号分别为A0216、A0208;PVDF 膜,美国Millipore 公司,货号IPVH00005。离心机,美国Beckman 公司,型号Avanti J-E;凝胶成像系统,上海天能生命科学有限公司,型号Tanon-5200;生物组织冷冻包埋机,浙江省金华市科迪仪器设备有限公司,型号KD-BM;烘片机,浙江省金华市科迪仪器设备有限公司,型号KD-H;酶标仪,美国BioTek 公司,型号Synergy 2;组织匀浆器,上海净信科技有限公司,型号JY-24;显微镜,日本奥林巴斯公司,型号CX33。
2 实验方法
2.1 动物分组、造模与给药 造模及给药方法参考文献[8],32 只小鼠适应性饲养1 周后,随机分为正常组、模型组、非布司他组和矢志方组,每组8 只。正常组用同等体积生理盐水灌胃,其余各组采用250 mg/kg 氧嗪酸钾溶液灌胃建立HUA 小鼠模型。4 h 后给予药物干预即非布司他组灌胃非布司他药液6 mg/kg,矢志方组灌胃矢志方药液562.5 mg/kg,参考《中药药理实验方法学》的人与小鼠药物换算方式和本课题组前期实验,每只小鼠每10 g 灌胃0.2 mL,每日1 次,正常组和模型组予等体积生理盐水灌胃,造模与给药同时进行,连续2 周。
2.2 细胞培养与造模方法 将HK2 细胞用含10%FBS 和1%双抗的DMEM/F12 培养基于5%CO2、37 ℃恒温培养箱中培养,细胞密度为90%时进行细胞传代,取对数生长期细胞进行细胞铺板,细胞贴壁后用含0.5%FBS 的DMEM/F12 培养基饥饿处理12 h,再进行相应干预,干预24 h 后处理细胞进行后续实验。将细胞分为正常组,模型组(200 μg/mL UA),中药组(200 μg/mL UA+300 μg/mL 失志方)。
2.3 取材 第14 日给药结束后,0.8%戊巴比妥钠腹腔注射麻醉小鼠,摘取双侧肾脏分别用于病理观察、蛋白免疫印迹法(Western blot)实验和免疫荧光染色。
2.4 病理观察 小鼠肾脏组织经4%多聚甲醛组织固定液固定24 h,梯度脱水、浸蜡、包埋,4 μm 厚度切片,37 ℃烤片12 h,然后进行苏木精-伊红(HE)染色、Masson 染色,中性树脂封片,显微镜下观察小鼠肾脏组织病理形态。
2.5 Western blot 检测 取20 mg 小鼠肾组织,加入RIPA 裂解液200 μL,匀浆机65 Hz 匀浆1 min,4 ℃、12 000 rpm 离心15 min,离心半径6 cm。BCA 法测定蛋白浓度,加入上样缓冲液和生理盐水配制成浓度为40 μg/μL 的等量蛋白样品。上样,120 V 电泳1 h,300 mA、1 h 30 min 转至PVDF 膜,5%脱脂奶粉室温封闭1 h,分别加入IRE1α 一抗(1∶1 000)、Sirt1一抗(1∶1 000)、Foxo1 一抗(1∶1 000)、Caspase 12 一抗(1∶1 000)、Chop 一抗(1∶1 000)、α-Tubulin 一抗(1∶1 000)、GAPDH 一抗(1∶5 000),4 ℃孵育过夜;PBST 洗膜3 次,加入HRP 标记的山羊抗小鼠IgG(1∶1 000)、山羊抗兔IgG(1∶1 000),室温孵育1 h;PBST 洗膜3 次,ECL 化学发光法显影,凝胶成像系统拍摄。以GAPDH 和α-Tubulin 为内参,计算目的蛋白相对表达量。
2.6 免疫荧光染色 细胞经爬片、干预结束后,4%多聚甲醛室温固定爬片细胞30 min,室温通透细胞20 min,加入1%BSA 室温封闭60 min,加入稀释的IRE1α 一抗(1∶200)、Sirt1 一抗(1∶1 000)、Foxo1 一抗(1∶1 000)、Caspase 12 一抗(1∶400)、Chop 一抗(1∶400),4 ℃孵育过夜;加入荧光二抗(1∶500),避光孵育1 h,加入DAPI 染细胞核5 min,甘油封片,荧光显微镜下观察。
2.7 免疫组化染色 肾组织石蜡切片脱蜡至水,抗原修复,3%牛血清白蛋白溶液(BSA)室温封闭30min,加入IRE1α 一抗(1∶100)、Sirt1 一抗(1∶100)、Foxo1一抗(1∶100)、Caspase12 一抗(1∶100)、Chop 一抗(1∶100)。4 ℃孵育过夜,加二抗室温孵育50 min,二氨基联苯胺(DAB)显色,中性树脂封片,光镜下观察,以棕黄色颗粒为阳性表达。
3 统计学方法
采用SPSS22.0 统计软件和Image J 1.8 软件进行分析。实验数据以均数±标准差(±s)表示,多重比较采用单因素方差分析(one-way ANOVA)。P<0.05 表示有统计学意义。
4 结果
4.1 矢志方对模型小鼠肾组织病理形态的影响 与正常组比较,模型组小鼠肾组织结构紊乱,肾小管管腔扩张、管壁变薄,肾间质炎性细胞浸润,大量蓝色胶原纤维沉积;与模型组比较,矢志方组和非布司他组小鼠肾小管管腔扩张、炎性细胞浸润、蓝色胶原纤维集聚程度减少。见图1。

图1 各组小鼠肾组织形态(×400)Fig.1 Pathological changes of mouse kidney tissue in each group(×400)
4.2 矢志方对高UA 小鼠肾组织和高UA 诱导HK2 细胞Sirt1、IRE1α、Foxo1、Caspase 12、Chop 蛋白表达的影响 Western blot 结果显示,与正常组比较,模型组小鼠肾组织IRE1α、Foxo1、Caspase12、Chop 蛋白表达显著升高(P<0.01 或P<0.001),Sirt1蛋白表达显著降低(P<0.001);与模型组比较,非布司他组小鼠肾组织和矢志方组小鼠肾组织IRE1α、Foxo1、Caspase 12、Chop 蛋白表达显著降低(P<0.001),Sirt1 蛋白表达显著升高(P<0.001)。细胞Western blot 结果与HUA 小鼠肾组织Western blot结果趋势一致,见图2,图3。

图2 各组HK2 细胞Sirt1、IRE1α、Foxo1、Caspase 12、Chop 蛋白表达情况(±s)Fig.2 Protein expressions of Sirt1、IRE1α、Foxo1、Caspase 12、Chop in HK2 cells of each group(±s)
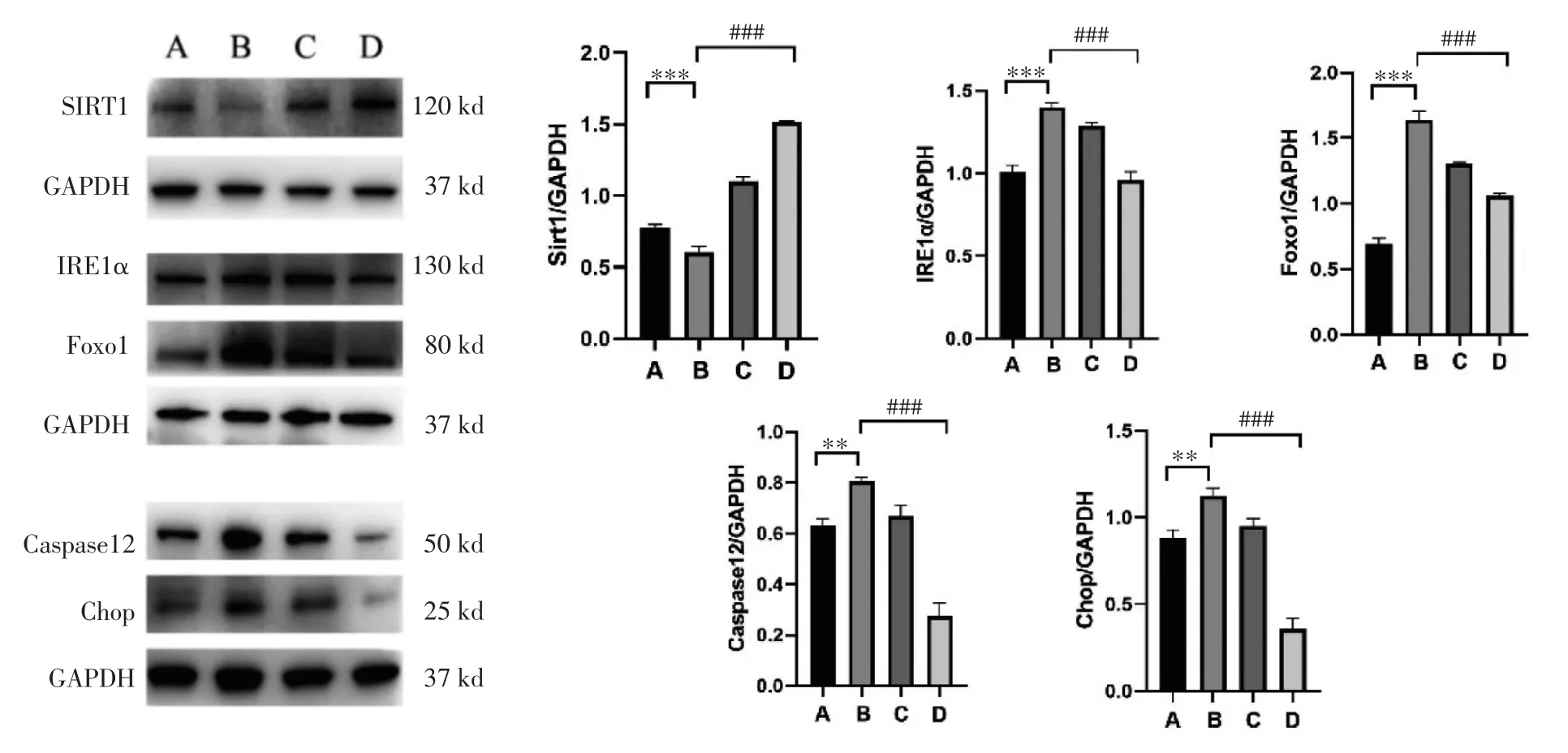
图3 各组小鼠肾组织Sirt1、IRE1α、Foxo1、Caspase 12、Chop 蛋白表达情况(±s)Fig.3 Protein expressions of Sirt1、IRE1α、Foxo1、Caspase 12、Chop in mouse kidney tissue of each group(±s)
4.3 矢志方对高UA 小鼠小鼠肾组织Sirt1、IRE1α、Foxo1、Caspase 12、Chop 表达的影响 免疫组化染色结果显示,与正常组比较,模型组小鼠肾组织IRE1α、Foxo1、Caspase 12、Chop 表达显著升高(P<0.01 或P<0.001),Sirt1 表达显著降低(P<0.001);与模型组比较,非布司他组和矢志方组小鼠肾组织IRE1α、Foxo1、Caspase 12、Chop 表达显著降低(P<0.05,P<0.01 或P<0.001),Sirt1 表达显著升高(P<0.05)。见图4。

图4 各组小鼠肾组织Sirt1、IRE1α、Foxo1、Caspase12、Chop 阳性表达情况(免疫组化染色,×400)Fig.4 Postive expressions of Sirt1、IRE1α、Foxo1、Caspase12、Chop in mouse kidney tissue of each group(Immunohistochemical staining,×400)
4.4 矢志方对高UA 诱导HK2 细胞Sirt1、IRE1α、Foxo1、Caspase12、Chop 表达的影响 免疫荧光染色结果显示,与正常组比较,模型组细胞IRE1α、Foxo1、Caspase 12、Chop 表达显著升高,Sirt1 表达显著降低;与模型组比较,矢志方组细胞IRE1α、Foxo1、Caspase 12、Chop 表达显著降低,Sirt1 表达显著升高。见图5-9。

图5 各组HK2 细胞Sirt1 阳性表达(免疫荧光染色,×400)Fig.5 Postive expressions of Sirt1 in HK2 cells of each group(Immunofluorescence staining,×400)

图6 各组HK2 细胞IRE1α 阳性表达(免疫荧光染色,×400)Fig.6 Postive expressions of IRE1α in HK2 cells of each group(Immunofluorescence staining,×400)

图7 各组HK2 细胞Foxo1 阳性表达(免疫荧光染色,×400)Fig.7 Postive expressions of Foxo1 in HK2 cells of each group(Immunofluorescence staining,×400)

图8 各组HK2 细胞Caspase 12 阳性表达(免疫荧光染色,×400)Fig.8 Postive expressions of Caspase 12 in HK2 cells of each group(Immunofluorescence staining,×400)

图9 各组HK2 细胞Chop 阳性表达(免疫荧光染色,×400)Fig.9 Postive expressions of Chop in HK2 cells of each group(Immunofluorescence staining,×400)
5 讨论
HUA 引起肾损伤的机制十分复杂,主要包括氧化应激、内皮功能障碍、肾纤维化和炎症[3]。本课题组前期研究发现矢志方临床疗效显著,前期基础实验研究表明,矢志方能抑制白细胞介素-1β(IL-1β)IL-1β 表达、促进有机阴离子转运蛋白1/3(OAT1/3)、肝细胞核因子1α/4α(HNF1α/4α)表达减轻HUA 小鼠肾脏损伤。ERS 与肾损伤密切相关[14-15],本研究中发现ERS 的调节因子Sirt1 在HUA 小鼠肾组织中显著下调,给予矢志方干预后能上调Sirt1 表达水平、矢志方还能抑制ERS、改善肾损伤和间质纤维化。因此,Sirt1 和ERS 可能是HUA 诱导的肾间质纤维化的潜在治疗靶点。
内质网是一个表型和功能多样的传感平台,与调节蛋白沉积、脂质代谢、糖异生和钙信号传导等多种细胞功能密切相关,是维持和恢复代谢健康的重要组成部分。内质网稳态的紊乱通常被称为ERS,ERS 是一种功能失衡状态,通过激活内质网激酶(PERK)/真核起始因子2α(eIF2α)途径中C/EBP同源蛋白(Chop)、IRE1α-凋亡信号调节激酶1(ASK1)-c-Jun N 端激酶(JNK)通路、IRE1α-X 盒结合蛋白1(XBP1)-Chop 通路、激活Caspase 12 通路调控细胞凋亡。轻度ERS 时,内质网可通过激活未折叠蛋白反应途径(UPR)启动自噬以恢复内质网稳态,促使细胞存活;当ERS 刺激过强且持续存在时,会过度诱导自噬或激活凋亡途径使细胞死亡。
UPR 包括重建内质网稳态的途径以及触发凋亡的途径,即转录因子依赖和Caspase 12 依赖的途径[16]。在转录因子依赖的途径中,葡萄糖调节蛋白78(GRP78)在ERS 激活时与IRE1 解离,IRE1α 的管腔结构域感知未折叠蛋白的积累,从而导致其二聚化和自身磷酸化。这激活了其胞质内核糖核酸酶活性,启动了两个独立的事件来恢复蛋白沉积。一个是通过调节的IRE1 依赖性衰变(RIDD)降解mRNAs,通过IRE1α 切割并去稳定内质网定位的mRNAs,从而减少新合成的蛋白质进入内质网腔所产生的折叠负担。另一种是X 盒结合蛋白-1(XB P1)mRNA 的非规范特异性剪接[17],XBP1s 还通过丝裂原活化蛋白激酶14(MAPK14)信号的磷酸化在蛋白质水平上受到调节[18]。UPR 的IRE1α-XBP1 途径是维持代谢稳态的关键因素[19-22]。在Caspase 12 依赖性途径中,钙离子(Ca2+)从细胞内储存到胞质溶胶,导致钙蛋白酶转移到内质网,使Caspase 12 活化,然后通过Caspase 9 的激活,诱导Caspase 3 依赖的凋亡途径,以促进细胞凋亡[23]。另外,IRE1 通过上调Chop 转录因子,一方面,活化的Chop 上调B 淋巴细胞瘤-2 基因(Bcl-2)家族促凋亡蛋白Bax 发挥促凋亡作用;另一方面,Chop 促进TRAIL 受体2(DR5)的转录,活化Caspase 8 依赖的外源途径的细胞凋亡。表明Chop 在靶向ERS 激诱导的细胞凋亡中发挥了关键作用[24]。本研究发现矢志方能在体内体外下调IRE1α、Foxo1、Caspase 12、Chop 蛋白表达水平,表明矢志方能通过抑制ERS 缓解肾脏损伤。
Sirt1 是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白去乙酰化酶,参与代谢、衰老、细胞存活、自噬和糖尿病的调节。Sirt1 通过去乙酰化激活各种蛋白质和转录因子。Foxo1 是其中一个被Sirt1 去乙酰化的转录因子,参与细胞的氧化应激抵抗、细胞凋亡、细胞周期阻滞、胰岛素信号转导和代谢等[25]。有研究报道,Sirt1 存在于细胞核中,但它可以穿梭到细胞质中,作为组蛋白的去乙酰化酶,以及许多非组蛋白靶点[26]。受Sirt11 调控的Foxo 转录因子的乙酰化状态可以选择性地将Foxos 定向到特定的靶点,是代谢和应激反应的另一个调控途径[27]。进一步的研究报道,Foxo1 被Sirt1 介导的赖氨酸242、245 和262 的脱乙酰化激活[28]。因为到目前为止已经证明Sirt1 通过调节Foxos 的表达来防止ROS 产生和氧化应激,但是也已经提出增加的氧化应激可以反过来控制Sirt1 活性,但是Foxo 参与该活性的可能性还不清楚[29]。Sirt1 在调节ERS 方面发挥了重要作用,它可通过调控内质网相关分子PERK、GRP78 缓解ERS 减轻阿霉素引起的心脏毒性[30]。本研究结果表明Sirt1 在受高UA 刺激后表达降低,而矢志方能显著激活Sirt1 水平,改善肾脏损伤,并且下调ERS 相关蛋白,说明Sirt1 可通过调控ERS 减轻HUA 所导致的肾损伤。
综上所述,矢志方可减轻HUA 小鼠肾脏损伤,其机制与激活Sirt1-Foxo1 通路抑制ERS 相关蛋白及下游Chop、Caspase 12 蛋白表达有关。然而,HUA引发ERS,以及进一步导致肾损伤并没有完全了解,还有待进一步研究。
——载人深潜研发团队

