灵芝三萜真空耦合超声提取工艺优化及其抗帕金森病活性
吴淑珍,王 成,桂双英,彭 灿,罗建平,李强明*
(1.合肥工业大学,安徽 合肥 240603;2.霍山县天下泽雨生物科技发展有限公司,安徽 六安 237200;3.安徽中医药大学,安徽 合肥 230012)
灵芝作为传统名贵中药,具有补气安神、止咳平喘、延年益寿等功效[1-3],灵芝三萜是其主要活性成分之一,有着护肝、抗病毒、抗肿瘤等活性,开发前景广泛[4-5],目前其提取方法主要有热回流提取[6]、超声提取[7]、超临界提取[8]、酶提取[9]等,但存在温度高、时间长、操作繁琐、成本高昂等缺点。真空耦合超声提取是在真空条件下对中药活性成分进行超声提取的方法,其中真空通过降低溶剂沸点来实现低温高效提取,而超声通过空化效应来加速活性成分溶出[10],其省时、省力、高效,但尚未应用于灵芝三萜的提取。因此,本实验优化灵芝三萜真空耦合超声提取工艺。
帕金森病是以中脑黑质多巴胺能神经元变性死亡为病理特征,静止性震颤、运动迟缓、肌强直等为临床表现的第二大神经退行性疾病,目前临床上仍主要以左旋多巴等药物进行对症治疗,但不能挽救多巴胺能神经元变性死亡,故发掘相关中药活性成分具有重要意义[11]。根据灵芝传统功效,课题组前期推测灵芝三萜可能具有抗帕金森病活性,但未见相关报道,故本实验通过建立小鼠帕金森病模型来对此进行研究。
1 材料
1.1 试剂与药物 齐墩果酸对照品(上海源叶生物科技有限公司,纯度≥98%)。1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP) (上海碧云天生物技术有限公司,纯度≥98%)。乙醇、左旋多巴、冰醋酸、氯化钠、CMC-Na、蒸馏水、高氯酸、水合氯醛、多聚甲醛(国药集团化学试剂有限公司)。
1.2 仪器 AL104 电子天平[梅特勒-托利多仪器(上海) 有限公司];V-5000 可见分光光度计(上海元析仪器有限公司);HH-1 数显恒温水浴锅(常州国宇仪器制造有限公司);KQ-300DE 数控超声波清洗器(昆山市超声仪器有限公司);GM-0.33A 隔膜真空泵(天津市津腾实验设备有限公司);KW-6C 疲劳转棒仪(南京卡尔文生物科技有限公司)。
1.3 药材 灵芝子实体购自霍山县天下泽雨生物科技发展有限公司,经合肥工业大学罗建平教授鉴定为正品。
1.4 动物 SPF 级C57BL/6 雄性小鼠,6~8 周龄,体质量20~25 g,购自常州卡文斯实验动物有限公司,动物生产许可证号 SCXK (豫)2020-0005。
2 方法
2.1 灵芝三萜含量、得率测定
2.1.1 线性关系考察 参考文献[9] 报道,以齐墩果酸为对照品,在546 nm 波长处测定吸光度,以其为纵坐标(A),质量浓度为横坐标(X) 进行回归,得方程为A=58.225X-0.047 3 (R2=0.995 0)。
2.1.2 测定方法 精密量取供试品溶液0.2 mL,置于10 mL 离心管中,按“2.1.1” 项下方法测定吸光度,计算含量。再测定该成分得率,公式为得率=(CV/M) ×100%,其中C为供试品溶液质量浓度,V为滤液体积,M为灵芝子实体粉末质量。
2.2 单因素试验 将灵芝子实体粉碎10 min 后过200 目筛,得到超微粉,置于60 ℃烘箱中干燥至恒重,精密称取1 g 至具塞锥形瓶中,加入90%乙醇30 mL,设定超声功率为240 W,开启真空泵形成负压,通过二通阀调节真空度为0.08 MPa,在30 ℃下超声提取,分别考察不同超声时间(5、10、20、40、80 min)、超声温度 (20、30、40、50、60 ℃)、乙醇体积分数 (70%、80%、90%、95%、100%)、料液比(1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶ 50)、超声功率 (150、180、240、270、300 W) 对灵芝三萜得率的影响。
2.3 正交试验 在单因素试验基础上,选择提取时间(A)、提取温度(B)、乙醇体积分数(C)、料液比 (D) 进行四因素三水平设计,具体见表1。

表1 因素水平Tab.1 Factors and levels
2.4 抗帕金森病活性研究
2.4.1 灵芝三萜制备 将优化工艺所得的灵芝三萜按照文献[12] 报道进行纯化,先用氯仿萃取浓缩,再用相同体积的饱和NaHCO3溶液提取4次,盐酸调节pH 至3~4,将沉淀溶于氯仿中减压干燥,测得得率为0.38%。
2.4.2 分组、造模及给药 参考文献[13] 报道,50 只小鼠随机均分为正常组、模型组、阳性药组(L-多巴胺,75 mg/kg)、灵芝三萜高剂量组(200 mg/kg)、灵芝三萜低剂量组(100 mg/kg),阳性药组、灵芝三萜各剂量组小鼠均连续灌胃给药14 d。从给药第4 天开始,模型组、阳性药组、灵芝三萜各剂量组小鼠均腹腔注射MPTP(30 mg/kg),连续7 d,正常组小鼠灌胃给予生理盐水。
2.4.3 行为学测试
2.4.3.1 转棒实验 将小鼠依次放置在转棒仪上,设定转速为40 r/min,记录从登棒到掉棒的时间,从造模前3 d 开始训练,每天1 次。末次给药后,每只小鼠进行3 次测试,取平均值。
2.4.3.2 悬挂实验 将小鼠前爪挂在直径5 mm的玻璃棒上(为了防止其趴在玻璃棒上,用透明塑料板将顶部盖住),记录抓住玻璃棒的时间,从造模前3 d 开始悬挂训练,每天3 次。末次给药后,每只小鼠进行3 次测试,取平均值。
2.4.4 脑组织指标检测
2.4.4.1 黑质致密部Nissl 染色 处死小鼠,取脑组织黑质致密部,石蜡包埋后进行切片,按照Nissl 试剂盒操作步骤进行染色,最后封片并进行拍照。
2.4.4.2 黑质致密部、纹状体酪氨酸羟化酶(TH) 免疫组织化学 处死小鼠,取脑组织黑质致密部、纹状体部位,石蜡包埋后进行切片,按照免疫组织化学步骤进行操作,统计TH 免疫反应阳性神经元情况[14]。
2.5 图像分析 参考文献[14-16] 报道,采用Image-pro Plus 软件统计小鼠脑组织中神经元数量。
2.6 数据分析 通过GraphPad Prism 软件进行数据处理,one-way ANOVN 单因素方差分析、多重比较分析进行统计学分析,结果以(±s) 表示。以P<0.05 为差异具有统计学意义。
3 结果
3.1 单因素试验
3.1.1 超声时间 图1 显示,灵芝三萜得率随着超声提取时间延长先升高,可能是由于超声波空化效应破坏了细胞壁,促使该成分溶出,在40 min时最高;40 min 后其得率反而降低,可能与不断超声会破坏结构成分有关[17]。

图1 超声时间对灵芝三萜得率的影响Fig.1 Effect of ultrasonic time on yield of Ganoderma lucidum triterpenoids
3.1.2 超声温度 图2 显示,灵芝三萜得率随着超声温度增加先升高,表明高温会加快分子运动速度,促进该成分浸出,在50 ℃时最高;50 ℃后其得率反而降低,可能与温度过高会破坏结构成分有关。
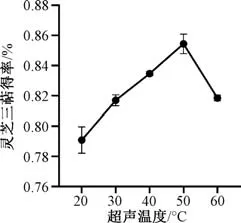
图2 超声温度对灵芝三萜得率的影响Fig.2 Effect of ultrasonic temperature on yield of Ganoderma lucidum triterpenoids
3.1.3 乙醇体积分数 图3 显示,灵芝三萜得率随着乙醇体积分数增加先升高,在90% 时最高;之后其得率反而降低,可能与醇类成分溶出增加会导致三萜类成分溶出减少有关[18]。

图3 乙醇体积分数对灵芝三萜得率的影响Fig.3 Effect of ethanol concentration on yield of Ganoderma lucidum triterpenoids
3.1.4 料液比 图4 显示,灵芝三萜得率随着料液比增加先升高后趋于平稳,在1 ∶20 时最高,可能是因为其传质过程有所加快[19]。
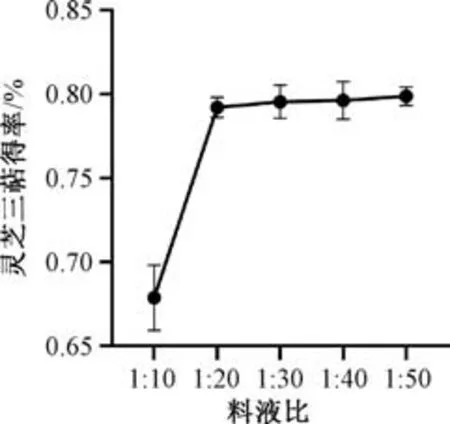
图4 料液比对灵芝三萜得率的影响Fig.4 Effect of solid-liquid ratio on yield of Ganoderma lucidum triterpenoids
3.1.5 超声功率 图5 显示,灵芝三萜得率随着超声功率增加先升高,在240 W 时最高;240 W 后其得率反而降低,可能与溶液分子运动加剧有关[20]。
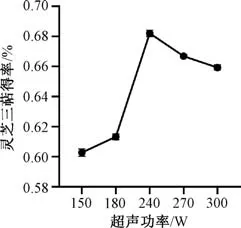
图5 超声功率对灵芝三萜得率的影响Fig.5 Effect of ultrasonic power on yield of Ganoderma lucidum triterpenoids
3.2 正交试验 在单因素试验基础上,以灵芝三萜得率为评价指标,采用L9(34) 表进行设计,结果见表2。由此可知,提取时间影响程度最大,料液比影响程度最小;最优工艺为A3B3C3D2,即超声时间60 min,超声温度60 ℃,乙醇体积分数95%,料液比1 ∶20。
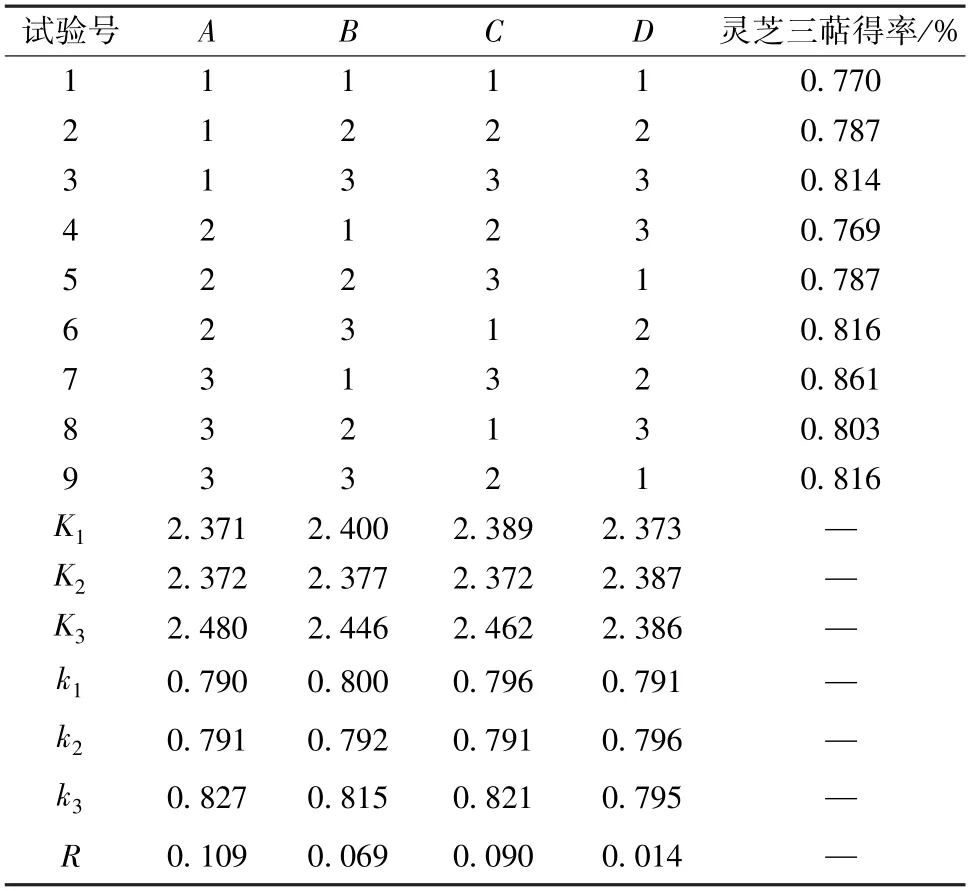
表2 试验设计与结果Tab.2 Design and results of tests
3.3 验证试验、对比试验 对“3.2” 项下工艺进行5 批验证试验,测得灵芝三萜平均得率为0.887%,大于表2 最大值,表明该工艺稳定可靠。再参照文献 [21] 报道进行提取,即超声时间40 min,超声温度30 ℃,乙醇体积分数90%,料液比1 ∶30,测得灵芝三萜平均得率为0.551%,而验证试验结果与其相比提高了60.98%,进一步印证了真空耦合超声提取的优越性。
3.4 行为学检测 如图6A 所示,与模型组比较,灵芝三萜各剂量组小鼠转棒时间延长(P<0.05)。如图6 所示,与模型组比较,灵芝三萜各剂量组小鼠悬挂时间延长(P<0.05,P<0.01)。

图6 小鼠行为学检测结果Fig.6 Results of mouse behavioral detection
3.5 脑组织检测 如图7A 所示,模型组小鼠黑质致密部Nissl 阳性细胞数少于正常组(P<0.05),而灵芝三萜各剂量组小鼠其数量多于模型组(P<0.05,P<0.01)。如图7B 所示,模型组小鼠黑质致密部TH 阳性细胞数少于正常组(P<0.01),而灵芝三萜各剂量组小鼠其数量多于模型组(P<0.01)。如图7C 所示,模型组小鼠纹状体TH 阳性纤维数少于正常组(P<0.01),而灵芝三萜各剂量组小鼠其数量多于模型组(P<0.01)。

图7 小鼠脑组织检测结果Fig.7 Results of mouse brain tissue detection
4 讨论与结论
前期报道,李颜桃等[10]采用真空耦合超声提取沙棘籽多酚,操作简便,得率较高;田莉等[22]通过该方法提取苹果渣多酚,时间缩短,得率提高。本实验发现,灵芝三萜以该方法提取后得率较前期方法增加60.98%,进一步印证了其优越性。
研究表明,灵芝三萜具有多种生物活性,Yu等[23]证明它可改善小鼠认知障碍,减轻神经元损伤,从而改善阿尔茨海默症;俞盈等[24]通过睡眠实验发现,灵芝三萜酸可有效改善睡眠,但目前还未见该成分抗帕金森病的研究。本实验采用MPTP诱导的小鼠帕金森病模型来评价灵芝三萜抗帕金森病活性,发现该成分可显著改善多巴胺能神经元缺失、运动功能障碍,能为后续相关药物开发奠定基础,但其分子机制尚不明确,有待于进一步研究。

