苦参素对2 型糖尿病雄性大鼠生殖损伤及Nrf2/HO-1 信号通路的影响*
杨芳,马静芬,郑聪聪,韦志坤
(1.邯郸市中心医院,邯郸 056008;2.邯郸市第一医院,邯郸 056002)
糖尿病是一种以高血糖为主要特征的慢性代谢性疾病,根据国际糖尿病联合会(IDF)报告,2021 年全球糖尿病患者约5.37 亿,预计2045 年将上升至7.83 亿,其中2 型糖尿病(T2DM)患者占90%以上[1]。糖尿病会导致包括男性生殖损伤在内的多种系统性健康问题,有研究报道糖尿病男性精子浓度与活力均明显低于正常男性,损伤男性生殖功能,与空腹血糖呈负相关[2]。病理学研究发现,高血糖引起线粒体活性氧(ROS)过度生成导致氧化应激,是糖尿病并发症发生发展的重要机制之一[3]。E2相关因子2(Nrf2)/血红素加氧酶1(HO-1)是参与调控氧化应激的重要信号通路,研究证实,通过调控Nrf2/HO-1 信号通路抑制氧化应激能够改善糖尿病雄性大鼠生殖损伤[4]。
苦参素(OMT)又名氧化苦参碱,是由苦参根茎中提取的一类活性生物碱,具有较好的抗氧化、抗炎作用[5]。有文献报道OMT 能够通过激活Nrf2/HO-1信号通路减轻急性肝衰竭小鼠和肝硬化大鼠氧化应激损伤[6-7],并且能够减轻糖尿病所致心肌组织损伤[8]。但OMT 能否通过抑制氧化应激减轻糖尿病雄性大鼠生殖损伤尚未见文献报道,本实验通过OMT干预T2DM 雄性大鼠模型,探讨OMT 对T2DM 雄性大鼠生殖损伤及Nrf2/HO-1 信号通路的影响,以期为临床防治T2DM 男性患者生殖损伤提供新的思路。
1 材料与方法
1.1 实验动物 53 只清洁级雄性SD 大鼠购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0011,6 周龄,体质量200~220 g。饲养于河北省中西医结合医药研究院,控制室温23~25 ℃、相对湿度50%~70%、光暗各12 h 循环。本实验通过邯郸市中心医院伦理委员会审批[HDZXYY(K)字2022-006],所有实验动物操作严格遵循3R 原则。
1.2 药物与试剂 OMT 片(规格:0.1 g/片)购自山东齐都药业有限公司(批号:202203019);二甲双胍(Met,规格:0.25 g/片)购自北京中新药业股份有限公司(批号:202204B03005);链脲佐菌素(STZ)和比色法检测超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)试剂盒购自上海碧云天生物技术有限公司(货号:ST1668、S0109、S0051、S0131S);酶联免疫吸附(ELISA)法检测睾酮(T)、黄体生成素(LH)、卵泡刺激素(FSH)试剂盒购自泉州市睿信生物科技有限公司(货号:RXJ302700R、RX303076R、RX302805R);ELISA 法检测促性腺激素释放激素(GnRH)试剂盒、苏木精-伊红(HE)染色试剂盒、ECL 发光液购自南京建成生物工程研究所(货号:H297、D006-1-1、W028-2-1);总RNA 提取试剂TRIzol 购自北京索莱宝生物科技有限公司(批号:R1100);逆转录试剂盒购自美国Thermo Fisher公司(批号:013071205);实时荧光定量聚合酶链式反应(RT-PCR)试剂盒购自日本Takara 公司(批号:RR651A);RIPA 裂解液和Nrf2 抗体、p-Nrf2 抗体、HO-1 抗体、β-actin 抗体购自北京博奥森生物技术有限公司(货号:C5028、bs-1074R、bs-2013R、bs-2075R、bs-0061R);IgG 二抗和BCA 法蛋白定量试剂盒购自美国SantaCruz 公司(货号:sc-2357、sc-14036)。
1.3 实验方法
1.3.1 模型制备与给药 53 只实验用大鼠适应性饲养1 周后,随机8 只设为正常(Normal)组,Normal组大鼠继续常规饲养。剩余45 只参照Rahimiyan-Heravan 等[9]报道的方法,通过高脂饮食(58%脂肪+17%蛋白质+25%碳水化合物)喂养4 周,禁食12 h后35 mg/kg 腹腔注射STZ 制备T2DM 大鼠模型,注射STZ 1 周后检测空腹血糖(FBG)水平>16.7 mmol/L即可判断造模成功。共造模成功42 只大鼠,去除FBG 水平最低的2 只后,将剩余40 只成模大鼠随机分为模型(Model)组、Met 组和OMT 低、中、高剂量组,每组8 只。Met 组每日1 次灌胃给药200 mg/kg[10],OMT 低、中、高剂量组分别每日1 次灌胃给药25、50、100 mg/kg(参照人临床使用剂量,根据大鼠与人剂量换算公式计算,OMT 低、中、高剂量组分别相当于人临床剂量的1/2 倍、1 倍、2 倍),Normal 组和Model 组每日1 次灌胃给予生理盐水,疗程4 周。
1.3.2 FBG 水平和血清T、GnRH、LH、FSH 含量检测 治疗完成后,禁食禁水12 h,经尾静脉取血并通过动物血糖仪(JPS-5 型,北京怡成生物科技公司)检测FBG 水平。麻醉后开腹、经腹主动脉取血5 mL,室温静置30 min 后2 000 r/min 离心(24D 型台式离心机,深圳市赛泰克生物科技有限公司,离心半径10 cm)5 min 取血清,遵照ELISA 试剂盒说明,通过酶标仪(MB-530 型,深圳汇松科技公司)检测血清T、GnRH、LH、FSH 含量。
1.3.3 睾丸质量和睾丸体积测量 取左侧睾丸,生理盐水冲洗并拭干后称其质量;测量睾丸上下径(L1)、前后径(L2)和左右径(L3),睾丸体积=π×L1×L2×L3/6。
1.3.4 HE 染色法观察睾丸病理学改变及输精管直径(STD)和输精管上皮厚度(TSE)测量 将测量后左侧睾丸置于10%中性甲醛溶液中固定48 h,脱水、石蜡埋机(TEC 5 型组织包埋机,日本樱花公司)、4 μm 厚度连续切片(RM-2135 型石蜡切片机,德国Leica 公司)、展片、烤片、脱蜡处理后,按照试剂盒操作说明进行HE 染色,在光学显微镜(CX41 型,日本Olympus 公司)下观察睾丸病理学改变。在显微镜下,应用目镜测微计测量STD 和TSE,每只大鼠随机取15 个输精管进行测量,取平均值。
1.3.5 精子数量、精子存活率和精子活力检测 取大鼠右侧附睾,加入37 ℃平衡盐溶液1 mL 后剪碎,反复吹打使精子充分游离,取10 μL 上层液体加入37 ℃平衡盐溶液稀释至1 mL,通过精液分析仪(AS-CASA 型,俄罗斯ASL 公司)检测精子数量和精子存活率。取1 滴新鲜精液和2 滴生理盐水置于37 ℃载玻片上,在400 倍光学显微镜(CX41 型,日本Olympus 公司)下选取200 个以上精子进行精子活力分级,参照文献[11]报道的精子活力分级标准:沿直线快速前进为a 级,沿直线或曲线缓慢前进为b 级,摇尾但不向前移动为c 级,不摇尾且不移动为d 级。
1.3.6 睾丸组织抗氧化酶(SOD、GSH-Px)活性和MDA 含量检测 取右侧睾丸部分组织,加入9 倍量(质量比)4 ℃生理盐水后研磨匀浆,4 ℃、3 500 r/min离心(24D 型台式离心机,深圳市赛泰克生物科技有限公司,离心半径10 cm)10 min 取上清,采用比色法,通过分光光度计(ND2000C 型,美国Thermo 公司)检测SOD、GSH-Px 活性和MDA 含量。
1.3.7 睾丸组织Nrf2、HO-1 mRNA 表达检测 取部分右侧睾丸组织,TRIzol 法提取睾丸组织总RNA并逆转录成cDNA,以cDNA 作为模板进行PCR(Quant Studio 5 型PCR 仪,美国ABI 公司)扩增,扩增程序设置为:95 ℃10 min 行预变性;95 ℃30 s、60 ℃30 s,重复40 个循环。以GAPDH 为内参基因,运用公式2-ΔΔCt计算Nrf2、HO-1 mRNA 相对表达量。引物序列由北京擎科新业生物公司设计并合成,引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.3.8 睾丸组织Nrf2、p-Nrf2、HO-1 蛋白表达检测 取100 mg 右侧睾丸组织,加入1 mL 4 ℃RIPA裂解液,组织剪碎后研磨匀浆,冰上静置30 min,4 ℃12000 r/min 离心(CR22N 型高速低温离心机,日本Hitachi 公司,离心半径8 cm)30 min 取上清,BCA法测定总蛋白浓度,各组均以30 μg 总蛋白量上样行10%SDS-PAGE 凝胶电泳(1659001 型电泳仪,美国Bio-Rad 公司)、半干法转至PVDF 膜(Turbo型转膜仪,美国Bio-Rad 公司)、5%蛋白封闭液37 ℃封闭2 h,洗膜后加一抗稀释液Nrf2(1∶1 000)、p-Nrf2(1∶1 000)、HO-1(1∶1 000)、β-actin(1∶2 000)4 ℃孵育过夜,洗膜后加二抗IgG 稀释液(1∶2 000)37 ℃孵育1.5 h,洗膜后ECL 显影,通过化学发光成像分析仪(Image Quant LAS4000 型,美国GE Healthcare 公司)拍照,通过Image J 软件分析蛋白条带灰度值。
1.4 统计学方法 运用SPSS 20.0 软件进行统计分析,计量资料符合正态分布以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间多重比较行LSD-t 检验(方差齐时)或Dunnett’T3 检验(方差不齐时),P<0.05 表示差异有统计学意义。
2 结果
2.1 OMT 对T2DM 雄性大鼠FBG 水平的影响 与Normal 组比较,Model 组大鼠FBG 水平明显升高(P<0.05)。与Model 组比较,Met 组和OMT 低、中、高剂量组FBG 水平明显降低(P<0.05);OMT 低、中、高剂量组该作用呈现剂量依赖性(P<0.05)。与Met组比较,OMT 低、中剂量组FBG 水平明显升高(P<0.05),OMT 高剂量组FBG 水平差异无统计学意义(P>0.05)。见表2。
表2 OMT 对T2DM 雄性大鼠FBG 和血清T、GnRH、LH、FSH 水平的影响(±s)Tab.2 Effects of OMT on FBG and the level of T,GnRH,LH,FSH in serum of male rats with T2DM(±s)
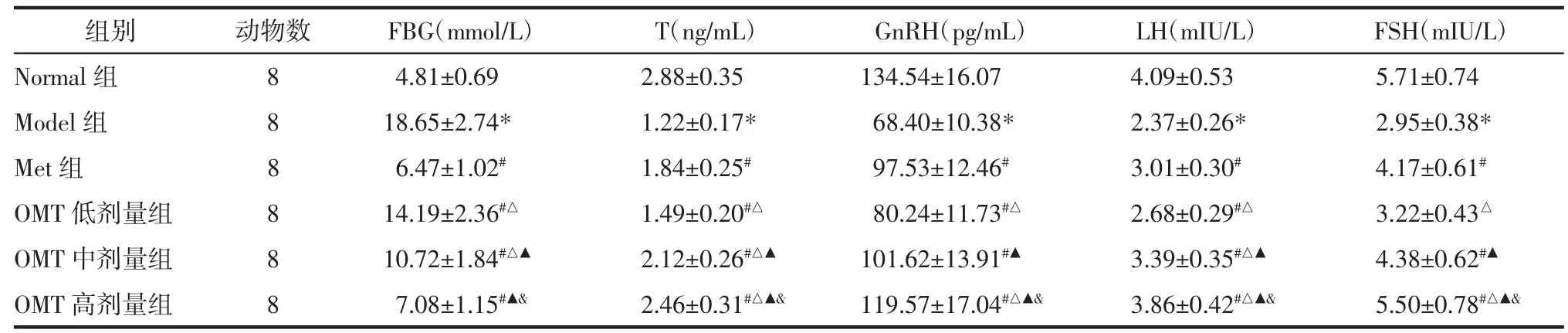
表2 OMT 对T2DM 雄性大鼠FBG 和血清T、GnRH、LH、FSH 水平的影响(±s)Tab.2 Effects of OMT on FBG and the level of T,GnRH,LH,FSH in serum of male rats with T2DM(±s)
注:与Normal 组比较,*P<0.05;与Model 组比较,#P<0.05;与Met 组比较,△P<0.05;与OMT 低剂量组比较,▲P<0.05;与OMT 中剂量组比较,&P<0.05。
组别动物数FBG(mmol/L)T(ng/mL)GnRH(pg/mL)LH(mIU/L)FSH(mIU/L)Normal 组84.81±0.692.88±0.35134.54±16.074.09±0.535.71±0.74 Model 组818.65±2.74*1.22±0.17*68.40±10.38*2.37±0.26*2.95±0.38*Met 组86.47±1.02#1.84±0.25#97.53±12.46#3.01±0.30#4.17±0.61#OMT 低剂量组814.19±2.36#△1.49±0.20#△80.24±11.73#△2.68±0.29#△3.22±0.43△OMT 中剂量组810.72±1.84#△▲2.12±0.26#△▲101.62±13.91#▲3.39±0.35#△▲4.38±0.62#▲OMT 高剂量组87.08±1.15#▲&2.46±0.31#△▲&119.57±17.04#△▲&3.86±0.42#△▲&5.50±0.78#△▲&
2.2 OMT 对T2DM 雄性大鼠血清T、GnRH、LH、FSH 水平的影响 与Normal 组比较,Model 组大鼠血清T、GnRH、LH、FSH 水平明显降低(P<0.05)。与Model 组比较,Met 组和OMT 低、中、高剂量组T、GnRH、LH 水平明显升高,Met 组和OMT 中、高剂量组FSH 水平明显升高(P<0.05);OMT 低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met 组比较,OMT 低剂量组T、GnRH、LH、FSH 水平明显降低(P<0.05);OMT 中剂量组T、LH 水平明显升高(P<0.05),GnRH、FSH 水平差异无统计学意义(P>0.05);OMT 高剂量组T、GnRH、LH、FSH 水平明显升高(P<0.05)。见表2。
2.3 OMT 对T2DM 雄性大鼠睾丸质量和睾丸体积的影响 与Normal 组比较,Model 组大鼠睾丸质量和睾丸体积明显降低(P<0.05)。与Model 组比较,Met 组和OMT 低、中、高剂量组睾丸质量和睾丸体积明显升高(P<0.05);OMT 低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met 组比较,OMT低、中剂量组睾丸质量和睾丸体积差异无统计学意义(P>0.05);OMT 高剂量组睾丸质量和睾丸体积明显升高(P<0.05)。见表3。
表3 OMT 对T2DM 雄性大鼠睾丸质量和睾丸体积的影响(±s)Tab.3 Effects of OMT on the mass and volume of testicular tissue in male rats with T2DM(±s)
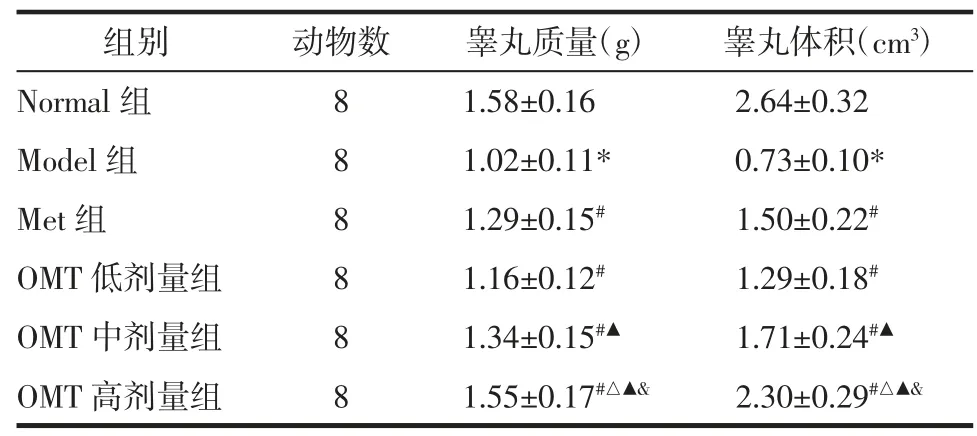
表3 OMT 对T2DM 雄性大鼠睾丸质量和睾丸体积的影响(±s)Tab.3 Effects of OMT on the mass and volume of testicular tissue in male rats with T2DM(±s)
注:与Normal 组比较,*P<0.05;与Model 组比较,#P<0.05;与Met 组比较,△P<0.05;与OMT 低剂量组比较,▲P<0.05;与OMT 中剂量组比较,&P<0.05。
组别动物数睾丸质量(g)睾丸体积(cm3)Normal 组81.58±0.162.64±0.32 Model 组81.02±0.11*0.73±0.10*Met 组81.29±0.15#1.50±0.22#OMT 低剂量组81.16±0.12#1.29±0.18#OMT 中剂量组81.34±0.15#▲1.71±0.24#▲OMT 高剂量组81.55±0.17#△▲&2.30±0.29#△▲&
2.4 OMT 对T2DM 雄性大鼠睾丸组织病理学改变及STD、TSE 的影响 Normal 组大鼠睾丸组织输精管排列整齐、结构完整,精子发生正常。Model 组睾丸组织呈现输精管萎缩、管腔直径变窄、上皮厚度变薄,生精上皮结构紊乱,精原细胞退化、脱落、数量减少等病理学改变。与Model 组比较,Met 组和OMT 低、中、高剂量组睾丸组织病理学改变不同程度改善,OMT 低、中、高剂量组改善效果呈现剂量依赖性,OMT 高剂量组改善效果优于Met 组。与Normal 组比较,Model 组大鼠睾丸组织STD、TSE 明显降低(P<0.05)。与Model 组比较,Met 组和OMT低、中、高剂量组STD、TSE 明显升高(P<0.05),OMT低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met 组比较,OMT 低剂量组STD、TSE 明显降低(P<0.05);OMT 中剂量组STD 明显升高(P<0.05),TSE 差异无统计学意义(P>0.05);OMT 高剂量组STD、TSE 明显升高(P<0.05)。见图1、表4。
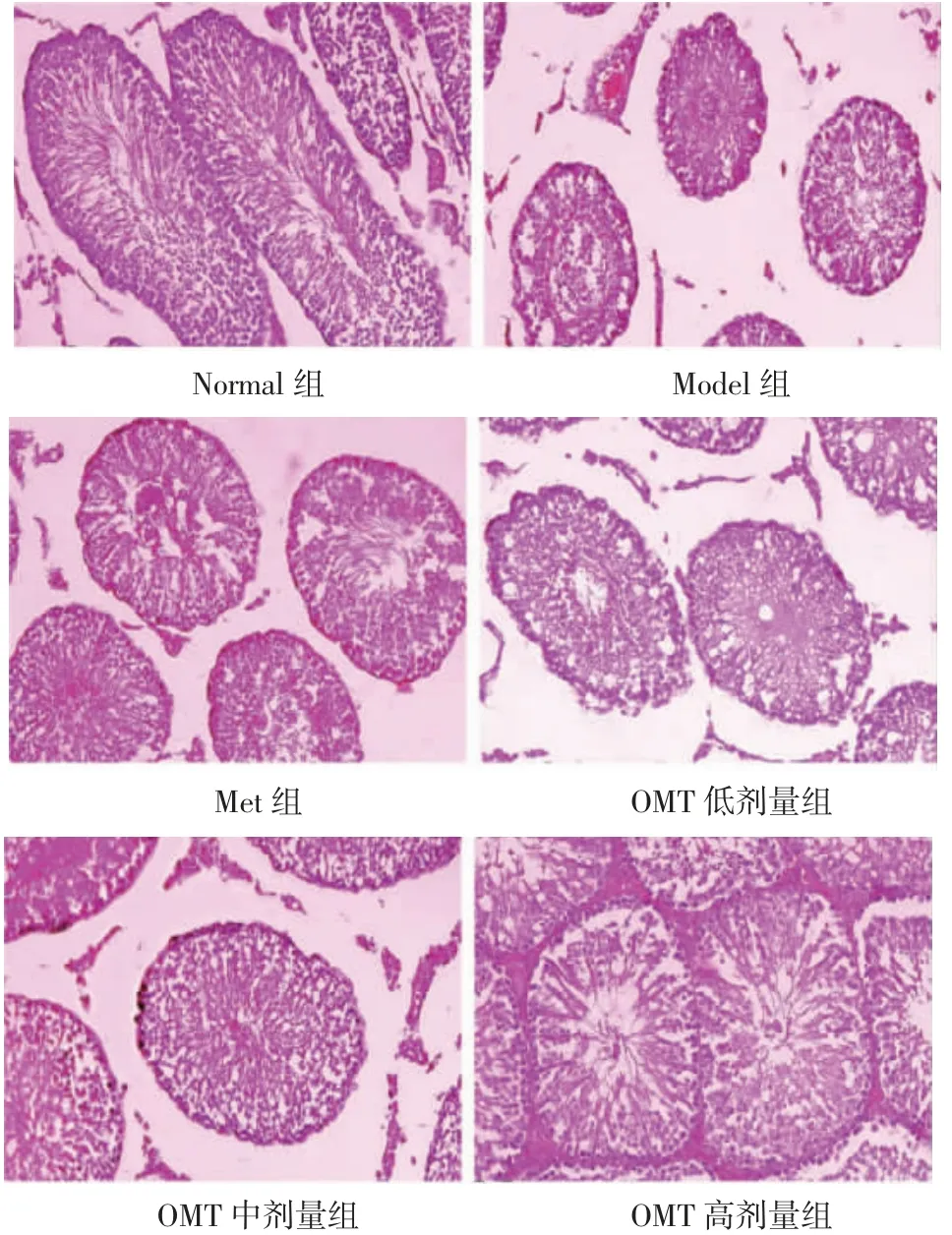
图1 OMT 对T2DM 雄性大鼠睾丸组织病理学改变的影响(HE 染色,×400)Fig.1 Effect of OMT on histopathological changes of testicular tissue in male rats with T2DM(HE staining,×400)
表4 OMT 对T2DM 雄性大鼠睾丸组织STD、TSE 的影响(±s)Tab.4 Effects of OMT on the STD and TSE of testicular tissue in male rats with T2DM(±s)
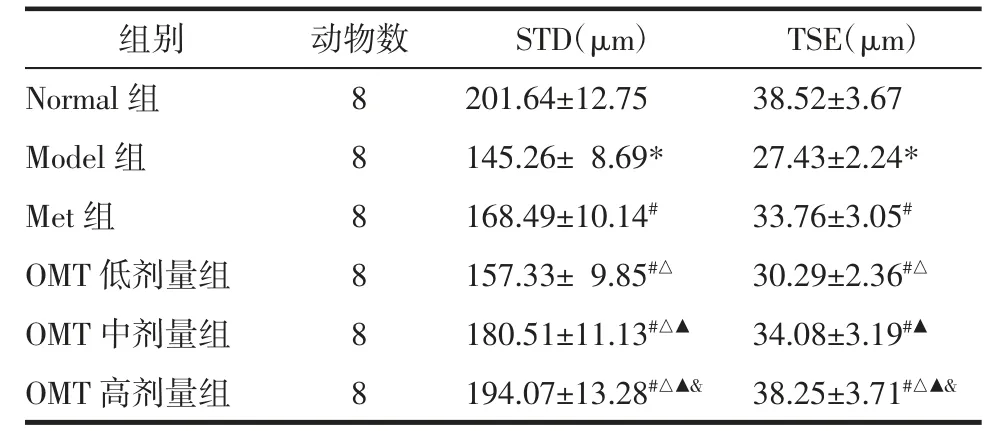
表4 OMT 对T2DM 雄性大鼠睾丸组织STD、TSE 的影响(±s)Tab.4 Effects of OMT on the STD and TSE of testicular tissue in male rats with T2DM(±s)
注:与Normal 组比较,*P<0.05;与Model 组比较,#P<0.05;与Met 组比较,△P<0.05;与OMT 低剂量组比较,▲P<0.05;与OMT 中剂量组比较,&P<0.05。
组别动物数STD(μm)TSE(μm)Normal 组8201.64±12.7538.52±3.67 Model 组8 8量组8145.26± 8.69*27.43±2.24*Met 组168.49±10.14#33.76±3.05#OMT 低剂157.33± 9.85#△30.29±2.36#△OMT 中剂量组8180.51±11.13#△▲34.08±3.19#▲OMT 高剂量组8194.07±13.28#△▲& 38.25±3.71#△▲&
2.5 OMT 对T2DM 雄性大鼠精子数量、精子存活率和精子活力的影响 与Normal 组比较,Model 组大鼠精子数量、精子存活率和(a+b)级活力精子明显降低(P<0.05)。与Model 组比较,Met 组和OMT低、中、高剂量组精子数量、精子存活率、(a+b)级活力精子明显升高(P<0.05);OMT 低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met 组比较,OMT 低剂量组精子数量明显降低(P<0.05),精子存活率和(a+b)级活力精子差异无统计学意义(P>0.05);OMT 中剂量组精子数量和精子存活率明显升高(P<0.05),(a+b)级活力精子差异无统计学意义(P>0.05);OMT 高剂量组精子数量、精子存活率和(a+b)级活力精子明显升高(P<0.05)。见表5。
表5 OMT 对T2DM 雄性大鼠精子数量、精子存活率和精子活力的影响(±s)Tab.5 Effects of OMT on sperm count,sperm survival rate and sperm motility in male rats with T2DM(±s)
注:与Normal 组比较,*P<0.05;与Model 组比较,#P<0.05;与Met 组比较,△P<0.05;与OMT 低剂量组比较,▲P<0.05;与OMT 中剂量组比较,&P<0.05。
精子活力(%)a 级b 级c 级d 级(a+b)级Normal 组867.92±6.5780.86±8.4564.17±4.9328.05±2.324.36±0.253.42±0.2192.22±5.80 Model 组813.01±2.24*41.73±3.93*51.26±4.87* 21.18±1.64* 13.48±0.95*14.03±1.07*72.49±4.63*Met 组839.50±4.63#49.85±4.71#58.74±5.10#24.82±2.09#8.73±0.65#7.71±0.62#83.56±4.91#OMT 低剂量组827.24±3.18#△50.64±5.28#54.08±4.9525.06±2.33#8.24±0.70#13.22±1.14△78.54±4.86#OMT 中剂量组847.01±5.29#△▲ 59.17±5.54#△▲59.57±5.03#▲ 25.46±2.41#6.59±0.52#△▲8.38±0.70#▲85.03±5.27#▲OMT 高剂量组861.48±6.52#△▲& 71.08±6.46#△▲& 63.82±5.17#▲ 27.40±2.85#5.26±0.49#△▲& 3.52±0.29#△▲& 91.22±5.45#△▲&组别动物数精子浓度(106 个/mL)精子存活率(%)
2.6 OMT 对T2DM 雄性大鼠睾丸组织SOD、GSHPx 活性和MDA 含量的影响 与Normal 组比较,Model 组大鼠睾丸组织SOD、GSH-Px 活性明显降低,MDA 含量明显升高(P<0.05)。与Model 组比较,Met 组和OMT 低、中、高剂量组SOD、GSH-Px 活性明显升高,MDA 含量明显降低(P<0.05);OMT 低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met 组比较,OMT 低剂量组GSH-Px 活性明显降低、MDA 含量明显升高(P<0.05),SOD 活性差异无统计学意义(P>0.05);OMT 中剂量组SOD 活性明显升高(P<0.05),GSH-Px 活性和MDA 含量差异无统计学意义(P>0.05);OMT 高剂量组SOD 活性明显升高、MDA 含量明显降低(P<0.05),GSH-Px 活性差异无统计学意义(P>0.05)。见表6。
表6 OMT 对T2DM 雄性大鼠睾丸组织SOD、GSH-Px活性和MDA 含量的影响(±s)Tab.6 Effects of OMT on the activity of SOD,GSH-Px and the content of MDA of testicular tissue in male rats with T2DM(±s)
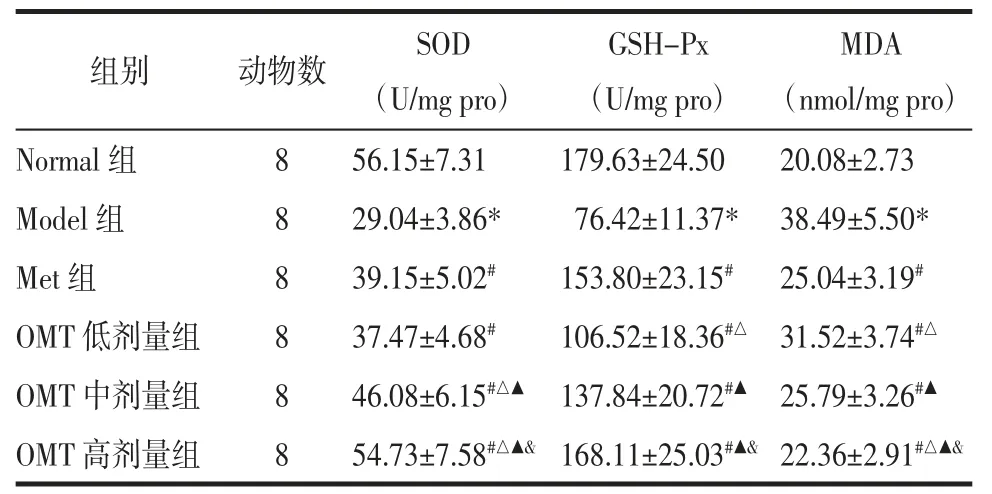
表6 OMT 对T2DM 雄性大鼠睾丸组织SOD、GSH-Px活性和MDA 含量的影响(±s)Tab.6 Effects of OMT on the activity of SOD,GSH-Px and the content of MDA of testicular tissue in male rats with T2DM(±s)
注:与Normal 组比较,*P<0.05;与Model 组比较,#P<0.05;与Met 组比较,△P<0.05;与OMT 低剂量组比较,▲P<0.05;与OMT 中剂量组比较,&P<0.05。
MDA(nmol/mg pro)Normal 组856 829.15±7.31179.63±24.5020.08±2.73 Model 组.04±3.86*76.42±11.37* 38.49±5.50*Met 组839.15±5.02#153.80±23.15# 25.04±3.19#OMT 低剂量组837.47±4.68#106.52±18.36#△ 31.52±3.74#△OMT 中剂量组846.08±6.15#△▲ 137.84±20.72#▲ 25.79±3.26#▲OMT 高剂量组854.73±7.58#△▲& 168.11±25.03#▲& 22.36±2.91#△▲&组别动物数SOD(U/mg pro)GSH-Px(U/mg pro)
2.7 OMT 对T2DM 雄性大鼠睾丸组织Nrf2、HO-1 mRNA 表达的影响 与Normal 组比较,Model 组大鼠睾丸组织Nrf2、HO-1 mRNA 表达量明显降低(P<0.05)。与Model 组比较,Met 组和OMT 低、中、高剂量组Nrf2、HO-1 mRNA 表达量明显升高(P<0.05);OMT 低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met 组比较,OMT 低剂量组Nrf2、HO-1 mRNA 表达量明显降低(P<0.05),OMT 中剂量组Nrf2、HO-1mRNA 表达量差异无统计学意义(P>0.05);OMT 高剂量组Nrf2、HO-1 mRNA 表达量明显升高(P<0.05)。见表7。
表7 OMT 对T2DM 雄性大鼠睾丸组织Nrf2、HO-1 mRNA 表达的影响(±s)Tab.7 Effects of OMT on the mRNA expression of Nrf2 and HO-1 of testicular tissue in male rats with T2DM(±s)
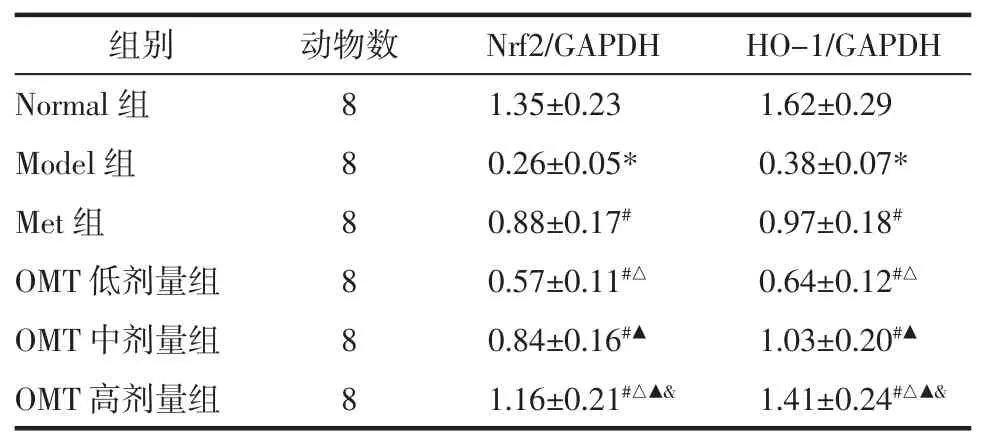
表7 OMT 对T2DM 雄性大鼠睾丸组织Nrf2、HO-1 mRNA 表达的影响(±s)Tab.7 Effects of OMT on the mRNA expression of Nrf2 and HO-1 of testicular tissue in male rats with T2DM(±s)
注:与Normal 组比较,*P<0.05;与Model 组比较,#P<0.05;与Met 组比较,△P<0.05;与OMT 低剂量组比较,▲P<0.05;与OMT 中剂量组比较,&P<0.05。
组别动物数Nrf2/GAPDHHO-1/GAPDH Normal 组81.35±0.231.62±0.29 Model 组80.2 80.8量组80.5量组80.86±0.05*0.38±0.07*Met 组8±0.17#0.97±0.18#OMT 低剂7±0.11#△0.64±0.12#△OMT 中剂4±0.16#▲1.03±0.20#▲OMT 高剂量组81.16±0.21#△▲&1.41±0.24#△▲&
2.8 OMT 对T2DM 雄性大鼠睾丸组织Nrf2、p-Nrf2、HO-1 蛋白表达的影响 与Normal 组比较,Model 组大鼠睾丸组织Nrf2、p-Nrf2、HO-1 表达量明显降低(P<0.05)。与Model 组比较,Met 组和OMT低、中、高剂量组Nrf2、p-Nrf2、HO-1 表达量明显升高(P<0.05);OMT 低、中、高剂量组上述作用呈现剂量依赖性(P<0.05)。与Met 组比较,OMT 低剂量组Nrf2、p-Nrf2 表达量明显降低,HO-1 表达量差异无统计学意义(P>0.05);OMT 中、高剂量组Nrf2、p-Nrf2、HO-1 表达量明显升高(P<0.05)。见图2、表8。
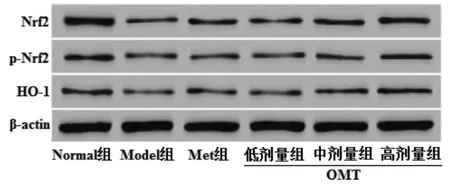
图2 OMT 对T2DM 雄性大鼠睾丸组织Nrf2、p-Nrf2、HO-1 蛋白表达的影响Fig.2 Effects of OMT on the protein expression of Nrf2,p-Nrf2,HO-1 of testicular tissue in male rats with T2DM
表8 OMT 对T2DM 雄性大鼠睾丸组织Nrf2、p-Nrf2、HO-1 蛋白表达的影响(±s)Tab.8 Effects of OMT on the protein expression of Nrf2,p-Nrf2,HO-1oftesticulartissueinmaleratswithT2DM(±s)
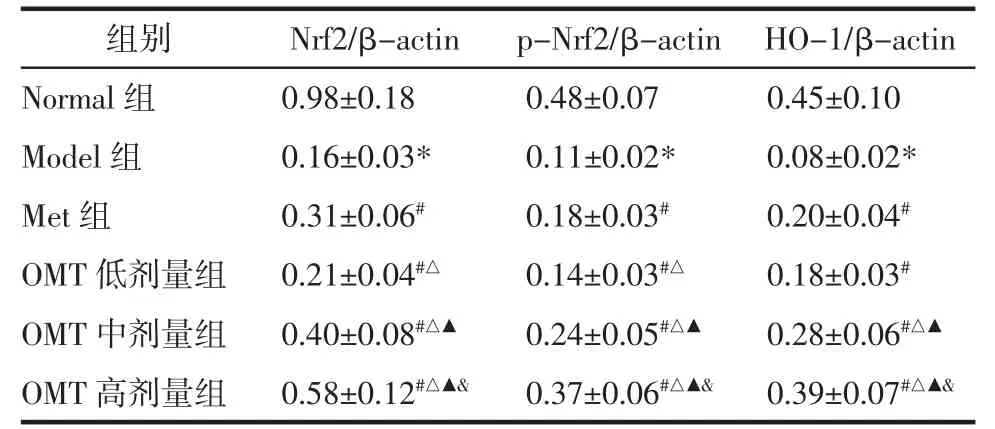
表8 OMT 对T2DM 雄性大鼠睾丸组织Nrf2、p-Nrf2、HO-1 蛋白表达的影响(±s)Tab.8 Effects of OMT on the protein expression of Nrf2,p-Nrf2,HO-1oftesticulartissueinmaleratswithT2DM(±s)
注:与Normal 组比较,*P<0.05;与Model 组比较,#P<0.05;与Met 组比较,△P<0.05;与OMT 低剂量组比较,▲P<0.05;与OMT 中剂量组比较,&P<0.05。
组别Nrf2/β-actinp-Nrf2/β-actin HO-1/β-actin Normal 组0.98±0.180.48±0.070.45±0.10 Model 组0.16±0.03*0.11±0.02*0.08±0.02*Met 组0.31±0.06#0.18±0.03#0.20±0.04#OMT 低剂量组0.21±0.04#△0.14±0.03#△0.18±0.03#OMT 中剂量组0.40±0.08#△▲0.24±0.05#△▲0.28±0.06#△▲OMT 高剂量组0.58±0.12#△▲&0.37±0.06#△▲&0.39±0.07#△▲&
3 讨论
糖尿病患者生殖损伤发病率是非糖尿病患者的5~10 倍,男性发病率高于女性[12]。随着国家鼓励生育政策相继出台,民众生育欲望升高,糖尿病所致男性生殖损伤甚至不育成为亟待解决的健康问题。
睾丸是男性生殖系统主要器官,是T 分泌和精子生成的场所,其生理功能受下丘脑-垂体-性腺轴调控。糖尿病可引发多器官并发症,持续高血糖可导致睾丸萎缩、T 分泌减少、精子质量降低,最终导致男性生殖功能受损甚至不育[13]。糖尿病患者中超过90%为T2DM,而T2DM 男性患者普遍存在生殖损伤。本研究采用高脂饮食结合注射STZ 损伤胰岛β 细胞的方法构建T2DM 雄性大鼠模型,该方法操作简便、成功率高、重复性好,并且成模过程与人类T2DM 发病机制及病理特点相似,是国内外普遍认可的T2DM 动物模型制备方法[14]。结果显示,与正常组比较,T2DM 雄性大鼠FBG 水平明显升高,血清T、GnRH、LH、FSH 含量水平明显降低,睾丸质量和睾丸体积明显降低,睾丸组织呈现输精管萎缩、生精上皮结构紊乱、精原细胞退化、脱落、数量减少等病理学改变,STD 和TSE 均明显降低,与Sudirman等[10,15]报道一致;精子数量、精子存活率、(a+b)级活力精子明显降低,与Heidari 等[16]报道一致;说明T2DM 雄性模型大鼠睾丸组织出现明显的结构和功能损伤,下丘脑-垂体-性腺轴功能受损。OMT 能够剂量依赖性降低T2DM 雄性大鼠FBG 水平,提高血清T、GnRH、LH、FSH 含量水平,减轻睾丸萎缩和睾丸组织病变,提高精子质量,并且OMT 高剂量组对除FBG 外其他指标的作用均优于Met 组,提示OMT 对T2DM 雄性大鼠生殖损伤及下丘脑-垂体-性腺轴功能具有保护作用。
氧化应激是糖尿病所致生殖损伤等发生发展的重要机制。高血糖引发线粒体过度生成ROS,致使SOD、GSH-Px 等内源性抗氧化酶被过度消耗,破坏“ROS 生成-还原清除”平衡,ROS 蓄积而攻击生物膜脂质双分子层结构并生成具有生物毒性的MDA,并且ROS 可破坏蛋白质、DNA 等生物大分子结构,造成氧化应激损伤[17]。Nrf2 是一种核转录因子,在机体抗氧化系统中发挥着重要作用。正常状态下存在于细胞质的Nrf2 通过Neh2 结构域与其抑制剂Keap-1 结合而无生理活性[18]。ROS 可诱导Nrf2 磷酸化并促使“Nrf2-Keap-1”复合体解离,p-Nrf2 核转位后能够诱导SOD、GSH-Px 等抗氧化酶转录与表达,提高ROS 还原清除能力,降低氧化应激损伤[19]。Nrf2 下游靶蛋白HO-1 为血红素降解限速酶,可促使血红素降解生成胆绿素IX、CO、Fe2+等内源性抗氧化剂[20-21]。本研究发现,OMT 能够剂量依赖性提高T2DM 雄性大鼠睾丸组织SOD、GSH-Px活性并降低MDA 含量,提高Nrf2、HO-1 mRNA 表达和Nrf2、p-Nrf2、HO-1 蛋白表达,并且OMT 高剂量组对除GSH-Px 外其他指标的作用均优于Met组,提示OMT 对T2DM 雄性大鼠睾丸组织氧化应激损伤具有保护作用,可能与激活Nrf2/HO-1 信号通路有关。
综上所述,OMT 对T2DM 雄性大鼠生殖损伤具有保护作用,其机制可能与激活Nrf2/HO-1 信号通路,抑制氧化应激,改善下丘脑-垂体-性腺轴功能有关。本研究为OMT 用于防治T2DM 男性生殖损伤提供了理论依据。氧化应激也是T2DM 雌性大鼠生殖损伤的重要机制[22-23],因此OMT 可能对T2DM雌性大鼠生殖损伤也具有保护作用,但尚需进行实验验证。

