人偏肺病毒的逆转录重组酶介导等温扩增荧光检测方法的建立
焦素黎,谢 蕾,毛 洋,倪红霞,李永东
人偏肺病毒(Human metapneumovirus,HmPV)是一种负向单链RNA病毒,是导致小儿急性呼吸道感染的主要病原微生物之一,也是世界范围内引起免疫功能低下者和老年人发病及死亡的常见病毒[1-2]。人偏肺病毒具有传染性强、潜伏期短等特点,其临床多表现为咳嗽、流涕、发热等,易与其他呼吸道病毒感染混淆,且目前尚无高效特效药和人偏肺病毒疫苗。因此,及时发现并掌握人偏肺病毒的流行现状及感染情况对控制该病毒传播及其治疗十分关键[3]。
当前,人偏肺病毒检测的方法主要有病毒分离培养法、免疫学方法和核酸检测法等。其中,病毒分离培养法虽有“金标准”之称,不适合早期、快速诊断[4-5];基于核酸的分子检测方法,其中qRT-PCR技术比较常见,但该方法需要昂贵的特殊设备及专业人员,且一般需要两个多小时,其在现场和环境条件差的场景适用性差[6]。
近年来,恒温核酸扩增技术进入快速发展轨道,如环介导等温扩增、链替代扩增、依赖核酸序列的扩增、依赖解旋酶的扩增和重组介导扩增[7]。其中,RAA扩增反应借助重组酶、单链DNA结合蛋白和DNA聚合酶发挥催化反应,通过重组酶与引物DNA发生结合形成酶和引物的复合物,当复合物遇到与其引物完全互补的序列时,再在单链DNA结合蛋白的介导下,模板DNA发生解开,随后DNA聚合酶发生催化作用,合成新的DNA互补链,反应产物以指数级增加,一般在30 min内即完成核酸扩增,反应高效快速,只需恒温扩增而无需高温介导。反应结果可通过实时荧光法、琼脂糖电泳法或侧流试纸条法对结果进行读取,可在现场进行快速检测,该方法已被应用于细菌、病毒、寄生虫等多个领域的检测[8-9]。本研究建立了HmPV荧光RT-RAA检测方法,并对方法的特异性、敏感性等进行了验证。
1 材料与方法
1.1 人偏肺病毒保守序列的确定 从NCBI数据库中下载20个HmPV的全基因组序列,利用Mega软件进行ClustalW分析,确定HmPV N蛋白基因作为保守靶向序列,并进行BLAST核酸比对,确保所选的靶向序列为HmPV的高度保守序列。进而将靶向序列交由生工生物工程(上海)股份有限公司合成,重组到pBluescript II SK+载体的EcoR Ⅰ位点,并构建含有重组质粒pBlu-HmPV的重组大肠杆菌TOP 10-HmPV。将重组菌TOP 10-HmPV用含有氨苄青霉素的液体LB培养基放大培养至OD600=0.6。将培养好的菌液利用质粒提取试剂盒(TIANGEN公司,北京)进行质粒提取,并利用超微量分光光度计(上海元析仪器有限公司)检测质粒浓度,并根据公式将其换算拷贝数。
1.2 人偏肺病毒的标准RNA制备 基于人偏肺病毒的保守序列筛选结果,将人偏肺病毒的N蛋白基因从240到430区域的序列交由生工生物工程(上海)股份有限公司进行人工合成,克隆至质粒pBluescript II SK+的T7启动子下游的酶切位点处,命名为pB-HmPN,并转化到载体菌大肠杆菌TOP 10中,构建重组菌株。将重组菌株进行发酵培养,用质粒提取试剂盒进行质粒提取,将提取的质粒通过超微量分光光度计测得浓度后用SacⅠ酶切,酶切产物再用通用型DNA纯化试剂盒(TIANGEN公司,北京)进行回收。将纯化的线化质粒pB-HmPN作为转录模板,用T7体外转录试剂盒(北京百奥莱博科技有限公司,北京)对提取的线化质粒进行体外转录,制备人偏肺病毒的N基因片段的标准RNA,并用超微量分光光度计进行浓度测定,置于-20 ℃备用。
1.3 荧光RT-RAA引物及探针设计 根据对HmPV基因组序列进行比对分析,以N蛋白基因从片243到425的序列区域(基因登录号:LC510257.1)为靶序列设计引物和探针(图1),RT-RAA引物设计参考TwistDx公司关于RT-RAA引物设计的注意事项。上游引物为5′-AGTCCAGGTGGTTCTAACCAAAACATACTCC-3′,下游引物为5′-TTGTGGGATGTTACCTGATGACTCT-TTAAGC-3′,探针为5′-GGGAAGA-GCTGCA-GAT(FAM)(THF)T(BHQ)TAGATATACATGGAGTGGAAAAGAGTTGGG-3′block,产物为206 bp。引物和探针交由生工生物工程(上海)股份有限公司合成。

图1 人偏肺病毒N蛋白基因高度保守序列区域Fig.1 Highly conserved sequence of the human metapneumovirus N protein gene
1.4 荧光RT-RAA反应体系 利用江苏奇天RT-RAA核酸扩增试剂盒(荧光法)进行扩增,RT-RAA扩增反应总体积为50 μL,包括25 μL反应缓冲液,1.5 μL上游引物(10 μmol/L),1.5 μL下游引物(10 μmol/L),1 μL探针,1 μL RNA标准模板(1×105copies/μL),2.5 μL醋酸镁(280 mmol/L)和17.5 μL无菌水以及在RT-RAA核酸扩增试剂反应管中预先冻干的重组酶、单链结合蛋白和DNA聚合酶。混均后加入到RT-RAA荧光反应管中,快速离心后,置于恒温扩增仪ISO-T8(TwistDx公司)检测,反应温度为39 ℃,反应时间为30 min,反应产物进行荧光实时检测。
1.5 荧光RT-RAA反应体系的灵敏性分析 将上述制备的HmPV标准RNA样本稀释至终浓度为1×105copies/μL、1×104copies/μL、1×103copies/μL、1×102copies/μL、1×101copies/μL和1×100copies/μL,分别取1 μL稀释液作为反应模板,分别进行荧光RT-RAA扩增反应,并以无核酶水作为阴性对照,重复实验3次,评价其检测灵敏度。
1.6 荧光RT-RAA反应体系的特异性分析 为分析RT-RAA反应体系的特异性,将从来自宁波市的两家国家流感监测哨点医院,分别为宁波市第一医院和宁波市妇女儿童医院的流感样疑似病例样品中检测分离得到的人博卡病毒、腺病毒和呼吸道合胞病毒的基因组与浓度为1×105copies/μL的人偏肺病毒的标准RNA分别进行RT-RAA扩增反应。并以无核酶水作为阴性对照,重复实验3次,评价其检测特异性。
1.7 人偏肺病毒临床样品的验证 为评价基于RT-RAA的人偏肺病毒核酸快速检测方法的效果,对2021年采集来自宁波市的两家国家流感监测哨点医院的流感样疑似病例样品,利用江苏硕世生物公司提供的核酸快速提取试剂盒(磁珠法)以及全自动核酸提取仪(SSNP-3000A)提取待测样品RNA,并利用上海之江生物科技有限公司提供的人偏肺病毒qRT-PCR试剂盒进行检测,对70份HmPV阳性(60份)和阴性(10份)样品检测结果与建立的RT-RAA的人偏肺病毒核酸快速检测结果进行分析比较。
1.8 数据统计分析 样品检测设置3个平行重复,使用SPSS 20.0对RT-RAA和qRT-PCR检测的临床样本进行McNemar卡方配对检验分析,以P<0.05计为差异有统计学意义。
2 结 果
2.1 RT-RAA的检测限度及重复性分析 利用制备HmPV的N基因片段的标准RNA作为模板,进而进行梯度稀释质粒,制备成不同浓度的质粒,用T7体外转录试剂盒对提取的线化质粒进行体外转录,制备人偏肺病毒的N基因片段的标准RNA,分别以RNA为模板进行实时荧光RT-RAA扩增检测。使用恒温扩增仪ISO-T8(TwistDx公司),对检测结果进行实时荧光检测,检测结果为随着反应时间延伸,荧光信号是否随着增加,如果出现阳性扩增反应,即会出现随着反应时间延长,荧光信号会随之增加。结果如图2所示,1×105copies/μL,1×104copies/μL,1×103copies/μL和1×102copies/μL为模板的RT-RAA检测结果均为阳性,显示RT-RAA的检测灵敏度达到了1×102copies/μL的水平,而上海之江生物科技有限公司提供的人偏肺病毒qRT-PCR试剂盒最低检测限为1×103copies/mL,表明建立的RT-RAA方法检测灵敏性好。
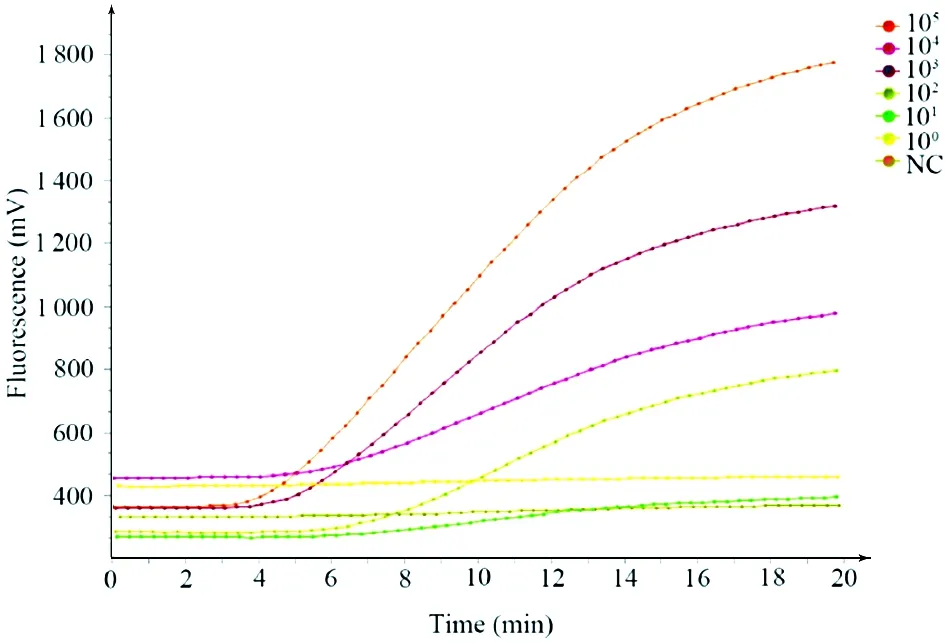
图2 人偏肺病毒实时荧光RT-RAA检测方法的灵敏性分析Fig.2 Sensitivity analysis of real-time fluorescence RT-RAA for detection of human metapneumovirus
2.2 RT-RAA的检测特异性分析 分别以偏肺病毒N蛋白基因片段DNA的体外转录获得的标准RNA(1×105copies/μL),共检测到呼吸道合胞病毒86份、博卡病毒25份和腺病毒57份,选择呼吸道合胞病毒、博卡病毒和腺病毒基因组(Ct值小于30)为模板,利用建立的HmPV荧光RT-RAA进行检测分析,结果如图3所示,只有HmPV的N蛋白体外转录的标准RNA模板出现了荧光扩增信号,表明所建立的RT-RAA检测方法特异性高。

图3 人偏肺病毒实时荧光RT-RAA检测方法的特异性分析Fig.3 Specificity analysis of real-time fluorescence RT-RAA for detection of human metapneumovirus
2.3 RT-RAA检测临床样品中的病毒核酸样本 以浙江省宁波市的两家国家流感监测哨点医院,分别为宁波市第一医院和宁波市妇女儿童医院的流感样疑似病例样品中收集的HmPV阳性和阴性样本的病毒RNA为检测对象,同时利用本研究建立的RT-RAA和商业化的qRT-PCR进行检测分析。结果表明,以常规qRT-PCR检测结果为基础,对60份hMPV阳性和50份阴性临床样本进行分析检测,结果表明:60份阳性样本,RT-RAA与qRT-PCR的检测完全一致;50份阴性样本,RT-RAA的检测结果中有1例qRT-PCR的阴性样本检测为假阳性,即RT-RAA与qRT-PCR的检测一致性为99.1%(109/110)。进而对检测结果进行统计分析,该两种方法在检测结果差异无统计学意义(P=0.338)。
3 讨 论
呼吸道病毒感染是导致严重发病率和死亡率的重要病因之一。偏肺病毒可以引起上呼吸道感染性疾病,严重者可导致肺炎和喘息性肺炎。同时,偏肺病毒可以与腺病毒、呼吸道合胞病毒和博卡病毒混合感染。为有效开展治疗和精准控制,明确致病病原是治疗重要基础,建立快速准确的检测方法非常重要。目前HmPV感染的临床分子检测方法主要是qRT-PCR,与传统PCR相比,尽管qRT-PCR方法具有灵敏性高、特异性高和重复性好等优点[10-11]。但是,开展qRT-PCR必需配备昂贵设备和具有扎实理论基础知识的人员,这在基层医院和现场快速检测依然有一定的难度。
逆转录重组酶介导等温核酸扩增(RT-RAA)是近年来新开发一种核酸快速等温检测方法,该方法具有反应时间短、恒温反应扩增、无需昂贵设备、结果读取形式多元等优点。即该方法的反应结果除能用常规的琼脂糖凝胶核酸电泳进行读取外,还可通过实时荧光法或侧流层析试纸条法进行读取分析。本研究建立了基于实时荧光RT-RAA的HmPV检测方法,其反应温度恒定,即无需温度的升降过程从而节省了检测时间,使检测能在30 min内完成。本研究以体外转录制备的RNA为模板,其检出限度102copies/μL。值得注意的是,尽管本研究建立的基于实时荧光RT-RAA的HmPV检测方法灵敏性低于实时荧光定量PCR方法,但本研究建立的方法具有便捷、对实验人员要求低等特点,利于该方法在资源困乏场地的应用。此外,本研究所建立的方法,30 min内完成检测,能实现及时快速准确的HmPV核酸检测,这对有效预防疾病传播具有重要作用。
利益冲突:无
引用本文格式:焦素黎,谢蕾,毛洋,等.人偏肺病毒的逆转录重组酶介导等温扩增荧光检测方法的建立[J].中国人兽共患病学报,2023,39(8):780-783. DOI:10.3969/j.issn.1002-2694.2023.00.085

