基于蛋白组学分析旋毛虫原肌球蛋白过表达对小细胞肺癌NCI-H446细胞蛋白组分的影响
王灏轩,朱莹莹,程露阳,郭文平,杜娈英
肺癌在我国的发病率和死亡率均位居各类癌症之首,且呈现逐年上升的趋势[1]。小细胞肺癌(small cell lung cancer, SCLC)具有恶性程度高、进展快,预后差等特点[2]。临床上对SCLC的治疗以化疗为主,但容易造成化疗药物的继发性耐药,而肿瘤的生物治疗可在肿瘤的治疗方面发挥重要作用[3]。旋毛虫的抗肿瘤作用已被越来越多的研究所证实[4],其作用机制主要分为调节免疫细胞功能[5-7]或诱导细胞凋亡发挥作用[8-9]。除此之外,旋毛虫对肿瘤细胞增殖、周期、代谢以及免疫微环境均有影响[5, 9-10]。但因旋毛虫感染人体可导致一定的病理损伤,用旋毛虫感染人体治疗肿瘤会有诸多困难,也会引起患者不良心理反应等缺点,使其在临床上较难推广应用[11-12]。而源自旋毛虫的重组蛋白则可以减少旋毛虫对人体的感染。旋毛虫肌幼虫排泄分泌蛋白(Excretory/secretory proteins, ESPs)能通过影响细胞周期和促进凋亡抑制NCI-H446细胞增殖[13]。课题组前期通过质谱法分析了旋毛虫肌幼虫ESPs的蛋白组分,并筛选出旋毛虫原肌球蛋白(Tropomyosin,Tm)等抗肿瘤相关重组蛋白[14],以其替代旋毛虫肌幼虫ESPs发挥其抗肿瘤作用。
Tm是肌动蛋白细胞骨架结构蛋白,参与多种癌症的发生发展。研究表明Tm可以介导癌细胞的迁移、侵袭、细胞凋亡和细胞代谢等生物学过程[15-17]。文献报道,旋毛虫Tm可以通过交叉免疫反应抑制骨肉瘤细胞生长[18]。其他寄生虫源Tm也展现出不同的免疫调节作用或抗肿瘤活性[19-20]。但是旋毛虫重组蛋白Tm的分子功能,及其对NCI-H446细胞蛋白组分的影响和潜在机制尚不清楚。
异源基因造成肿瘤细胞凋亡,周期阻滞,代谢水平的改变等均会影响肿瘤细胞的生长[19, 21-23],癌细胞的生长一旦受到抑制会引起癌细胞内多种蛋白的表达发生变化[22],分析其蛋白组分的变化并研究其功能是揭示异源基因抗肿瘤作用机制的手段之一。蛋白质组学可以分析细胞全体蛋白质,能够直观、整体地研究蛋白质的组成与调控的活动规律。本研究通过蛋白质组学技术对旋毛虫Tm过表达组和转染空载体组的蛋白质组分进行对比,筛选出差异表达蛋白(Differentially expressed protein,DEPs),并对DEPs进行基因本体论(Genetic Ontology, GO)功能富集分析,通过构建蛋白-蛋白互作(PPI)网络进一步筛选中心节点蛋白,并通过Western blot对随机选取的中心节点蛋白NDRG1进行验证。实验将为深入研究旋毛虫Tm的分子功能以及对SCLC的影响提供理论依据。
1 材料与方法
1.1 NCI-H446细胞的培养与传代 从液氮中取出NCI-H446细胞,立即复苏,用 RPMI 1640培养基(含10%小牛血清和1%青链霉素混合液)培养细胞。待细胞丰度达到80%~90%时,进行细胞传代,传3代后取对数生长期的NCI-H446细胞待用。
1.2 旋毛虫TM过表达NCI-H446细胞的构建 细胞转染采用脂质体法。将2 μg目的基因质粒(TM-pcDNA3.1)和空载体(PcNDA3.1)用无血清的1640培养基(不含血清和抗生素)稀释,向DNA溶液中加入2 μL的转染试剂,室温下孵育10~15 min。待转染复合物形成后将其缓慢滴入培养基中,并轻轻转动培养基以确保转染复合物分布均匀。
1.3 差异蛋白的筛选 本研究利用串联质谱标记(Tandem mass tags, TMT)技术,标记目标肽段的N端或赖氨酸侧链,以期分离处发生变化的蛋白。使用Q Exactive质谱仪(Thermo Fisher Scientific, 美国)检测肽段信号,将脱盐后的多肽混合物装入Acclaim PePmap C18反相色谱柱(100 mm × 7 mm,5 μm),用安装在Dionex ultimate 3000 nano LC系统上的反相C18色柱进行分离。使用80%(v/v)的乙腈在0.1%的甲酸中的梯度,在45 min内洗脱多肽,流速为300 nL / min。洗脱液直接进入Q Exactive质谱仪,设置为正离子模式,以数据为导向,质谱全扫描范围为 350~2 000 m/z,以上操作重复3次以确保其稳定性。最后,利用PD(Proteome Discoverer 1.4,thermo)软件进行定性检索与分析,PD提取后的谱图用mascot进行搜索。检索 UniProt 数据库获取蛋白质名称、基因ID等信息,根据P<0.05,且FC(fold change)≥1.2或≤0.83为标准筛选DEPs。
1.4 生物信息学分析 在获得DEPs数据后,利用生物信息学分析对数据进行注释和归类,以得到蛋白质的注释结果及其可能的细胞组分定位、分子功能、参与的信号通路和蛋白互作网络等信息,进而为后期研究方向的选择提供参考。本研究利用GO (http: / /www.Geneontology.org/) 功能富集分析分别从生物过程(biological processes)、细胞组分(cellular component)和分子功能(molecular function)3个不同的生物学方面描述蛋白的功能。
1.5 蛋白-蛋白互作网络的构建 在生物体中,蛋白质并非独立存在,其功能形式必须借助其他蛋白质的调节和介导,因此,研究蛋白质间的相互作用及相互作用形成的网络对揭示蛋白质的功能有重要意义。本研究利用相互作用基因库检索工具(STRING)数据库检索DEPs,构建出PPI网络,设定最低相互作用阈值为0.15,获取其相互作用的具体数值。将相互作用网络数据及DEPs数据导入Cytoscape 3.9.0 软件,绘制蛋白质相互作用网络。利用cytoCNA插件中介数中心性(Betweenness Centrality,BC)算法绘制出与其他蛋白密切关系。
1.6 Western blot 取对数生长期的NCI-H446细胞,转染TM-pcDNA3.1为实验组(Tm),转染PcNDA3.1为对照组(NC),转染48 h 后按细胞裂解液说明书提取细胞总蛋白,采用BCA蛋白定量试剂盒(Solarbio,中国)检测各组蛋白浓度。上样量为每孔20 μg进行电泳、转膜、封闭后,加入一抗NDRG1(1∶1 000,Abclonal 公司,中国武汉)、β-actin(1∶100 000,Abclonal 公司,中国武汉)单克隆抗体分别孵育2 h,洗膜后加入二抗(1∶10 000)孵育1 h。蛋白相对表达水平=NDRG1 灰度值/β-actin 灰度值,重复测量3次,取平均值。每个条带的蛋白灰度值采用 Image J 软件检测。
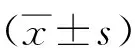
2 结 果
2.1 蛋白/肽段统计 本研究共鉴定到2 629个蛋白,9 961条多肽。在所有已鉴定的蛋白质中,大约62%的蛋白包括至少2种肽段(图1A)。对于不同的质谱仪可检测的肽段长度有一定的限制,鉴定肽段长度合理说明蛋白酶选用恰当。结果表明,肽段长度主要集中在7~17个氨基酸长度,符合肽段长度合理范围内,说明酶切效果好,数据质量高(图1B)。鉴定到的所有蛋白依据其肽段电荷分布进行统计,肽段电荷数≤3的约占96.55%(图1C),电荷数超过3的情况不常见。此外,分别鉴定出约44.4%和20.3%的蛋白质具有大于10%和20%的序列覆盖率(图1D),鉴定到的蛋白的整体可信度及准确度较高。

A:蛋白肽段鉴定数分布图,B:多肽长度分布图,C:肽段电荷分布图,D:蛋白鉴定覆盖率。图1 蛋白/肽段统计概览Fig.1 Protein/peptide statistics overview
2.2 差异蛋白的筛选 为探讨旋毛虫Tm对NCI-H446细胞的影响,本研究利用TMT技术对旋毛虫Tm过表达48 h后NCI-H446细胞的蛋白组分进行分析。以P<0.05,FC≥1.2或≤0.83为筛选条件,筛选出70个DEPs,包括34个下调蛋白和36个上调蛋白,将筛选DEPs的分析结果以火山图(volcano plot)的形式进行可视化(图2A)。通过Uniprot数据库检索DEPs,表1和表2分别列出了表达上调和下调显著性排名位于前10的蛋白质信息。

表1 显著上调的差异蛋白前10位列表Tab.1 Top 10 protein of up-regulated differential expressed proteins
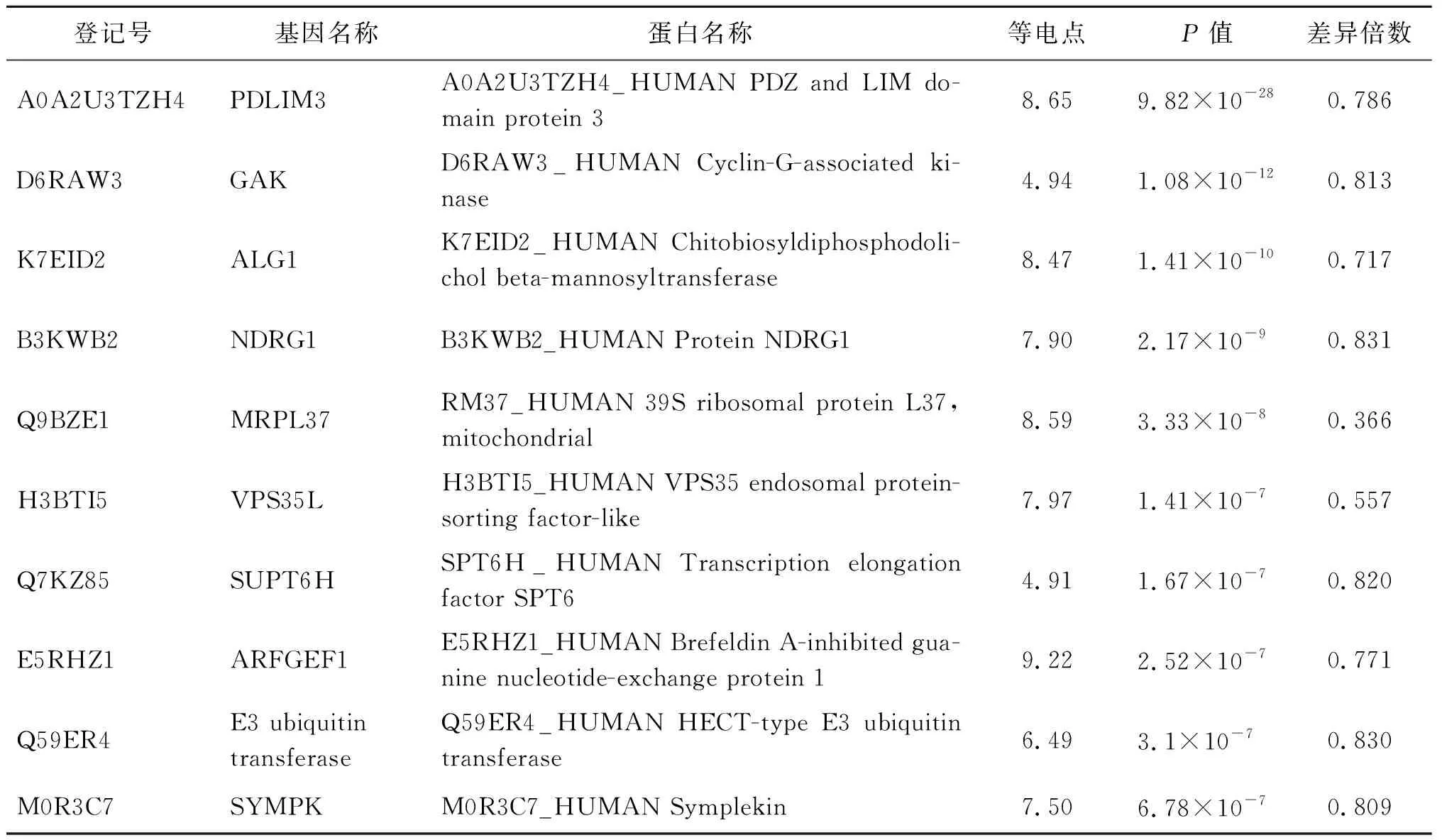
表2 显著下调的差异蛋白前10位列表Tab.2 Top 10 protein of down-regulated differential expressed proteins

A:差异表达蛋白火山图;B:差异蛋白分子功能的GO分析;C:差异蛋白生物学过程的GO分析;D:差异蛋白细胞组分的GO分析。图2 旋毛虫Tm过表达所致差异表达蛋白的生物信息学分析Fig.2 Bioinformatics analysis of differentially expressed proteins after overexpression of Trichinella spiralis Tm
2.3 旋毛虫Tm过表达所致的DEPs的GO分析 为分析DEPs的生物学功能,本研究分别从分子功能、生物过程、细胞成分3个层面对DEPs进行GO功能注释分析。GO分析结果显示DEPs主要发挥丝氨酸型肽链内切酶活性、蛋白激酶活性等分子功能(图2B);生物过程涉及免疫球蛋白等介导的免疫应答调节、RNA聚合酶Ⅱ启动子转录延长的正调控及脂质定位等(图2C);DEPs定位于转录延长因子复合物、前核糖体小亚基等(图2D)。
2.4 旋毛虫Tm过表达所致的蛋白互作关系 为了鉴定旋毛虫Tm与其他蛋白联系密切的中心节点蛋白,构建了PPI网络,其中蛋白蛋白互作关系数据从STRING数据库获得。根据STRING数据库提供的信息,利用Cytoscape 3. 9. 0软件对70个差异蛋白进行可视化(图3A)。为了更直观的观察中心节点蛋白,利用CytoCNA插件通过BC评分计算出蛋白-蛋白之间的联系程度(图3B),BC评分前五的蛋白分别是:细胞周期蛋白G相关激酶(GAK)、组蛋白H3-7(H3-7)、辛普勒金Symplekin(SYMPK)、N-myc下游调节因子1(NDRG1)、丝氨酸/苏氨酸蛋白激酶N2(PKN2)。
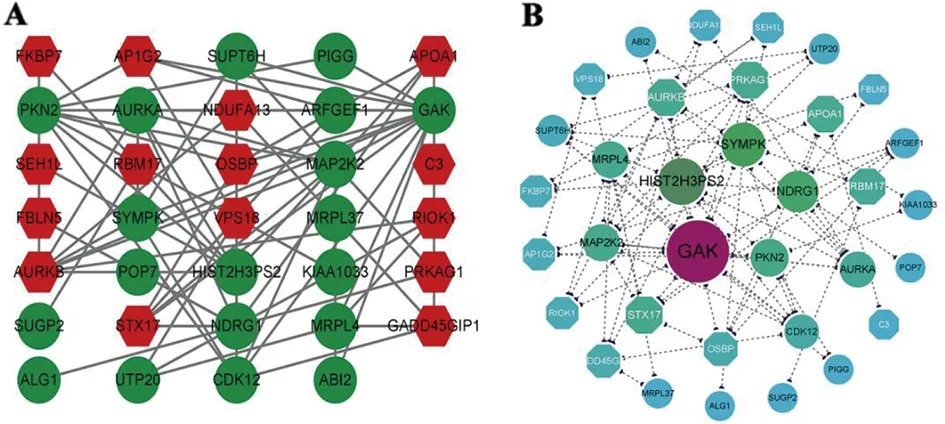
A:所有差异蛋白构成的 PPI 网络图;红色菱形代表上调差异蛋白,绿色圆形代表下调差异蛋白;直线连接两个圆形代表差异蛋白之间有相互作用。B:以“BC”评分为筛选条件;颜色越接近紫色则BC评分越高,越接近蓝色则BC评分越低。图3 PPI调节网络图Fig.3 PPI network diagram
2.5 Western blot 我们从上述评分前五的中心节点蛋白中随机选取了一种蛋白NDRG1,通过Western blot 进行了独立验证。实验结果显示,旋毛虫Tm能降低NCI-H446细胞中NDRG1的表达(t=5.772,P<0.05)。见图4。

A:Western blot检测Tm过表达后对NCI-H446细胞中NDRG1蛋白的表达情况;B:NDRG1蛋白表达的定量分析。图4 Western blot 验证Fig.4 Western blot verification
3 讨 论
旋毛虫是人兽共患病病原体,对人类健康有一定影响,但有许多研究亦表明,旋毛虫有调节免疫细胞功能的能力[4],例如旋毛虫通过诱导巨噬细胞、树突细胞等免疫细胞的活化[5-6],促进转化生长因子β和调节性因子白细胞介素-10的释放[7]。除旋毛虫感染宿主外,学者们还通过提取旋毛虫ESPs,或重组蛋白证明了旋毛虫的抗肿瘤作用[13, 24],例如旋毛虫肌幼虫ESPs通过抑制抗凋亡蛋白Bcl2,激活促凋亡蛋白Bax的表达,引起Cyt-C由线粒体内释放到胞质中,激活线粒体介导的细胞凋亡发挥作用[8-9]。
Tm在肌肉收缩的过程中发挥调节作用。该蛋白由两条α-螺旋链组成,结构相对保守,该蛋白可表达于寄生虫类、鱼类和哺乳动物(包括人)体内。既往有关旋毛虫Tm的研究仅是证实其分子量及氨基酸序列,且发现了其对骨肉瘤细胞的抗肿瘤作用[25],其他的实验则多以筛选鉴定特异性的诊断抗原或是寻找与其他蛋白质组间共同的免疫反应抗原为目的[20, 26],而旋毛虫Tm对SCLC的抗肿瘤作用尚无报道。本课题组前期实验证明,旋毛虫ESPs处理NCI-H446细胞后,能抑制其细胞增殖、诱导细胞凋亡,造成S期阻滞等[9, 13]。旋毛虫Tm作为旋毛虫ESPs的蛋白组分之一[14],能否也发挥抗肿瘤作用,值得进一步研究。因此为探究旋毛虫重组蛋白Tm的分子功能,及其对NCI-H446细胞的影响和潜在机制。我们以旋毛虫Tm过表达的NCI-H446细胞为研究对象,采用TMT技术分析旋毛虫Tm过表达NCI-H446细胞中蛋白质的变化情况。结果显示,与NC组相比,瞬时转染旋毛虫Tm 48 h后,NCI-H446细胞中蛋白组分及表达发生显著变化,共筛选出70个差异表达蛋白(包括34个上调蛋白和36个下调蛋白)。结果表明,旋毛虫Tm对NCI-H446细胞蛋白组分有显著的改变。
我们对DEPs进行GO分析,结果显示,DEPs主要定位于转录延长因子复合物中。研究表明,转录延长因子是影响细胞基因组稳定的重要分子,可以通过调控RNA聚合酶Ⅱ的延长和终止从而影响细胞周期[27],且在免疫微环境调控方面发挥巨大作用[28-29]。GO分析结果提示旋毛虫Tm对NCI-H446细胞周期及免疫功能有潜在调控作用,而细胞周期及免疫功能的改变是影响肿瘤细胞生长的有效步骤之一。部分DEPs可以影响丝氨酸型内肽酶、蛋白激酶的活化。研究表明,内肽酶对多肽内部的切割和蛋白激酶对关键酶蛋白的激活在肿瘤细胞的凋亡、代谢、自噬等方面发挥重要作用[30-32]。除此之外,DEPs还涉及免疫球蛋白介导的细胞免疫应答反应等生物学过程。研究表明,免疫细胞的功能贯穿肿瘤细胞的生长,旋毛虫能通过调控肿瘤细胞的免疫应答而发挥抗肿瘤作用[4]。由旋毛虫Tm过表达引起的DEPs与肿瘤细胞的转录、蛋白质激活及免疫调控有关,这为旋毛虫Tm影响肿瘤的发生与发展提供理论依据。
分析PPI网络BC评分前5个蛋白:GAK、HIST2H3PS2、SYMPK、NDRG1、PKN2。GAK是细胞周期蛋白家族成员,在肿瘤细胞增殖、细胞周期调控以及影响线粒体功能等方面发挥作用[33-35]。最近有研究表明,在小鼠体内敲除GAK,会造成NF-κB p65的活性增加,而NF-κB p65在肿瘤细胞的增殖和迁移以及葡萄糖代谢的调控上发挥重要作用[36-37]。本实验中GAK的表达量下调,提示旋毛虫TM可能通过抑制GAK的表达影响肿瘤细胞的生长以及葡萄糖的利用。SYMPK是一种多聚腺苷酸化因子,在mRNA成熟,转录后调控以及和细胞间的紧密连接中发挥作用[38]。研究发现,SYMPK的积累会促进细胞增殖和去分化[39]。也有研究表明,SYMPK参与不稳定热因子对细胞周期的调节,其消耗减慢了S期进程[40]。由此推测,旋毛虫Tm通过下调NCI-H446细胞中SYMPK的表达水平,影响HLF复合物的功能从而可能导致NCI-H446细胞S期阻滞。NDRG1是N-myc下游调节因子1,在肿瘤细胞增殖、迁移、糖代谢以及线粒体介导的细胞凋亡中发挥作用[41-42]。研究表明,沉默NDRG1会加剧缺氧诱导的线粒体碎片化[41]。有趣的是,沉默GAK基因也能改变线粒体形态,研究表明GAK参与线粒体自噬过程,在线粒体碎片正确摄取到自噬体这一过程发挥重要作用[35]。由此可见,二者有着相似的生物学效应。但GAK和NDRG1之间的明确关系还需进一步实验论证。除此之外,沉默NDRG1可以影响肝癌细胞的糖代谢[41]。我们通过Western blot检测了NDRG1在旋毛虫Tm过表达的NCI-H446细胞中的表达水平,与蛋白组学的结果一致,这提示旋毛虫Tm可能会通过下调NDRG1影响NCI-H446细胞葡萄糖代谢以及线粒体功能。PKN2是丝苏氨酸蛋白激酶家族成员,研究表明,沉默PKN2可以调节G2/M期进展和细胞分裂[43]。除此之外,PKN2在调节细胞周期进展、肌动蛋白细胞骨架组装、细胞迁移、肿瘤细胞侵袭和转录激活信号过程中发挥作用[43-44]。本实验发现旋毛虫Tm可能通过下调NCI-H446细胞中PKN2的表达,这提示旋毛虫Tm可能通过下调PKN2发挥其抗肿瘤作用。
综上所述,旋毛虫Tm影响NCI-H446细胞增殖、细胞周期、细胞代谢以及细胞免疫应答等生物学过程,这可能与旋毛虫Tm下调NCI-H446细胞中GAK、H3-7、SYMPK、NDRG1、PKN2等蛋白的表达有关。
利益冲突:无
引用本文格式:王灏轩,朱莹莹,程露阳,等.基于蛋白组学分析旋毛虫原肌球蛋白过表达对小细胞肺癌NCI-H446细胞蛋白组分的影响[J].中国人兽共患病学报,2023,39(8):758-765. DOI:10.3969/j.issn.1002-2694.2023.00.082

