工程菌在肿瘤治疗方面的应用进展
陈家文,黄建东,孙海涛,2
(1 南方医科大学珠江医院神经外科中心,国家临床重点专科,脑血管病诊断与治疗教育部工程研究中心,广东省普通高校脑功能修复与再生重点实验室,广东神经外科研究所,广东 广州 510280; 2 南方医科大学珠江医院检验医学部,临床生物样本资源中心,南方医科大学微生物组医学中心,广东 广州 510280; 3 香港大学李嘉诚医学院生物医学学院,生物医学学院,香港 999077; 4 中国科学院深圳先进技术研究院,深圳合成生物学创新研究院,中国科学院定量工程生物学重点实验室,广东省合成基因组学重点实验室,广东 深圳 518055; 5 香港大学深圳医院临床肿瘤科,深圳市肿瘤转移与个体化治疗重点实验室,广东 深圳518055; 6 粤港RNA医学联合实验室,中山大学,广东 广州 510120)
细菌治疗肿瘤有着较长的历史,最早可以追溯到19 世纪。一名外科医生首次用链球菌(Streptococcus pyogenes)来治疗患有无法手术切除的肉瘤患者,并且发现部分肿瘤自发消退。在接下来的时间里,他用热灭活的酿脓链球菌治疗了超过1000 名的肿瘤患者并取得了较好的效果[1‑3]。然而,由于结果的不稳定性,加上放射治疗和化学治疗的出现,细菌治疗肿瘤慢慢淡出了人们的视野[4]。近年来,随着合成生物学的蓬勃发展,人们重新考虑运用细菌来治疗肿瘤,并为提高细菌疗法的效果做了各种努力。用于肿瘤治疗的常见细菌有沙门氏菌[5]、大肠杆菌[6]、双歧杆菌[7]和链球菌[8]等,这些细菌都有靶向肿瘤和杀死肿瘤细胞的能力[9‑10]。人们通过合成生物学等技术对细菌进行改造后大大增强了其在肿瘤治疗上的运用,改造后的细菌可以选择性地定植在肿瘤组织中并抑制肿瘤生长[11‑13]。特别是鼠伤寒沙门氏菌研究较多,并被认为是具有较大潜力的治疗方法,例如,比较常见的工程鼠伤寒沙门氏菌有VNP20009、A1‑R、YB1 和SHJ2037 等。然而,单纯工程菌不能消除肿瘤。人们用工程细菌作载体来表达细胞因子、细胞毒性药物、前药物转化酶、调节因子、小干扰RNAs(siRNAs)和其他抗肿瘤分子来增强抗肿瘤效果[9‑10,14‑15]。在用于临床治疗前,工程细菌治疗肿瘤还面临着许多问题[11‑13]。本文结合近年来国内外研究报道,阐述人们通过不同的策略来改造细菌,并且总结工程菌在肿瘤治疗方面的一些进展。
1 细菌改造策略和应用进展
1.1 细菌的基因工程改造及应用
野生细菌的毒力较强是细菌治疗肿瘤的挑战之一,如何平衡细菌过强的毒性和治疗效力是研究者急需解决的难题[16]。人们通过改造细菌的相关基因来减弱细菌的毒力,从而提高细菌的安全性。此外,在减弱细菌毒力的同时也可以增强其肿瘤靶向性。通过敲除与细菌代谢相关的基因可以减弱细菌的毒力,同时也能增强细菌在肿瘤组织的定植和减少对正常组织的破坏[10‑11]。例如,减毒鼠伤寒沙门氏菌VNP20009 中msbB缺失改变了脂质A 的结构,从而减少了细菌诱导的TNF‑α 的分泌。其另一个purI基因的突变使细菌不能合成腺嘌呤[17‑18]。在动物模型中,研究证实减毒鼠伤寒沙门氏菌VNP20009 可以抑制多种肿瘤的生长[19‑20]。此外,1999 年开展了减毒鼠伤寒沙门氏菌VNP20009 一期人类临床研究,研究表明VNP2009 用于肿瘤患者具有较高的安全性。但是在最大剂量下只在3个患者的肿瘤组织中发现了细菌定植,且肿瘤组织没有明显的消退[18]。该研究说明,VNP2009 的肿瘤靶向性和疗效需要进一步的提升。专性厌氧鼠伤寒沙门氏菌YB1 是在减毒鼠伤寒沙门氏菌SL7207 菌株的基础上进一步改造而来。设计缺氧启动子PepT 和反义需氧启动子SodA 调控必需基因asd的表达。Asd是合成二氨基庚二酸(DAP)的关键酶,而DAP 是革兰氏阴性菌细胞壁的重要组成部分。缺乏DAP 会导致细菌在短时间内裂解。常氧下,asd基因不表达从而导致DAP 缺乏。因此,YB1 只能在厌氧条件(氧气体积分数<0.5%)下存活[16,21]。许多研究表明,YB1 优先在肿瘤组织定植,并可以抑制肿瘤的生长和转移[16,21]。在动物模型中,尽管工程细菌治疗多种肿瘤取得了一定的效果,但是利用改造后的细菌作为载体表达抗肿瘤分子可以进一步提高疗效。常见的抗肿瘤分子有细胞因子、细胞毒性药物、前药物转化酶、调节因子、小干扰RNAs(siRNAs)。在多种动物肿瘤模型中,工程细菌可以有效表达抗肿瘤分子并显著抑制各种肿瘤的生长。随着免疫治疗的兴起,人们利用工程细菌作为载体表达纳米抗体来阻断免疫抑制信号从而增强抗肿瘤免疫反应[22‑24]。研究表明,在多种动物模型中工程菌表达纳米抗体后肿瘤生长受到明显的抑制,并且有些具有免疫记忆,从而抑制肿瘤的复发[22‑24]。例如,大肠杆菌表达L‑精氨酸联合抗PDL‑1治疗肿瘤后,肿瘤生长受到明显抑制,并且体内可以产生记忆性T 细胞,从而抑制肿瘤的复发。近年来,工程菌在肿瘤治疗上取得了令人期待的结果,但是还不能完全抑制肿瘤的生长。此外,细菌的安全性一直是人们担心的问题,如何平衡细菌的安全性和疗效是一个难点。
1.2 细菌合成基因线路深度优化及应用进展
虽然人们通过改造野生细菌的相关基因降低了细菌的毒力,并且证明减毒后的细菌可以选择性地定植在肿瘤组织同时抑制肿瘤的生长,但由于细菌在体内的遗传不稳定,可能会产生无效或有害的表型。此外,潜在的抗生素耐药性或逆转细菌减毒表型的突变可能对患者健康形成威胁[11,25]。因此,开发更广泛更安全的细菌治疗方案是肿瘤治疗的一个重要发展方向。随着合成生物学的进一步发展,为进一步优化细菌提供了理论基础和技术支撑。在传统的细菌改造基础上,许多重要基因线路被设计出来,常见的基因线路包括自杀开关、群体感应、遗传振荡器和门控系统等[16,26]。这些基因线路大大提高了细菌在肿瘤治疗中的安全性,将会进一步推动细菌治疗肿瘤进入临床试验[16,27]。自杀开关是在限定条件下可以诱导致死基因表达,导致细菌死亡的人工系统[16,28]。将自杀开关引入细菌中,可以保证细菌在肿瘤特异性区域增殖,而在其他区域可以表达自杀基因杀死细菌,从而有效保证细菌不逃逸[16,29]。目前,开发的几种自杀开关已被用于基础研究、生物技术、代谢工程和临床诊断及细菌治疗[16,30]。在肿瘤治疗上,许多研究证实在引入了不同的自杀开关后,细菌在正常组织的定植明显减少并且表现出较好的肿瘤抑制效果。群体感应和遗传振荡器的利用可以有效控制基因在特定宿主器官的表达。用改造后的细菌作为载体使其表达抗肿瘤分子,有可能剂量过高损伤正常组织[16,31]。因此,通过加入群体感应和遗传振荡器可以精准控制抗肿瘤分子的表达。研究表明,加入群体感应后的细菌可以最大程度地维持体内较低的细菌定植数量,从而减少对周围组织的损伤及毒副作用,但是可以显著抑制肿瘤的生长[32]。逻辑门控系统的构建可以整合两个或两个以上输入信号并产生功能性的特异信号输出。含逻辑门控系统的重构细菌可以通过使用连接特异性响应肿瘤相关信号的启动子,实现治疗基因的特异性输出表达,可以作为诊断、预防和治疗的高度选择性工具[33]。比如,Liu 等[34]构建了逻辑与门(logical AND gate)基因线路,两个启动子hUPⅡ和hTERT 都在膀胱癌细胞中有高表达活性,但只有同时被激活时才能产生细胞表型的输出。因此,该系统能够更特异性地鉴别膀胱癌细胞。
2 工程菌治疗肿瘤的机制探讨
2.1 对肿瘤的直接作用
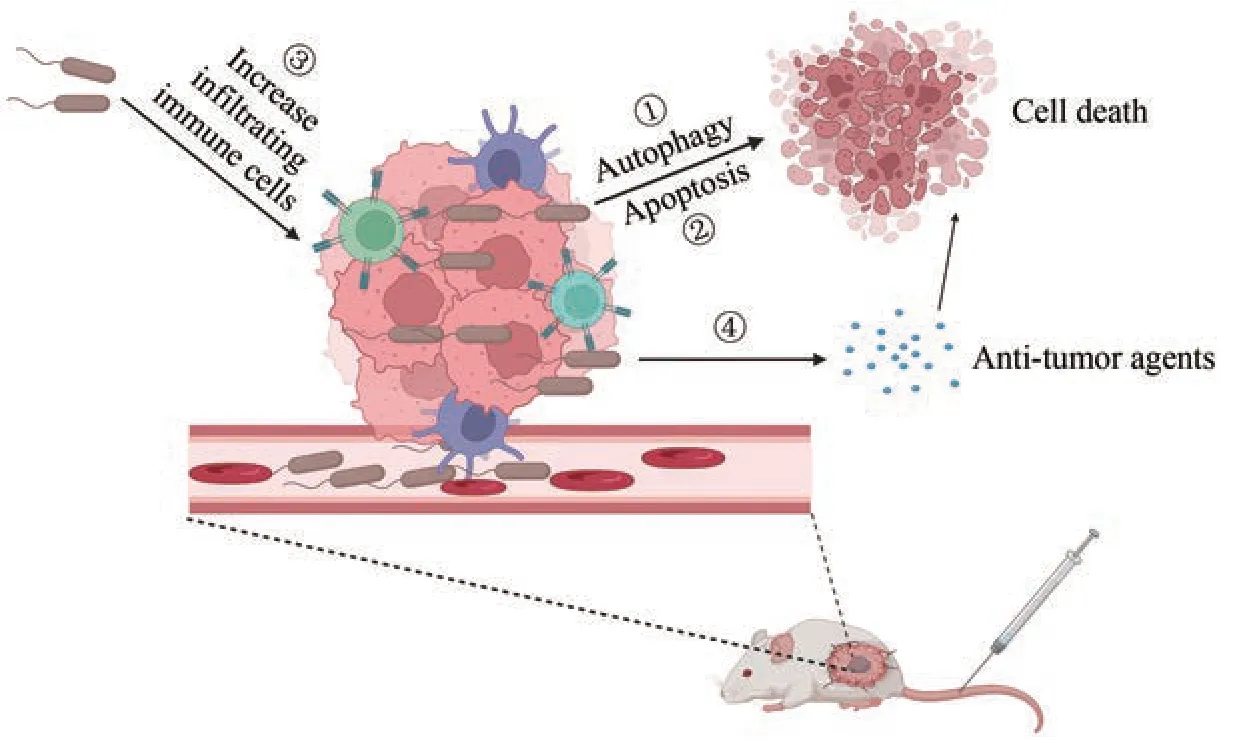
近年来,人们发现工程鼠伤寒沙门氏菌在肿瘤组织聚集后可以直接杀死肿瘤细胞[35]。凋亡和自噬是两种不同的细胞过程,它们参与了细胞的生理和病理过程[36‑37]。有研究表明,工程鼠伤寒沙门氏菌可以诱导肿瘤细胞发生凋亡和自噬来发挥抗肿瘤作用[图1(a)]。凋亡蛋白酶3 和Bax 蛋白是细胞凋亡效应蛋白。鼠伤寒沙门氏菌VNP20009可以增加凋亡蛋白酶3 的活性和Bax 蛋白的表达,从而诱导胰腺导管腺癌细胞发生凋亡[19]。除了凋亡,工程鼠伤寒沙门氏菌也可以诱导肿瘤细胞发生自噬--一种调节细胞质中长寿蛋白质和不需要的细胞器降解的细胞过程[36,38]。Lee 等[38]的研究表明,在小鼠黑色素瘤模型中,工程鼠伤寒沙门氏菌可以通过下调AKT/mTOR 信号通路诱导肿瘤细胞发生自噬,并且具有时间和剂量依赖性。然而,也有研究认为工程鼠伤寒沙门氏菌诱导的肿瘤细胞自噬是一种保护机制,可以保护肿瘤细胞免受伤害。Liu 等[20]研究表明,阻断自噬途径之后,鼠伤寒沙门氏菌A1‑R和VNP20009可以通过增强肿瘤细胞凋亡来杀死肿瘤细胞。因此,自噬抑制剂和工程鼠伤寒沙门氏菌联合运用可能取得较好的治疗效果。除了工程鼠伤寒沙门氏菌外,其他细菌也可以诱导肿瘤细胞发生凋亡。Bax和BCl‑xL是凋亡的重要蛋白,并在肿瘤的进展和侵袭中具有关键作用。此外,PI3K/AKT 信号通路可以影响多种细胞过程,包括抑制细胞凋亡、促进细胞生长和增殖。因此,通过抑制PI3K/AKT 信号通路可能诱导肿瘤细胞发生凋亡。体外研究发现,尼氏大肠杆菌可以通过上调PTEN和Bax蛋白和下调AKT1和Bcl‑xL 蛋白诱导细胞发生凋亡,从而抑制结肠腺癌生长[39]。另外,酪酸梭状芽孢杆菌通过基质金属蛋白酶8(MMP‑8)触发中性粒细胞释放TNF相关凋亡诱导配体,从而诱导肿瘤细胞凋亡[40]。

图1 工程菌治疗肿瘤的机制Fig. 1 The mechanisms of genetically engineered bacteria an anti‑tumor agent
2.2 激活宿主的免疫系统
肿瘤治疗的难点之一是肿瘤组织中的免疫抑制微环境。骨髓来源的抑制细胞和调节性T细胞的浸润可以导致免疫抑制微环境,从而促进肿瘤的生长[10,13]。除了诱导肿瘤细胞发生凋亡或者自噬外,细菌可以通过调节宿主的先天性和适应性免疫反应,从而提高宿主的抗肿瘤免疫反应[10‑11,13,35][图1(b)和(c)]。Toll 受体(TLR)是膜结合型受体,在先天性和后天性免疫反应中发挥重要作用,特别是在抗病原体感染的炎症反应中[41]。聚集在肿瘤部位的工程鼠伤寒沙门氏菌主要被细胞膜上的Toll 受体(TLR)识别。Toll 受体(TLR)主要识别革兰氏阴性杆菌的各种模式识别受体,包括TLR4 受体识别LPS、TLR5 受体识别鞭毛蛋白、TLR 受体识别非甲基化的CpGDNA。细菌的各种模式识别受体被Toll受体识别后可以激活宿主的抗肿瘤免疫系统[11]。有研究表明,IL‑1β具有明显的抗肿瘤活性,鼠伤寒沙门氏菌ΔppGpp的LPS 与巨噬细胞上TLR4 识别后可以直接促进IL‑1β 的分泌。另外,肿瘤细胞死亡后释放的ATP可以激活巨噬细胞的炎性小体,促进巨噬细胞分泌IL‑1β[42‑43]。此外,LPS 也可以和肿瘤细胞膜上的CD14、TLR4 结合增加肿瘤坏死因子TNF‑α 的分泌,从而破坏肿瘤血管[41]。鞭毛蛋白(细菌鞭毛的结构蛋白)亚基,可以被TLR5 受体特异性识别[44]。在肿瘤疫苗模型中,鞭毛蛋白与TLR5结合后可以增强肿瘤特异性CD8+T细胞的免疫反应[45]。鞭毛蛋白也可以通过激活TLR5 受体直接抑制乳腺癌细胞的增殖和生长[45]。YB1 是一种专性厌氧伤寒沙门氏菌,其可以在肿瘤缺氧区域聚集和抑制肿瘤生长[21,46]。此外,YB1 也可以抑制肿瘤的转移。在感染早期YB1可以促进NK细胞分泌INF‑γ,反过来分泌的INF‑γ 可以使NK 细胞聚集和活化,从而杀死转移的肿瘤细胞。该研究表明,NK 细胞的自反馈环在抑制转移瘤方面发挥了重要作用[46‑47]。许多研究表明,李斯特菌和大肠杆菌也可以通过调节宿主的抗肿瘤反应来抑制肿瘤的生长。Chandra 等[47‑48]研究发现,李斯特菌(attenuatedListeria monocytogenes)可以感染骨髓衍生的免疫抑制细胞,而后将细菌运送到肿瘤微环境中。同时,它可以使MDSC 转变为具有免疫刺激表型而分泌IL‑12,继而提高CD8+T 细胞和NK 细胞的抗肿瘤反应,从而抑制乳腺癌的生长和转移。
虽然工程菌本身可以通过许多机制来抑制肿瘤的生长,但是其疗效还需要进一步的提升。与传统抗肿瘤治疗方法相比,工程菌在肿瘤治疗上有许多优势,比如肿瘤靶向性和渗透入肿瘤组织深部的能力。随着合成生物学的发展,人们可以采用许多新的策略进一步改造工程菌来提升其抗肿瘤的能力。
3 工程菌治疗肿瘤新策略:递送抗肿瘤分子
虽然工程菌在肿瘤治疗上具有较好的疗效,但是单纯工程菌不能完全抑制肿瘤的生长。为了提高肿瘤治疗的疗效,工程菌可以作为载体来表达各种抗肿瘤分子,比如细胞因子、细胞毒性剂、免疫调节剂、肿瘤相关抗原或抗体、前药物酶、siRNA和其他分子。工程菌表达抗肿瘤分子具有许多优点:一方面,细菌可以靶向到肿瘤组织且可以渗透到肿瘤组织内部,并且工程菌本身具有抗肿瘤和激活免疫系统的能力;另一方面,细菌可以在肿瘤组织中增殖而持续表达抗肿瘤分子,从而使其保持在较高水平[10‑11,35,49]。
3.1 细胞因子
细胞因子可以通过促进免疫细胞的激活、增殖和迁移来杀死肿瘤细胞[10]。白细胞介素‑2(IL‑2)是由活化的CD4+T 细胞产生,其不仅可以促进淋巴细胞增殖,还可以增强细胞毒性T 淋巴细胞(CTL)和天然杀伤(NK)细胞的细胞毒性功能[50]。研究表明不同工程菌表达IL‑2 后,可以显著抑制肿瘤的生长和转移[51‑55]。Brent 等[51‑52]研究表明,工程鼠伤寒沙门氏菌表达IL‑2 可以诱导局部和全身的NK 细胞增殖,从而抑制骨肉瘤的转移。在小鼠黑色素瘤模型中,工程鼠伤寒沙门氏菌表达IL‑2 可以抑制黑色素瘤的生长,且可以减少黑色素瘤组织中的血管生成和显著增加肿瘤组织坏死[54]。CCL21,被称为6C 激活因子或次级淋巴组织趋化因子,是小分泌蛋白趋化因子家族的一个成员,其控制着淋巴细胞、树突状细胞、T 细胞和NK 细胞的迁移,其激活后可以增强细胞介导的免疫反应[56]。研究发现,工程鼠伤寒沙门氏菌表达CCL21 可以增加炎症细胞的浸润,从而抑制黑色素瘤的生长和转移并且具有较好的安全性[56]。IL‑18 最初被描述为一种IFN‑γ 诱导因子,不仅能够促进T 细胞和NK 细胞分泌细胞因子,而且还能诱导T 细胞和NK 细胞增殖和细胞溶解活性。静脉注射工程鼠伤寒沙门氏菌表达IL‑18 后,结肠癌生长和转移明显受到抑制。与肿瘤组织中T 细胞、NK 细胞和粒细胞的大量浸润以及肿瘤组织中几种细胞因子的增加有关[57]。此外,IL‑12 是一种多功能的细胞因子,在各种小鼠肿瘤模型中具有强大的抗肿瘤活性。有研究表明,产芽孢梭状芽孢杆菌(Clostridium sporogenes)在肿瘤组织缺氧区域聚集表达IL‑12,可以明显抑制乳腺癌的生长[53]。
3.2 细胞毒性剂和调节剂
除了细胞因子,工程鼠伤寒沙门氏菌也可以表达细胞毒性剂和调节剂来直接杀死肿瘤细胞或抑制肿瘤血管的生成。TNF 相关的细胞凋亡诱导配体(TRAIL)可以激活凋亡信号通路诱导肿瘤细胞凋亡[19]。工程鼠伤寒沙门氏菌表达TRAIL 可以诱导肿瘤细胞发生凋亡,从而抑制黑色素瘤和乳腺癌的生长,而对正常组织没有明显的毒性[58‑59]。另外,内皮素是胶原蛋白的C端片段,具有抗血管生成活性。在小鼠肿瘤模型中,工程鼠伤寒沙门氏菌表达内皮素后,肿瘤血管生成明显减少并可以诱导肿瘤细胞凋亡[60‑61]。另一项研究表明内皮素可以减少肿瘤内微血管的密度,减少VEGF生成和肿瘤内CD8+T 细胞的浸润,从而抑制肿瘤的生长[62]。细胞溶酶A(ClyA,一种34 kDa 的重整后溶血蛋白)可引起哺乳动物细胞膜的孔隙形成,从而导致细胞凋亡[6,62]。此外,FasL 是一种属于肿瘤坏死因子蛋白家族的膜蛋白,与受体(Fas)结合后可以在Fas 敏感细胞中启动凋亡信号。在小鼠肿瘤模型中,工程鼠伤寒沙门氏菌表达FasL 后与其受体(Fas)结合可以明显抑制原位瘤和转移瘤的生长,且对正常组织没有明显的毒性[63]。
3.3 抗肿瘤蛋白
许多蛋白可以影响肿瘤的生长,细菌表达这些蛋白可以明显抑制肿瘤的生长。天青蛋白(azurin‑like protein, Laz)是一种抗肿瘤蛋白,它是由脑膜炎奈瑟氏菌(Neisseria meningitidis)产生的。在脑部肿瘤中,Laz 可以与肿瘤抑制蛋白P53 相互作用,从而诱导肿瘤细胞凋亡[64]。Mansour 等[64]研究表明,鼠伤寒沙门氏菌VNP‑20009 表达LAZ 蛋白可以诱导胶质母细胞发生凋亡。胶质瘤组织中MMP‑2和MMP‑9的水平升高可以促进肿瘤的侵袭、血管生成和转移。金属蛋白酶的组织抑制剂(TIMP)是MMP 的一个同源抑制剂家族,通过抑制MMP 来控制细胞外基质的降解[65]。在小鼠胶质瘤模型中,鼠伤寒沙门氏菌SHJ2037 表达TIMP‑2 后抑制MMP‑2 的表达从而抑制胶质瘤的生长[65]。此外,Tum‑5 是一种抗血管生成蛋白。它可以降低mTOR 激酶的磷酸化和真核生物起始4E 阻止内皮细胞蛋白的合成,从而抑制新生血管的形成。有研究表明,大肠杆菌(Escherichia coliNissle 1917)表达Tum‑5 可以通过抑制肿瘤组织内新生血管来发挥抗肿瘤作用,从而抑制黑色素瘤的生长[66]。p53是一种肿瘤抑制蛋白,它与肿瘤的发生、发展密切相关。在此基础上,He Lian 等[67]用大肠杆菌(Escherichia coliNissle 1917)表达p53 和Tum‑5 融合蛋白,结果发现肝细胞癌的生长明显受到抑制且没有明显的副作用。
3.4 酶蛋白类
在给予原药时,细菌表达的酶蛋白可将无毒性的原药转化为有活性的毒性药物,从而降低全身毒性。胞苷脱氨酶主要存在于肠杆菌科和假单胞菌科,其具有脱氨基的功能[68]。工程鼠伤寒沙门氏菌表达胞苷脱氨酶,使无毒的5‑氟胞嘧啶(5‑FC)转变为5‑氟尿嘧啶(5‑FU),其可以明显抑制肿瘤的生长而不损伤其他正常组织[69‑70]。工程鼠伤寒沙门氏菌在肿瘤部位聚集后表达羧基肽酶G2 后可以抑制黑色素瘤的生长[71]。表达嘌呤核苷磷酸化酶(ePNP)工程鼠伤寒沙门氏菌可以将6‑甲基嘌呤‑2'‑脱氧核苷(MePdR)转化为6‑甲基嘌呤,从而抑制小鼠体内黑色素瘤的生长[72]。梭状芽孢杆菌(Clostridium sporogenes)表达大肠杆菌来源的硝基还原酶(NTR),其提高了新型DNA交联剂PR‑104 的抗肿瘤活性,从而抑制宫颈癌的生长[73]。
3.5 siRNA
siRNA(RNAI)是由长19~30 个核苷酸组成的双链RNA。它可以介导序列特异性基因的沉默,从而为肿瘤治疗提供一种新的策略。然而,siRNAs 带负电荷,具有膜不渗透性、在系统循环中高度不稳定等缺点。所以如何有效地传递小干扰RNAs(siRNAs)靶向到肿瘤组织是一个巨大的挑战[10,74‑75]。在体外和体内证实,工程菌传递siRNA可以特异性下调相关因子的表达[76‑77]。程序性细胞死亡蛋白1(PD‑1)是一种重要的免疫检查点分子,其可以通过抑制效应T细胞的功能和诱导T 细胞耗竭,使肿瘤细胞逃脱宿主的免疫杀伤[78]。工程鼠伤寒沙门氏菌表达靶向抑制PD‑1 的siRNA与吡莫嗪联合运用可以显著抑制小鼠体内黑色素瘤的生长。该研究表明,其可以诱导肿瘤细胞凋亡和增加肿瘤组织中CD4+T 细胞和CD8+T 细胞的数量[79]。缺氧诱导因子‑1(HIF‑1α)是一种关键的转录因子,可以激活几乎所有参与糖酵解的酶的表达。有研究证实,在恶性肿瘤中,缺氧诱导因子‑1(HIF‑1α)表达上调可以促进肿瘤的生长和转移[80]。在体内外卵巢癌细胞中下调HIF‑1α 后,卵巢癌细胞对化疗显著敏感[77]。同样地,在前列腺癌中肿瘤细胞由有氧糖酵解转变为线粒体氧化磷酸化,从而显著增强前列腺癌细胞对顺铂的敏感性[76]。Bcl‑2 是一种抗凋亡蛋白,可显著延长细胞对凋亡经典刺激的生存。值得注意的是,Bcl‑2蛋白常常在肿瘤细胞中过度表达,其有利于肿瘤细胞生存和治疗抵抗[81‑83]。工程鼠伤寒沙门氏菌表达siRNA靶向抑制Bcl‑2后,Bcl‑2蛋白水平明显下降且小鼠黑色素瘤生长明显变慢[83]。另外,STAT3在多种人类肿瘤中持续激活,在促进肿瘤细胞增殖和生存方面起着重要作用。靶向抑制STAT3表达后也表现出明显的抗肿瘤疗效[84]。内多酰胺2,3‑二氧酶1(IDO)是一种色氨酸分解代谢酶,其可以抑制适应性免疫反应,包括激活调节性T 细胞(Treg)、抑制效应性T 细胞的活性,甚至可以诱导免疫细胞凋亡[85]。抑制IDO 的表达后,可以使肿瘤组织中多形核中性粒细胞浸润增加,从而增强抗肿瘤免疫反应[86]。
3.6 其 他
此外,近年来,PD‑1 单克隆抗体和其他免疫检查点抑制剂的临床试验表现出明显的疗效。然而,有一大群肿瘤患者不能对这些免疫治疗产生反应并且有多重毒性反应[87‑88]。因此,如何使PD‑1单克隆抗体和其他免疫检查点抑制剂靶向到肿瘤组织是一个亟需解决的问题。工程菌因其独特的优势成为了一个理想的工具。2020 年,来自哥伦比亚大学的团队以尼氏大肠杆菌作为一个天然平台,设计了一个系统使尼氏大肠杆菌可以稳定表达并释放PD‑1 和CTLA‑4 纳米抗体。研究结果表明,与单纯运用单克隆抗体相比,注射表达PD‑1和CTLA‑4 的尼氏大肠杆菌后可以显著抑制肿瘤生长。此外,该研究进一步发现小鼠体内活化的T细胞和记忆T 细胞数量明显增加[22]。该团队以尼氏大肠杆菌作为一个天然平台,使其可以稳定表达和释放CD47 纳米抗体。CD47 是一种抗吞噬受体,在许多肿瘤中高度表达。研究发现,阻断CD47 后在肿瘤微环境中浸润性T 细胞的激活显著增加,从而抑制肿瘤的生长和转移[89]。STING 激活后可以增加IFN‑1 的分泌,从而增强抗肿瘤免疫反应。Lora 等[23]工程化尼氏大肠杆菌靶向STING 后激活吞噬性APCs 细胞,研究发现抗肿瘤免疫反应得到显著增强。在肿瘤中,L‑精氨酸是抗肿瘤T细胞反应的重要因素,人为补充L‑精氨酸可以增加肿瘤组织内L‑精氨酸的水平。但人为补充所需剂量太大,操作上不太现实。为了使L‑精氨酸在肿瘤组织中维持较高水平,有研究者瘤内注射能将氨气合成L‑精氨酸的工程尼氏大肠杆菌,发现肿瘤组织中L‑精氨酸维持在较高水平。进一步发现注射工程尼氏大肠杆菌后,肿瘤组织内浸润的T 细胞明显增多并且具有长期抗肿瘤免疫效应[24]。
4 总结和展望
近几十年来,工程菌治疗肿瘤取得了巨大进展。工程菌在肿瘤治疗方面具有许多优点。肿瘤靶向性可以使细菌在肿瘤部位聚集,而在正常组织中聚集较少,并且随着时间的推移可以被免疫系统清除,从而减轻系统毒性。与化疗和放疗相比,细菌具有运动性。因此,细菌可以渗透入肿瘤组织深部,从而杀死深部的肿瘤细胞。与单一细菌治疗相比,细菌作为载体递送各种抗肿瘤剂可以协同提高抗肿瘤的疗效。一方面,细菌可以靶向聚集在肿瘤组织直接杀死肿瘤细胞,或者抑制肿瘤血管的生成和激活免疫系统的能力;另一方面,细菌可以在肿瘤组织中增殖,从而持续表达抗肿瘤剂[9‑11,35]。最新的一些研究也表明,工程菌和免疫治疗(包括PD‑1 抑制剂和CTLA‑4 检查点抑制剂)联合运用也取得了令人期待的结果。
尽管基因改造的细菌在肿瘤治疗方面有许多优点,但是一些临床研究并未取得令人满意的结果,基因改造的细菌在运用于临床前还有许多问题需要解决。首先,安全性是细菌治疗肿瘤的先决条件。如果毒性没有充分减弱,经系统注射的细菌可能会在血液中增殖,释放细菌毒素,甚至会引起严重的感染性休克。通过对细菌的相关基因进行改造,可以使细菌的毒力得到不同程度的降低,从而增强其安全性。然而,毒性过度减低,也会使细菌治疗肿瘤的疗效大大减低。其次,在减弱细菌毒力的同时,还要增强细菌靶向到肿瘤组织的能力,以减少对其他正常组织的影响。如何平衡细菌毒力和抗肿瘤能力是一个难点,需要设计更精巧的基因线路来对细菌进行改造。最后,细菌的遗传不稳定性也是一个潜在的问题,因为突变可能会产生无效或有害的表型。随着合成生物学的发展,这些问题都将解决。在不久的将来,细菌治疗将会是一种具有巨大潜力的肿瘤治疗的方法。递送抗肿瘤分子基因工程菌总结于表1。
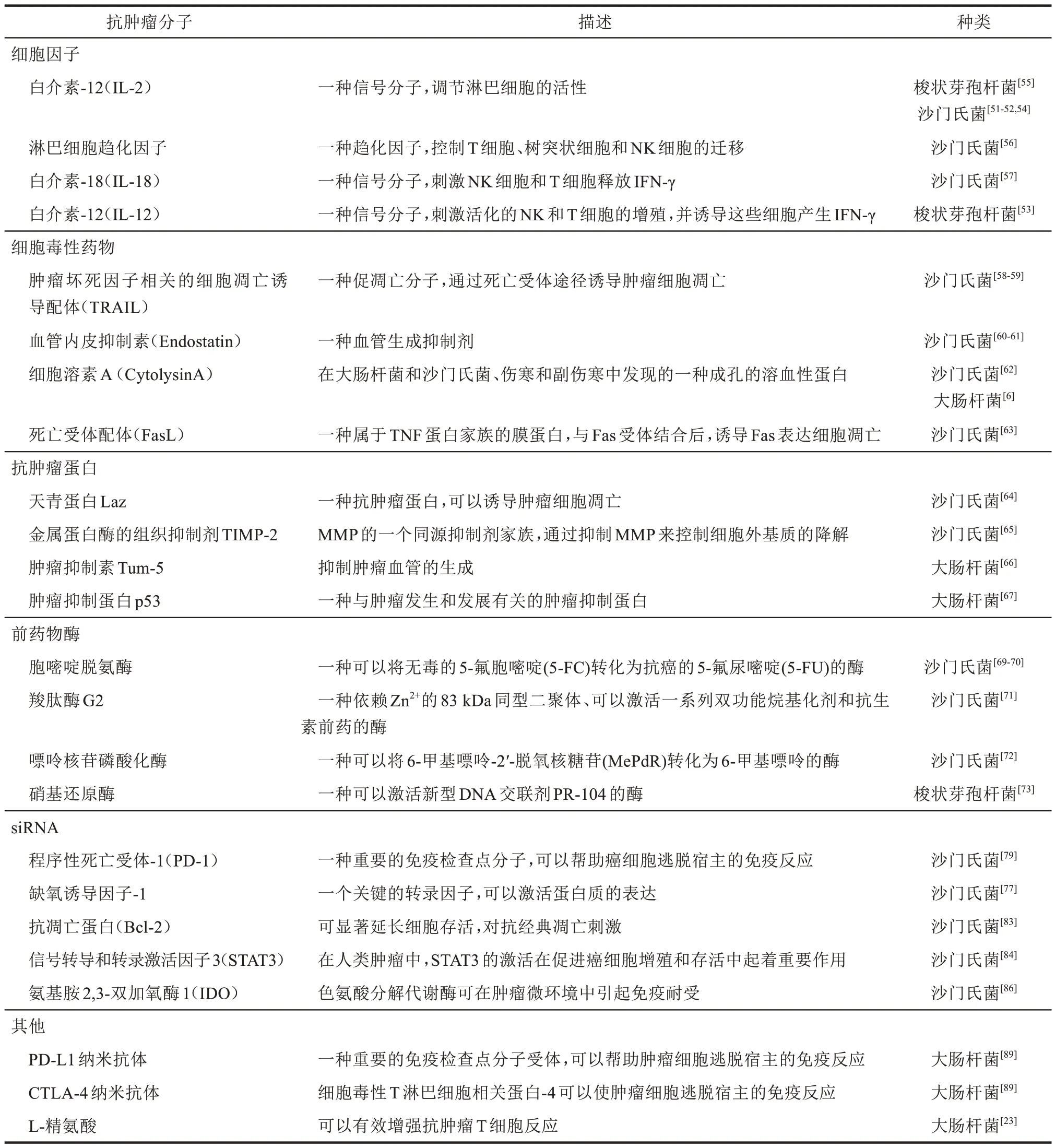
表1 递送抗肿瘤分子基因工程菌Table 1 Anti‑tumor therapeutic agents delivered by engineered attenuated bacterium

