低温甲醇洗系统铵盐结晶热力学研究
王伟民,王兵,李霁阳,王红艳
(1.陕西化工研究院有限公司,陕西 西安 710054;2.陕西省轻工业研究设计院,陕西 西安 710000;3.陕西延长青山科技工程股份有限公司,陕西 西安 710054)
低温甲醇洗工艺是利用合成气中H2S、COS、CO2等气体低温下相对溶解度的区别,将其分离的工艺过程[1]。工艺流程目前多使用一步法(林德)[2],在实际运行过程中,系统中NH3逐渐富集,生成易结晶的铵盐,严重影响设备安全、稳定运行[3-4]。目前,针对CO2-NH3-H2O平衡体系有许多热力学模型研究成果[5-6],但针对结晶的主要推动力过饱和度和由溶析引起的离子间微观力改变的研究较少[7-10]。针对CO2-NH3-H2O-CH3OH平衡体系结晶的热力学研究,在预测系统内结晶分布上具有重要意义。
1 实验部分
1.1 试剂与仪器
碳酸氢铵、无水甲醇均为分析纯;CO2,纯度99.90%;去离子水,一级。
条形对开视窗反应釜;DLSB-5低温恒温冷却液循环泵;DP-X7533结晶点测定仪。
1.2 实验方法
采用静态法和动态法测定铵盐在CO2-NH3-H2O-CH3OH平衡体系中的介稳区。
1.2.1 静态法 将过量碳酸氢铵加入实验要求配比溶液中,在实验温度下,充分溶解饱和,用滴定法测其静置液上层溶液中碳酸氢铵含量。
1.2.2 动态法 参照一步法(林德)工艺包数据[2],按照512流股质量分率配制一定比例的溶剂,将溶剂和碳酸氢铵注入条形对开视窗反应釜,开启低温恒温冷却液循环泵,冷却至实验温度,保温30 min,待其充分溶解。开启结晶点测定仪的激光发射器和记录仪,将甲醇滴加到混合溶剂体系中,出现结晶后停止滴加,并记录滴加甲醇量。
2 结果与讨论
2.1 体系介稳区测定
碳酸氢铵在CO2-NH3-H2O-CH3OH平衡体系下的溶解度曲线见图1。

图1 溶解度随温度及溶剂组成变化曲线Fig.1 Solubility curve with temperature and solvent composition
由图 1可知,随温度的升高碳酸氢铵在不同摩尔分率(Xc)的H2O-CH3OH体系中的摩尔溶解率(Xa)升高。当体系中Xc增大,溶解曲线逐渐趋于平缓,这表明离子间的静电力成为结晶的主导因素,Xa受温度的影响变小。
由静态法和动态法所测的实验数据得到的不同温度下碳酸氢铵在CO2-NH3-H2O-CH3OH体系中的介稳区间见图2~图4。

图2 -15 ℃下溶质介稳区Fig.2 Solute metastable zone at -15 ℃
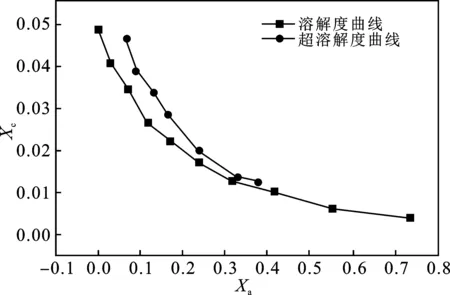
图3 -20 ℃下溶质介稳区Fig.3 Solute metastable zone at -20 ℃
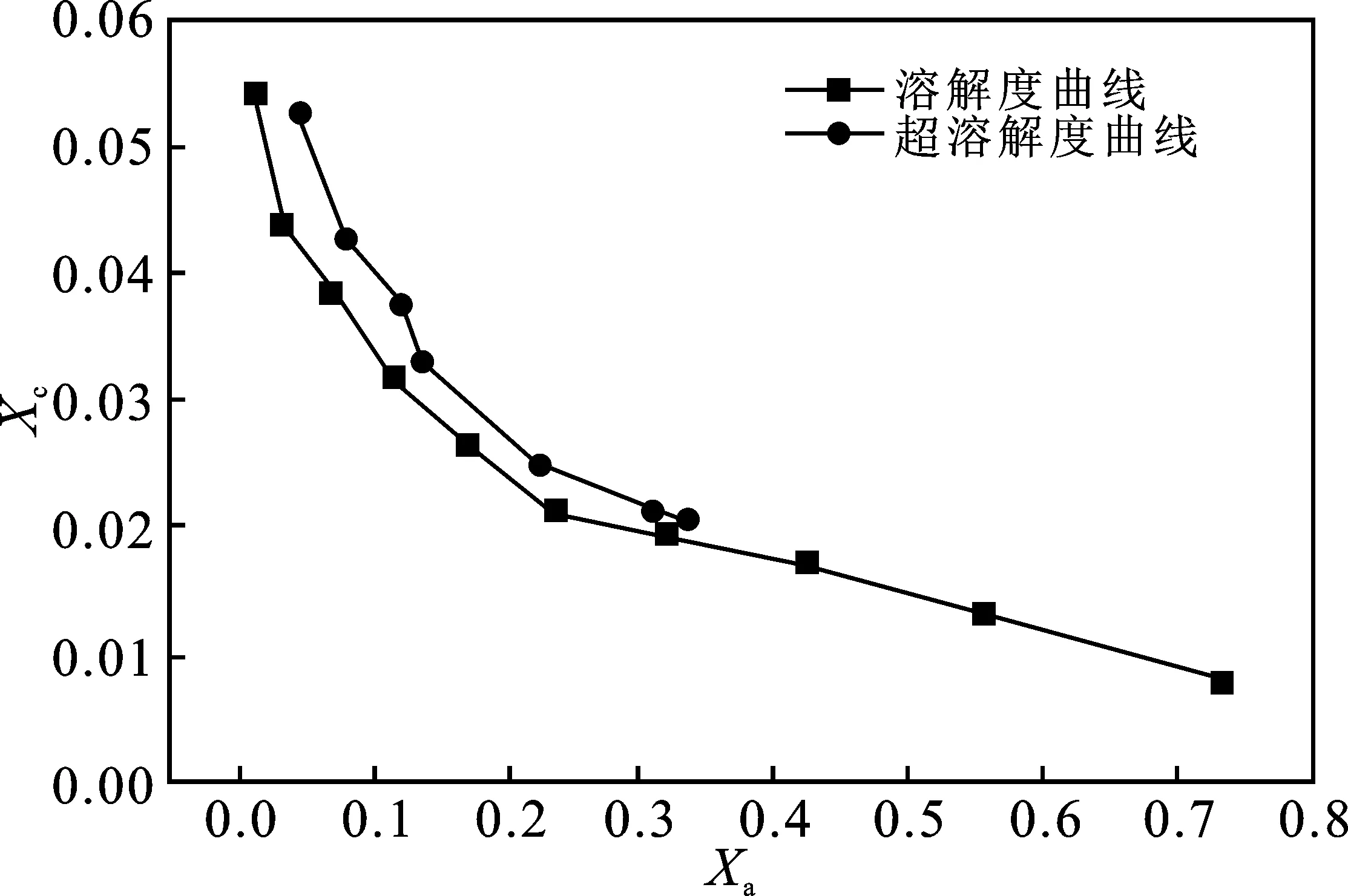
图4 -25 ℃下溶质介稳区Fig.4 Solute metastable zone at -25 ℃
在理想体系中,溶解度曲线和超溶解曲线不相交,始终保持一段距离曲线[8]。
由图2~图4可知,CH3OH摩尔分率Xc>0.3后,曲线有明显相交趋势,体系介稳区几乎消失,表明甲醇的存在对CO2-NH3-H2O体系介稳区的影响较大,这是因为主溶剂H2O和反溶剂CH3OH的化学结构差异,使离子之间的微观力发生改变,降低了碳酸氢铵的溶解度。同时,体系中实际水含量的减少约束了离子活动空间,间接推动晶体成核。同时,随着温度升高,分子扩散加剧,成核速率相对提高,介稳区宽度变窄趋势更加明显。
2.2 体系溶解度模型
活度系数方程作为热力学的重要理论,在相平衡及溶解度的领域成为机理研究的主要手段,其中应用比较广泛的是理想状态模型以及Apelbat 模型,理想状态模型方程如下。
(1)
式中:X为固体溶解度,γx为活度系数,Ttp为三相点温度,ΔfusH为熔融焓。当压力不变时,温度与溶解度修正的Apelbat 模型如下:
(2)
忽略体系溶剂效应和热容差,上式可被简化为:
(3)
因CO2-NH3-H2O-CH3OH体系的特殊性,铵盐的结晶模型目前研究成果较少。Design-Expert软件作为一款响应面分析软件,可以实现实验设计、实验数据拟合及模型可靠性分析的多种功能[11-13]。利用软件对实验数据进行模拟,实验的因素与水平见表1,结果见表2。

表1 响应面实验因素与水平Table 1 Response surface experimental factors and levels
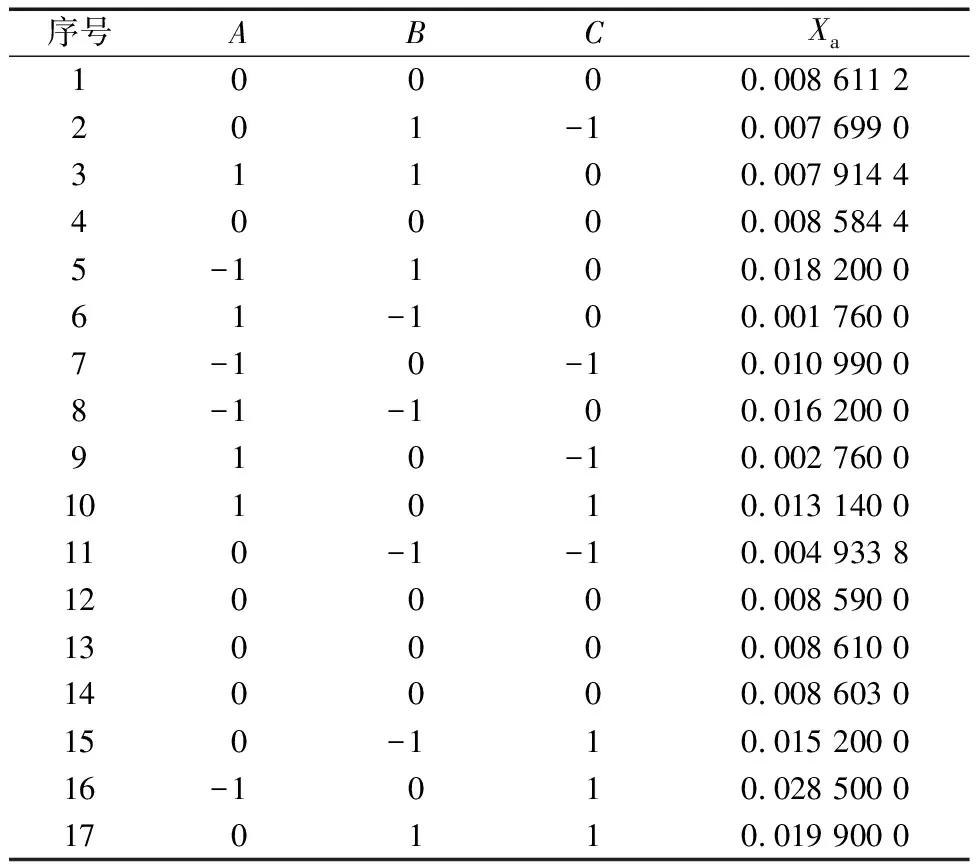
表2 响应面实验结果Table 2 Response surface experimental results
通过对各个因素的拟合,得到回归方程:Xa=0.008 6-0.006 0A+0.002 0B+0.006 3C+0.001 0AB-0.001 8AC+0.005BC+0.002 2A2+0.002 2B2+0.003 1C2,模型方差分析结果见表3,响应面实验检验结果见图5、图6。

表3 响应面实验方差分析结果Table 3 Response surface analysis of variance

(a) 残差正态分布图

图6 响应面3维曲线图Fig.6 Response surface 3-D graph
由图5a、图5b可知,残差符合正态分布,预测值与残差基本无重合。由图5c可知,预测值与实际值基本重合,且上述回归方程的F值分别为143.95,噪音出现的概率<0.000 1,故这个模型是十分显著的。因此利用该Quadratic模型分析比对数据结果合理、可靠。
3 结论
(1)CO2-NH3-H2O-CH3OH体系的结晶溶解度和温度呈正相关,体系中甲醇与水的化学结构差异产生的离子间的静电力成为诱导结晶的主要因素。介稳区范围的主要影响因素是温度和甲醇摩尔分率(Xc),当Xc>0.3后,体系介稳区几乎消失。
(2)利用Design-Expert软件对实验数据的响应面分析,拟合的回归方程F值分别为143.95,噪音出现的概率< 0.000 1,残差符合正态分布。所得回归方程结果可靠,可用于预测不同工况下结晶的分布。

