功能菌群对柴油污染土壤的修复及菌群演替特性
赵中汀,李 爽,朱春昀,马会强
(辽宁石油化工大学 环境与安全工程学院,辽宁 抚顺 113001)
全球发生过多起柴油污染事件,其造成的巨大损失无法估量,而且影响还在持续[1-2]。柴油在开采、加工和运输等过程中会泄漏到地面,对土壤环境造成污染[3]。工业的持续发展和对燃料的需求不断增长,使排放的污水和污泥中含有的柴油类物质不断增加,对周围环境造成严重危害[4-5]。柴油污染物进入到土壤后,其腐蚀性成分石油烃不仅对土壤环境造成污染,而且还会通过蒸发等途径进入到大气环境中,通过渗透迁移到地下水环境中,然后转移到植物及动物体内,最终对人类健康造成危害[6]。柴油污染已经成为急需解决的问题,柴油污染的修复方法主要有物理修复方法、化学修复方法和生物修复方法。物理修复方法具有操作复杂、成本高的特点[7];化学修复方法具有一定的危险性,且操作复杂,易产生其他污染;生物修复方法有植物修复方法、动物修复方法和微生物修复方法,其中微生物修复方法具有安全可靠、操作简单、利于可持续发展的优点,被认为是一种安全、经济、高效和可持续的技术[8-9],其原理是通过微生物将有机物的有害成分降解为无害物质,如二氧化碳和水。Q.Xia 等[10]研究发现,在粗质地的土壤中真菌物种丰富度和多样性均有所提高,土壤性质是影响微生物群落结构和组成的主要因素之一。T.G.Weldmichael 等[11]研究发现,不同土壤深度的微生物呼吸速率不同,表层土壤的微生物呼吸速率高于地下深层土壤。M.Zhang 等[12]研究发现,由于土壤性质的不同,不同恢复类型的细菌和真菌群落存在明显差异。S.Tajik等[13]研究发现,土壤微生物的分布与地形的属性有关,所设计的地形参数为发现微生物群落变化提供了低成本、可访问的数据和准确的模型。一般来说,若柴油在土壤中质量分数过高也会使微生物中毒,从而抑制微生物的活性[14]。
本研究以柴油为主要碳源,进行柴油污染土壤人工模拟实验,筛选出可降解柴油的高效菌群。通过高通量测序技术,分析了在不同条件下柴油高效降解菌群的多样性以及对柴油的降解效果。
1 材料和方法
1.1 试剂与仪器
试剂:盐酸(质量分数为37%),天津大茂化学试剂厂;氯化钠、氯化钙、氯化钴、氯化钡,天津博迪化工有限公司;正己烷,天津富宇精细化工有限公司;酚酞,天津登峰化学试剂有限公司;氢氧化钾、磷酸氢二钾、硫酸铵、氯化镁、乙二胺四乙酸(EDTA),天津恒兴化学试剂制造有限公司;磷酸二氢钠,沈阳新兴试剂厂;硫酸锌,天津光复精细化工研究所;硫酸铁、硫酸铜、氯化锰,国药集团化学试剂有限公司;钼酸钠,合肥工业大学化学试剂厂。本实验所用试剂均为分析纯。
仪器:HZQ-Q 型全温振荡器,哈尔滨东联电子技术开发有限公司;UV-5100 型紫外可见分光光度计,上海元析仪器有限公司;LDZX-40KB 型立式热压力蒸汽灭菌锅,上海申安医疗器械厂;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司。
1.2 无机盐培养基
常量溶液:磷酸氢二钾1 550.0 mg/L,磷酸二氢钠850.0 mg/L,硫酸铵2 000.0 mg/L,氯化镁100.0 mg/L。
微量溶液:硫酸锌2.0 mg/L,氯化钙1.0 mg/L,硫酸铁5.0 mg/L,钼酸钠0.2 mg/L,硫酸铜0.2 mg/L,氯化钴0.4 mg/L,氯化锰1.0 mg/L。
制备条件和过程:在无菌环境中,按照配方分别称取定量药品,加入所需水量使药品溶解;溶解后的药品混合为常量溶液和微量溶液;用移液管移取99 mL 常量和1 mL 微量无机盐,并将其加入无菌锥形瓶中,调节pH=7.0。
1.3 柴油降解菌群的筛选及驯化
取10 g 柴油污染场地土样置于装有100 mL 蒸馏水的250 mL 锥形瓶中,在15 ℃下以150 r/min 转速振荡培养3~4 h。对上述培养液进行驯化,采取柴油质量浓度递增的方式,连续培养9 次,柴油质量浓度按照500、1 000、1 500、2 000 mg/L 递增。具体步骤为:从初始培养液中移取4 mL 加入至以柴油为唯一碳源的100 mL 无机盐液体培养基中,其中柴油质量浓度为500 mg/L,在15 ℃下培养20 d,连续培养2次;从上一培养液中移取4 mL 加入至以柴油为唯一碳源的100 mL 无机盐液体培养基中,其中柴油质量浓度为1 000 mg/L,在15 ℃下培养20 d,连续培养2次;从上一培养液中移取4 mL 加入至以柴油为唯一碳源的100 mL 无机盐液体培养基中,其中柴油质量浓度为1 500 mg/L,在15 ℃下培养20 d,连续培养2次;从上一培养液中移取4 mL 加入至以柴油为唯一碳源的100 mL 无机盐液体培养基中,其中柴油质量浓度为2 000 mg/L,在15 ℃下培养20 d,连续培养3次。筛选出菌群用于柴油污染土壤降解实验。
1.4 菌群修复污染土壤模拟实验
1.4.1 柴油污染环境的构建 构建柴油污染环境所需的土壤来自无柴油污染的场地,柴油为市售0#柴油。
取两个等份(每份150 g)土壤制成土柱,对两个土柱进行灭菌处理,并分别命名为A 土柱和B 土柱。向A 土柱中投加柴油降解菌群和一定量的蒸馏水,使土壤含水率达到50%;B 土柱不投加菌群,仅投加蒸馏水使土壤含水率达到50%,作为空白对照组。同时,向两个土柱中加入1 000 mg/kg 柴油。1.4.2 柴油降解情况分析(1)测定土壤中残留柴油质量分数。在培养第5、10、15、20、30 d,分别测定A、B 土柱内土壤中残留的柴油质量分数。分别移取A 土柱和B 土柱的土壤样品,向其中加入去离子水20 mL、正己烷30 mL,并在振荡器上充分振荡1 h,倒入布氏漏斗内进行真空抽滤;分别用30、20 mL 正己烷和20 mL 去离子水清洗容器瓶,将清洗液倒入布氏漏斗内一并进行真空抽滤,以此减少损失;将抽滤后的清液移入250 mL 分液漏斗中,摇匀后静置分层,收集下层水相于干净烧杯中,将正己烷萃取相通过无水硫酸钠填充的过滤层,收集于干净的100 mL 蒸馏瓶中;再将烧杯中的水相倒回分液漏斗,分别用30、20 mL 正己烷萃取2 次,合并过滤后的有机相置于先前的蒸馏瓶中,将蒸发装置放置于水浴中浓缩,然后用正己烷在10 mL 比色管中定容。使用紫外分光光度计在225 nm 处测定吸光度,对照标准曲线,确定其质量分数。如果样品质量分数过高,超出了标准曲线范围,则稀释后再测定。(2)测定柴油降解菌群呼吸强度。在培养第5、10、15、20、30 d,分别测定A 土柱内土壤中CO2的质量分数,该值可表示土壤中菌群的呼吸强度。根据土壤呼吸强度的测定原理,采取直接吸收法测定。方法如下:称取3 g 土样,用纱布包好,再用绳子将其悬挂于盛有一定量KOH 的广口瓶内,密闭,使土样中释放出来的CO2被瓶内的KOH 吸收;培养1 d后取出土样,向瓶内加入过量BaCl2溶液及酚酞指示剂,用盐酸滴定至无色。将没有投加菌群的B 土柱的土样作为空白对照。
(3)分析菌群在不同土壤深度对柴油的降解效果。投加A、B 土柱中的菌群降解30 d 后,分别测定A、B 土柱内深度为0、5、10、15、20 cm 处土壤中残留柴油质量分数,通过土壤中柴油的残留量分析菌群在不同土壤深度对柴油的降解能力。
1.5 柴油降解菌群的高通量测序
在构建的柴油污染土壤中取样,在投加菌群第0 d 时取样制成样本A1;在降解30 d 后于表层(0~1 cm)处取样制成样本A2;在降解30 d 后于深层(19~20 cm)处取样制成样本A3。将以上制成的所有样本送至生工生物工程(上海)股份有限公司进行高通量测序。
2 结果和分析
2.1 菌群对柴油污染土壤的降解效果
2.1.1 菌群降解土壤中柴油效率 以不加柴油降解菌群的灭菌土壤为对照组,考察了投加菌群前后土壤中柴油降解率的变化,结果如图1 所示。由图1 可知,投加菌群后土壤中柴油降解率有明显增加;在降解第5、10、15、20、30 d,投加菌群的样品中柴油的降解率分别为47.3%、59.0%、70.1%、72.5%、74.3%,未投加菌群的样品中柴油的降解率分别为3.2%、5.7%、9.2%、15.5%、17.0%;菌群对土壤中的柴油降解能力稳步提升,在降解时间为5~15 d 时,菌群对柴油的降解速率增加较快,此时菌群的生长繁殖最旺盛,而在降解时间为15~30 d时,菌群对柴油的降解速率逐步放缓,营养物质的减少使菌群生长繁殖处于稳定状态,与菌群生长规律相一致。

图1 投加菌群前后土壤中柴油降解率的变化Fig.1 Changes of diesel degradation rate in soil before and after adding flora
2.1.2 土壤中菌群的呼吸强度分析 土壤中CO2质量分数可以动态地反映土壤中菌群的呼吸强度。图2 为投加菌群前后土壤中CO2质量分数的变化。由图2 可以看出,在第5、10、15、20、30 d 时,投加 菌 群 的CO2质 量 分 数 分 别 为1.30、3.99、13.27、18.56、22.07 g/kg,未投加菌群的CO2质量分数分别为0.05、0.10、0.15、0.31、0.56 g/kg;在降解开始至降解时间为5 d 时,CO2质量分数较低,这是由于柴油降解菌群投入土壤后需要一定的时间适应新环境,没有立即利用营养物质,因此该阶段菌群生长速率缓慢;随着降解时间的增加,土壤中CO2质量分数逐渐增大,尤其是在降解时间为10~20 d 时CO2释放速率最快,这是由于土壤中微生物在适应新环境后开始代谢土壤中的柴油污染物,进行生长繁殖,使菌群数量逐渐增多,呼吸强度增加,土壤中菌群的呼吸强度随着时间的增加而增强;在降解时间大于20 d 时,菌群的呼吸强度增加幅度开始减小,这是因柴油质量分数的降低、营养物质的限制、微生物生长繁殖速度减缓造成的。

图2 投加菌群前后土壤中CO2质量分数的变化Fig.2 Changes in the cumulative release of CO2 in soil before and after adding flora
2.1.3 菌群在不同土壤深度对柴油的降解效果图3 为柴油在不同土壤深度的质量分数。由图3 可知,在土壤深度为0、5、10、15、20 cm 处投加菌群土壤中柴油的质量分数分别为229.00、261.00、294.00、343.00、421.00 mg/kg,未投加菌群土壤中柴油 的 质 量 分 数 分 别 为756.00、804.00、865.00、899.00、905.00 mg/kg;投加菌群后土壤中的残余柴油质量分数明显低于未投加菌群的残余柴油质量分数;土壤中不同深度菌群对柴油均有较明显的降解效果,随着土壤深度的增加,柴油质量分数也有所增加。这是由于随着土壤深度的增加,其氧气质量分数减少,菌群活性随之降低,菌群对柴油的降解效果变弱,柴油降解菌群对土壤中柴油的降解效果随着土壤深度的增加而逐渐降低。与未投加菌群的土壤样本相比,在投加菌群的样本中,菌群对土壤中柴油的降解率在土壤深度为20 cm 时达到53.5%。

图3 柴油在不同土壤深度的质量分数Fig.3 Mass fraction of diesel at different depths in soil
2.2 柴油污染土壤中柴油降解菌群多样性分析
对土壤样本进行了多样性分析,结果如表1所示。
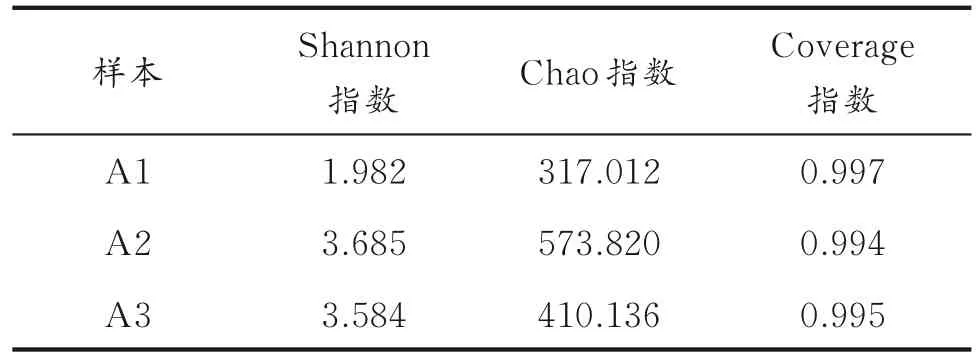
表1 Alpha 多样性分析Table 1 Alpha diversity analysis
由表1 可以看出,测序的三个样本Coverage 指数均大于0.993,说明测序结果具有较高的可信性。
由Shannon 指数可以看出,样本A2 的物种多样性高于样本A3,说明在表层氧气充足的状态下,菌群的繁殖状况优于深层缺氧的环境;样本A2 和A3 的物种多样性均远高于样本A1,说明该柴油降解菌群在柴油污染环境中具有较强的适应能力,能够高效地繁殖。
由Chao 指数可以看出,样本A2 中微生物的总数大于样本A3,这是由于深层土壤中氧气质量分数低,会影响微生物的生长繁殖;样本A2 和A3 中物种的丰度均高于A1,说明将菌群投加到柴油污染环境中可以较好地进行生命代谢活动,使其物种丰度增大。
2.3 柴油降解菌群优势菌种分析
土壤灭菌后,分别对样本A1、A2、A3 中的微生物群落结构进行分析,得到相对丰度3D 柱状图,结果如图4 所示。由图4 可知,样本A1 主要由菌群Proteobacteria、Firmicutes以及少量Bacteroidetes组成;样本A2 中Proteobacteria相对丰度占比提高,由75.4% 增加到80.6%,增加幅度为5.2%,说明Proteobacteria可以较好地适应柴油污染土壤的环境,并可以在其中生长繁殖,结合土壤中柴油的残留质量分数判断,Proteobacteria是降解柴油的主要菌群;样本A3 与A2 的群落结构差异较大,样本A3中主要的优势菌群为Firmicutes,其相对丰度占比为79.9%,而在A2 中其相对丰度占比仅为8.1%,Firmicutes的相对丰度增加幅度为71.8%,这是由于深层土壤中氧气质量分数较低,菌群处于缺氧环境,从而厌氧菌群Firmicutes可以大量繁殖并降解土壤中的柴油类污染物。

图4 相对丰度3D 柱状图Fig.4 3D histogram of relative abundance
通过以上分析可知,本实验筛选出的柴油高效降解菌群中主要的优势菌群为Proteobacteria、Firmicutes以及少量Bacteroidetes,此菌群可以适应不同的环境,对柴油类污染物有较高的降解效率。
3 结 论
(1)投加菌群的降解时间大于30 d 时,菌群对土壤中柴油降解率达到74.3%;土壤中菌群在30 d的连续降解过程中,其呼吸强度逐渐增大;菌群对柴油的降解能力随着土壤深度的减小逐渐增强。
(2)土壤中菌群多样性分析结果表明,将菌群投加入土壤后,土壤中微生物多样性和丰度都有所增加,说明该菌群对柴油污染土壤适应性良好,能够高效地生长繁殖。
(3)各样本的微生物群落结构组成分析结果表明,在氧气丰富的表层土壤中优势菌群为Proteobacteria,在相对缺氧的深层土壤中优势菌群为Firmicutes,故本实验菌群可适应不同环境。

