α-硫辛酸药用价值的研究进展
代 鑫,毛朝坤,钱 静,陈芳勇,张显武,代小方
(遵义医药高等专科学校,贵州 遵义563000)
0 引言
α-硫辛酸[(±)-α-lipoic acid]简称LA,是一种细胞内天然存在的强效抗氧化剂。从化学角度看[1],LA的二硫五元环被还原后可生成二氢硫辛酸(DHLA),而LA/DHLA的氧化还原电极电势为-0.32 V,因此比谷胱甘肽(GSH)/氧化型谷胱甘肽(GSSG)(-0.24 V)和胱氨酸/半胱氨酸(-0.22 V)在提供抗氧化保护方面更具优势。在生理方面[2],LA作为丙酮酸脱氢酶PDH、α-酮戊二酸脱氢酶KGDH与黄素腺嘌呤二核苷酸FAD等多种线粒体多酶复合物的辅助因子,深刻影响着基于三羧酸循环(TCA循环)的细胞能量代谢。LA可在植物与动物体内合成,也可通过饮食摄入。由于LA/DHLA对人体具有多种生理功能及生化作用机制(图1)[3],近年来已引起广泛关注并取得了一系列的研究成果。本研究从其抗氧化、抗炎症、糖尿病治疗、抗肿瘤、抗细菌及抗病毒感染等方面综述了LA最新的药用价值研究进展。

图1 LA(a)和DHLA(b)的化学结构及其内在化学属性(c)
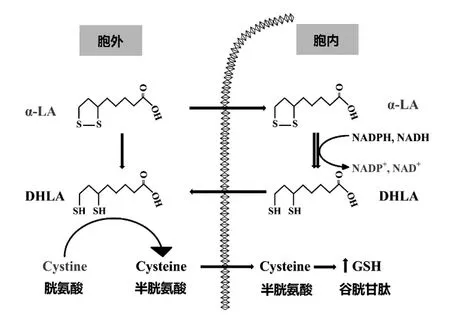
图2 LA的二硫五元环结构
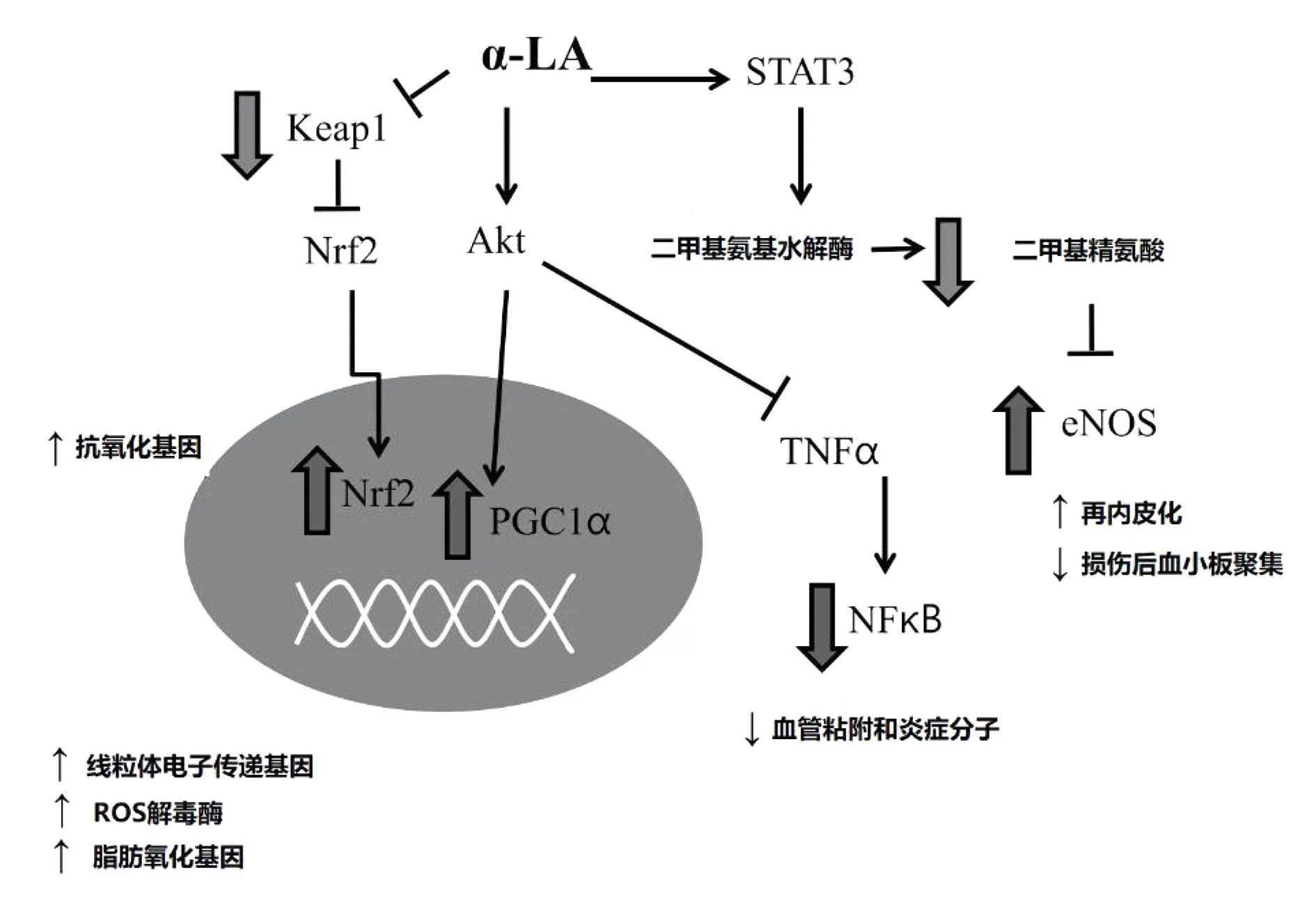
图3 LA对血管活性有益作用的几种途径
1 LA的药理研究进展及应用
1.1 抗氧化
LA/DHLA的抗氧化作用主要表现在以下几个方面:①LA可以直接清除自由基,特别是活性氧自由基(ROS),如•OH、•NO、•ROO等,从而减少自由基对细胞内分子的氧化损伤,保护细胞免受氧化应激损害。②再生内源性抗氧化剂,如GSH、抗坏血酸(VC)及α-生育酚(VE)。③激活抗氧化酶。LA可以通过调节抗氧化酶的活性及表达来增强细胞的抗氧化能力。研究发现[3],LA可通过激活谷胱甘肽过氧化物酶(glutathione peroxidase)、超氧化物歧化酶(superoxide dismutase)及谷胱甘肽还原酶(glutathione reductase)等抗氧化酶的表达与活性,增强细胞的抗氧化防御系统。④抑制氧化应激信号通路。LA可通过抑制氧化应激信号通路来减轻细胞的氧化损伤。LA可以抑制NF-κB、MAPK与Nrf 2等重要的氧化应激信号通路,从而减少氧化应激相关基因的表达,降低氧化应激的程度。⑤保护细胞器功能。LA可保护细胞器免受氧化损伤,通过抑制线粒体氧化应激、维持内质网稳态及保护细胞核DNA等机制,保护细胞器的结构和功能,从而维护细胞的正常生理状态。
LA的二硫五元环通过NADH与NADPH依赖性途径在细胞中还原为二氢硫辛酸(DHLA),DHLA被释放到细胞外空间,增加了细胞中的半胱氨酸转运与GSH水平。DHLA与GSH水平的增加可能会降低活性氧的水平或改变蛋白质的功能及活性[4]。
基于LA较为明确的抗氧化能力,目前已被广泛应用于心血管疾病、肝病、神经系统疾病的治疗中。通过增强心肌细胞的抗氧化能力,减少心脏组织的损伤,降低心脏病发作及中风的风险[5]。通过促进肝细胞的修复与再生保护肝脏细胞,减轻肝脏损伤,从而治疗肝病[6]。通过减轻氧化应激及抑制炎症反应,保护神经细胞免受损伤,对神经退行性疾病如阿尔茨海默病[7]、帕金森病[8]等起到治疗作用。
1.2 抗炎症
LA对炎症的抑制通常认为有以下几个途径:①抑制炎症介质的产生。LA可以抑制一些重要的炎症介质的合成及释放,如前列腺素E2(PGE2)、白细胞介素-1β(IL-1β)及肿瘤坏死因子-α(TNF-α),从而减轻炎症反应。②调节炎症信号通路。通过调节炎症信号通路来抑制炎症反应。LA可以抑制NF-κB、MAPK及JAK/STAT等重要的炎症信号通路的激活,从而减少炎症相关基因的表达及炎症介质的释放。③抑制白细胞活化及浸润。LA可以抑制白细胞的趋化、黏附及迁移,减少白细胞对炎症部位的聚集及浸润,从而降低炎症反应的程度。④调节免疫系统。LA可以调节免疫细胞的活性与分化,增强抗炎细胞(如M2巨噬细胞和调节性T细胞)的功能,抑制炎症细胞(如M1巨噬细胞和Th17细胞)的活性,从而平衡免疫反应,减轻炎症反应。
LA可以调节Nrf2、PGC1α及NFkB的转录活性,增强内皮中eNOS的活性[4]。依赖于其良好的抗炎作用,LA已广泛应用于各种炎症性疾病的治疗,如风湿性关节炎[9],LA具有减轻关节炎炎症及疼痛的作用,改善关节功能,减少关节肿胀。减轻炎症性肠病[10](如溃疡性结肠炎与克罗恩病)引起的肠道炎症反应,缓解腹痛、腹泻及其他相关症状。减轻炎症性皮肤疾病[11](如湿疹及银屑病)引起的皮肤炎症,缓解瘙痒、红肿及其他相关症状。减轻支气管炎与哮喘引起的呼吸道炎症[12],缓解咳嗽、气喘及其他相关症状。对炎症相关的代谢性疾病[13](如肥胖症与2型糖尿病)具有治疗作用,可减轻慢性低级炎症,改善代谢功能。但对于严重的炎症疾病,LA可能需要与其他更具针对性的药物联合使用。
1.3 治疗糖尿病
LA用于治疗糖尿病已经有相当长的历史及较多的临床经验[14]。机制上,LA能提高细胞对胰岛素的敏感性,促进葡萄糖的摄取及利用。通过增加胰岛细胞内的葡萄糖转运蛋白(GLUT4)的表达及活性,增强葡萄糖进入细胞的能力,从而降低血糖水平。促进胰岛素的释放,通过刺激胰岛细胞的胰岛素分泌,增加胰岛素在血液中的浓度。通过调节胰岛素合成与分泌相关的信号通路(如AMPK和CREB等),以促进胰岛素的释放。促进胰岛β细胞的功能和重建,通过促进胰岛β细胞的增殖及分化,增加胰岛素的合成与释放,提高胰岛素的生物学活性。促进胰岛β细胞的修复及再生,改善胰岛功能。糖尿病患者往往伴有氧化应激的增加,导致细胞损伤与功能异常。LA作为一种抗氧化剂,可减少自由基的产生并清除已有的自由基,从而减轻氧化应激反应,保护胰岛β细胞与其他组织免受损伤。另外,LA具有抑制炎症反应的能力,能够改善胰岛素敏感性及代谢功能。

表1 LA对伴有神经病变的糖尿病患者的影响
1.4 抗肿瘤
由于LA的安全性较高,副作用较小,具有一定的抗肿瘤活性,已成为肿瘤治疗的研究热点。研究表明[18],LA可以抑制细胞周期的进展,使癌细胞停滞在G0/G1期或G2/M期,从而阻断肿瘤细胞的增殖与扩散。具有对肿瘤细胞的促凋亡作用,从而抑制肿瘤生长。研究发现[19],LA可以通过多种途径激活凋亡信号通路,如线粒体途径(内源性)与死亡受体途径(外源性)等,从而促使肿瘤细胞发生凋亡。具有抗血管生成作用,可以抑制肿瘤血管生成,从而阻断肿瘤的营养供应。研究显示[20],LA可以抑制血管内皮生长因子(VEGF)的表达及分泌,减少新血管的形成,降低肿瘤的血液供应,抑制肿瘤的生长及转移。调节免疫系统,增强机体对肿瘤的免疫应答。增加免疫细胞的活性,促进免疫细胞的浸润及活化,增强抗肿瘤免疫效应,通过调节免疫抑制因子的表达来抑制肿瘤的免疫逃逸。
目前已发现LA对乳腺癌有一定的抗肿瘤效果,通过减少氧化应激来抑制肿瘤细胞的增殖[21]。研究发现[22],LA可以通过减少肿瘤细胞的生长、促进肿瘤细胞凋亡来抑制肺癌的发展。在利用LA治疗结直肠癌的研究中发现[23],其可通过减少肿瘤细胞的增殖、诱导细胞凋亡及抑制肿瘤血管生成来抑制结直肠癌的发展。目前,这些研究主要是在体外及动物实验中进行,尚未在临床中得到广泛应用。此外,LA作为抗肿瘤辅助治疗的具体用法及剂量仍需进一步研究和验证。治疗肿瘤时,应综合考虑患者的具体情况,在医生的指导下制定个体化的治疗方案。
1.5 抗菌及抗病毒
研究表明[24],LA可以抑制多种微生物的生长及复制,包括细菌、真菌及病毒等。通过破坏细菌的细胞壁及细胞膜来抑制其生长与繁殖,还可抑制微生物的酶活性及蛋白质合成等关键过程,从而杀灭或抑制微生物的生长,甚至包括耐药菌株。还可抑制真菌生物膜的形成,增加真菌的敏感性[25]。LA可作为抗生素的辅助治疗药物,增强抗生素的抗菌效果。研究表明[26],LA能抑制病毒的复制酶活性及病毒蛋白质的合成,从而抑制多种病毒的复制与传播,包括流感病毒、冠状病毒等。LA的抗病毒能力也有一部分是通过增强免疫系统、提高机体对病毒的抵抗力来实现的。
2 总结与展望
α-硫辛酸作为一种具有多重生理功能的抗氧化剂及抗炎剂,其开发与应用前景非常广阔。未来,研发方向可能主要集中在以下几个方面:①抗氧化和抗炎。LA作为一种有效的抗氧化剂和抗炎剂,以抗衰老、心脑血管疾病、免疫调节等为重点研究将继续深入,为其开发出更多的临床应用提供支持。②LA具有良好的生物利用度和安全性,因此在药物开发及治疗方面具有巨大的潜力。研究人员将进一步深入研究其药代动力学、药效学及毒理学,以优化其药物性质,开发出更多的药物形式和给药途径,满足不同疾病的治疗需求。③营养补充品与功能性食品。LA作为一种天然存在于食物中的营养物质,通过研究其生理功能及作用机制,可以更好地了解其在人体内的作用与需求量,从而开发出更多高效、安全的营养补充品及功能性食品。④组合治疗和综合应用。随着对LA作用机制的深入研究,人们将进一步探索其与其他药物或治疗方式的组合治疗及综合应用,将其与其他药物或治疗方式相结合,可能会产生协同效应。如与化疗、放疗等副作用较高的治疗手段相结合,提高治疗效果,保护正常肌体,为临床治疗提供更多的选择及可能性。随着进一步的研究和探索,将有更多基于LA的临床应用,为疾病治疗带来更多的可能性。

