心力衰竭患者Circ-PALLD的高表达受转录因子GATA4的转录调控
黄 卓,曾振宇,李佳,蔡蕊,贺文霞,胡淑婷
1宁夏医科大学基础医学院,宁夏 银川 750004;2海军军医大学附属长海医院心内科,上海200433
在真核生物基因组中,大约90%的基因是转录基因,在这些转录基因中只有1%~2%编码蛋白质,其他大多数转录为非编码RNA(ncRNA)。非编码RNA不编码蛋白质,但却在基因表达调控中发挥重要作用[1]。最近研究表明,前体RNA(pre-mRNA)可以通过不同的选择性剪接产生不同的RNA种类[2]。前体mRNA可经反向剪接形成一种共价闭合的连续环,也就是CircRNAs。并且CircRNAs因其特殊的剪接方式,与线性RNA相比,缺少5'端甲基鸟苷帽子和3'端poly-A尾结构,并且CircRNAs的半衰期明显小于线性RNA分子[3]。CircRNAs因其结构的特殊,可以抵抗核糖核酸外切酶的降解,以及对RNA 折叠的限制[4]。同时CircRNAs可以通过调节线性RNA转录,下游基因表达和蛋白质或肽翻译,在许多生物过程中起着至关重要的作用[5]。据报道CircRNAs的异常调节是各种心血管疾病和代谢紊乱(包括肥胖,高血压)的主要变化之一[6]。并且在心血管疾病中异常表达的CircRNAs可作为心血管疾病临床诊断和判断预后的分子标记物以及潜在的治疗靶点[7]。
有报道称CircRNAs参与心力衰竭、心肌梗死和心脏重构的病理过程[8],但只有少数CircRNAs被证明与心功能有关[9],这些CircRNAs是否与慢性心衰有关,并且参与了心力衰竭的发病机制尚不清楚,有待进一步研究[10]。到目前为止心血管系统中CircRNAs的调控机制与其在衰竭心肌中的表达情况的相关报道甚少。为了研究CircRNAs在心血管疾病中的功能和作用,本研究对已报道的在人和鼠的心衰样本中异常表达的10种CircRNAs 分子进行测序[11,12],并设计引物,探讨CircRNAs与其线性RNA(linear RNA)在人衰竭心肌的表达情况并做对比分析,从中筛选出在衰竭心肌中具有表达差异的CircRNAs——Circ-PALLD。现在很多研究表明,CircRNAs可以与转录因子结合调控基因的表达,但对调控CircRNAs的机制研究却知之甚少。本研究通过生物信息学对调控PALLD的转录因子进行预测,探讨在慢性心衰过程中Circ-PALLD潜在的生物学功能,加深对CircRNAs的了解。
1 资料和方法
1.1 研究对象
1.1.1 病例来源 所有病例来自于海军军医大学第一附属医院2021年5月1日~2023年2月15日期间出院诊断符合CHF 的患者,年龄≥18岁,心衰病史≥6个月。均签署知情同意书。
1.1.2 实验动物 SPF级SD大鼠6只,1~3 d龄,购自上海市计划生育科学研究所实验动物经营部。SPF级动物房饲养,本文的动物实验操作均通过宁夏医科大学医学伦理审查委员会已批准(审批编号:2017-014)。
1.2 主要试剂
胶回收试剂盒(天根生化);75%酒精(国药集团);Hank's平衡盐溶液(上海源培生物科技);1%Ⅰ型胶原酶,Brdu(Sigma);胎牛血清,RIPA 裂解液(上海碧云天生物);DMEM培养基(武汉普诺赛生命科技);Hieff TransTM脂质体核酸转染试剂,2×Hieff PCR Master Mix(翌圣生物科技);Trizol Reagent,PVDF膜(默克);反转录试剂盒HiScript ⅢRT SuperMix for qPCR(+gDNA wiper)试剂盒,DNA marker(诺唯赞生物);SYBR®Green Pro Taq HS 预混型qPCR 试剂盒(爱科瑞生物);本研究中使用的抗体包括anti-GATA4,anti-GAPDH(ABclonal);辣根过氧化物酶偶联二抗(Abways);化学发光系统(新赛美生物科技);本研究使用的引物全部交由金维智公司合成;siRNA均由广州锐博生物公司设计合成;其他生化试剂均为进口分装或国产分析纯。
1.2 CircRNAs的Sanger测序
首先通过NCBI 与Circbase 数据库查找Circ-VWA8,Circ-VMP1,Circ-PRDM5,Circ-PLCL2,Circ-PALLD,Circ-NFATC3,Circ-MLIP,Circ-FAM208A,Circ-ANKIB1,Circ-AGTPBP1的前体序列,Primer3设计PCR引物,经PCR扩增得到以上CircRNAs序列,琼脂糖凝胶电泳后进行胶回收,并送至金维智公司进行Sanger测序,验证以上CircRNAs的反向剪接方式。引物序列见表1。

表1 基因的引物序列Tab.1 Primer sequence for the target genes
1.3 乳鼠原代心肌细胞的培养
将出生1~3 d的新生SD乳鼠于75%酒精中浸泡消毒,取出后置于超净工作台,取出心脏后迅速将心脏迅速置于预冷的HBSS平衡盐溶液中,用无菌眼科剪将心室剪成1 mm3左右组织块,清洗后将组织块转移至10 cm培养皿,加入8倍体积的含1%Ⅰ型胶原酶的DHanks液,4 ℃孵育过夜。孵育完成后,无菌枪头充分吹打直至无组织块存在,移入离心管。离心10 min后弃掉上清,加入含有10%胎牛血清的DMEM培养基重悬细胞,移入10 cm培养皿,置37 ℃,5%的CO2培养箱孵育2 h。2 h后取出培养皿,将上清培养基(心肌细胞)接种于6孔板,置37 ℃,5%的CO2培养箱中培养48h,待细胞贴壁后换液(含1%Brdu DMEM)。
1.4 细胞转染
GATA4 siRNA 与对照siRNA 参照说明书,使用Hieff TransTM脂质体核酸转染试剂进行细胞转染,将siRNA转染入12孔板中的原代乳鼠心肌细胞中。
1.5 聚合酶链式反应(PCR反应)
在研钵中加入液氮,再将组织剪成小块在液氮中磨成粉末,用液氮预冷的药匙取50~100 mg组织粉末加入已盛Trizol液的EP管中,充分混合均匀。室温放置5 min,使用Trizol Reagent从细胞/组织中提取RNA,应用反转录试剂盒HiScript ⅢRT SuperMix for qPCR(+gDNA wiper)试剂盒合成cDNA,使用2×Hieff PCR Master Mix,进行聚合酶链式反应,35个循环后进行琼脂糖凝胶电泳,50×TAE缓冲液用去离子水稀释,倒入样品槽中。用移液枪将样品和DNA marker加入已经准备好的样品孔中。30 min后,停止电泳,紫外下观察显影并拍照,使用GAPDH 作为circRNA或linear RNA的检测内参。引物序列见表1。
1.6 qRT-PCR
使用SYBR®Green Pro Taq HS 预混型qPCR 试剂盒在实时检测系统进行qRT-PCR 检测。使用GAPDH作为circRNA或linear RNA的检测内参,采用2-△△CT法计算基因表达。引物序列见表1。
1.7 Western blot
使用含有苯甲基磺酰氟的RIPA裂解液在冰上裂解提取蛋白。将蛋白质萃取物转移至4%~12%的十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳分离,然后将凝胶上的蛋白转移至PVDF膜。经过5%脱脂奶粉封闭2 h后,使用相应一抗在4 ℃孵育过夜。然后用辣根过氧化物酶偶联二抗在室温下孵育2 h。使用化学发光系统对蛋白印迹进行可视化。所有蛋白条带以GAPDH作为检测内参。
1.8 生物信息学预测与Circ-PALLD有相关性的的转录因子
通过生物信息学预测与Circ-PALLD有相关性的转录因子。R²越接近1及相关性越强。
1.9 数据处理与统计学分析
用Image pro plus 软件对条带进行灰度值检测(IOD)归一化后依据相应比值作为统计数据。应用GraphPad Prism8.0统计软件进行数据分析。数据采用均数±标准差表示,两组间的差异比较采用t检验。以P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 CircRNAs分子反向剪接成环
CircRNAs 通过反向剪接的形式形成环状结构(图1)。通过Sanger测序法得出以上环状分子的RNA序列,我们发现Circ-VWA8通过外显子4与外显子3反向剪接方式成环;Circ-VMP1通过外显子5与外显子2反向剪接方式成环;Circ-PRDM5通过外显子13与外显子7反向剪接成环;Circ-PLCL2通过外显子4与外显子3反向剪接成环;Circ-PALLD通过外显子2首尾反向剪接成环;Circ-NFATC3通过外显子3与外显子2反向剪接成环;Circ-MLIP通过外显子11与外显子4反向剪接成环;Circ-FAM208A通过外显子11与外显子2反向剪接成环;Circ-ANKIB1通过外显子5与外显子2反向剪接成环;Circ-AGTPBP1通过外显子15与外显子13反向剪接成环(图2)。
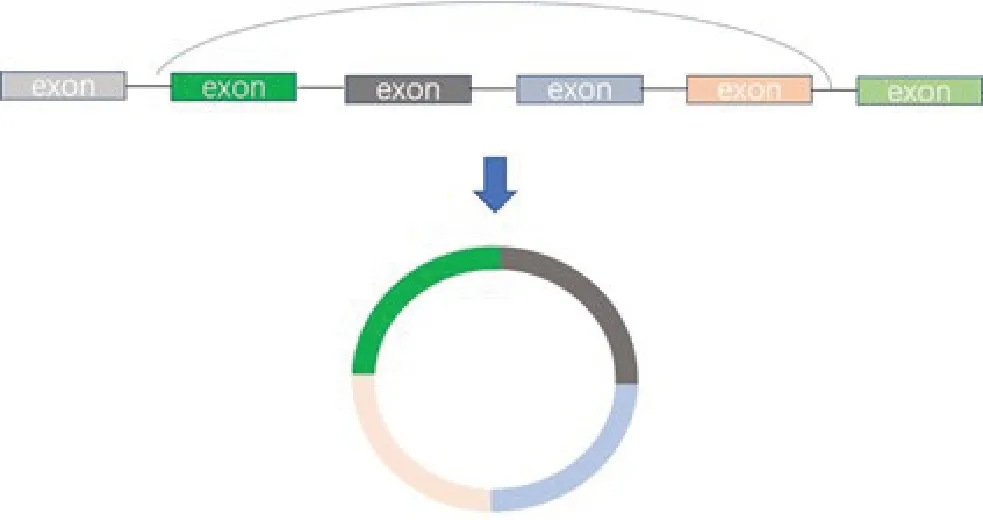
图1 反向剪接示意图Fig. 1 Diagram showing reverse splicing of CircRNAs.

图2 CircRNAs的Sanger测序结果Fig. 2 Sanger sequencing results of the CircRNAs.
2.2 CircRNAs与linear RNA在心衰中的表达
2.2.1 CircRNAs 在衰竭心肌中的表达 通过琼脂糖凝胶电泳检测衰竭心肌组织中Circ-VWA8,Circ-VMP1,Circ-PRDM5,Circ-PLCL2,Circ-PALLD,Circ-NFATC3,Circ-MLIP,Circ-FAM208A,Circ-ANKIB1,Circ-AGTPBP1的表达,发现在衰竭心肌中环状RNA分子的表达水平均上调,其中Circ-VWA8,Circ-ANKIB1,Circ-AGTPBP1,Circ-NFATC3 和 Circ-PALLD的上调最为显著(P<0.05,图3)。
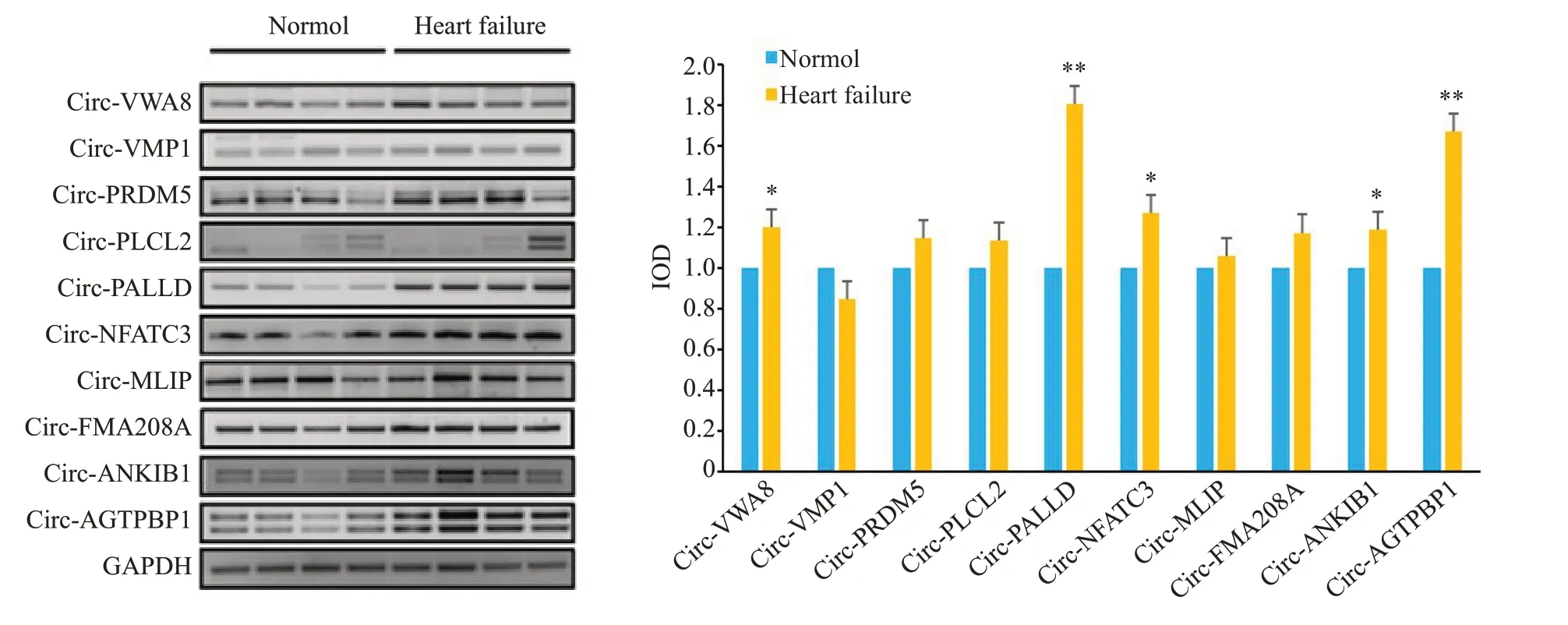
图3 CircRNAs分子在衰竭心肌中的表达Fig. 3 Agarose gel electrophoresis of the amplified CircRNAs from failing myocardium.*P<0.05,**P<0.01 vs Normol(n=4).
2.2.2 linear RNA在衰竭心肌中的表达 通过琼脂糖凝胶电泳检测衰竭心肌组织中VWA8,VMP1,PRDM5,PLCL2,PALLD,NFATC3,MLIP,FAM208A,ANKIB1,AGTPBP1 的表达,发现在衰竭心肌中AGTPBP1,VMP1表达水平升高,而PALLD表达水平降低(P<0.05,图4)。

图4 线性RNA在人衰竭心肌的表达水平Fig. 4 Agarose gel electrophoresis of the amplified linear RNAs from failing myocardium.*P<0.05 vs Normol(n=4).
2.2.3 衰竭心肌中PALLD 与Circ-PALLD 的实时定量PCR检测 通过RT-qPCR 实验结果进一步表明,在衰竭心肌中,Circ-PALLD的表达水平明显升高(P<0.001,图5A),PALLD的表达水平明显降低(P<0.001,图5B)。

图5 衰竭心肌中PALLD与Circ-PALLD的表达水平Fig. 5 Expression levels of PALLD(A)and Circ-PALLD(B)in the failing myocardium.***P<0.001 vs Normol(n=8).
2.3 生物信息学寻找可能调控Circ-PALLD的转录因子
通过生物信息学分析出与Circ-PALLD具有相关性的转录因子有49个(图6)。在String网站检索以上49个转录因子可能的潜在相互作用,并构建了蛋白质相互作用网络(图7)。然后通过Cytoscape 进行Hub基因的筛选发现GATA4 具有最高的连接度,连接分数为4514784。
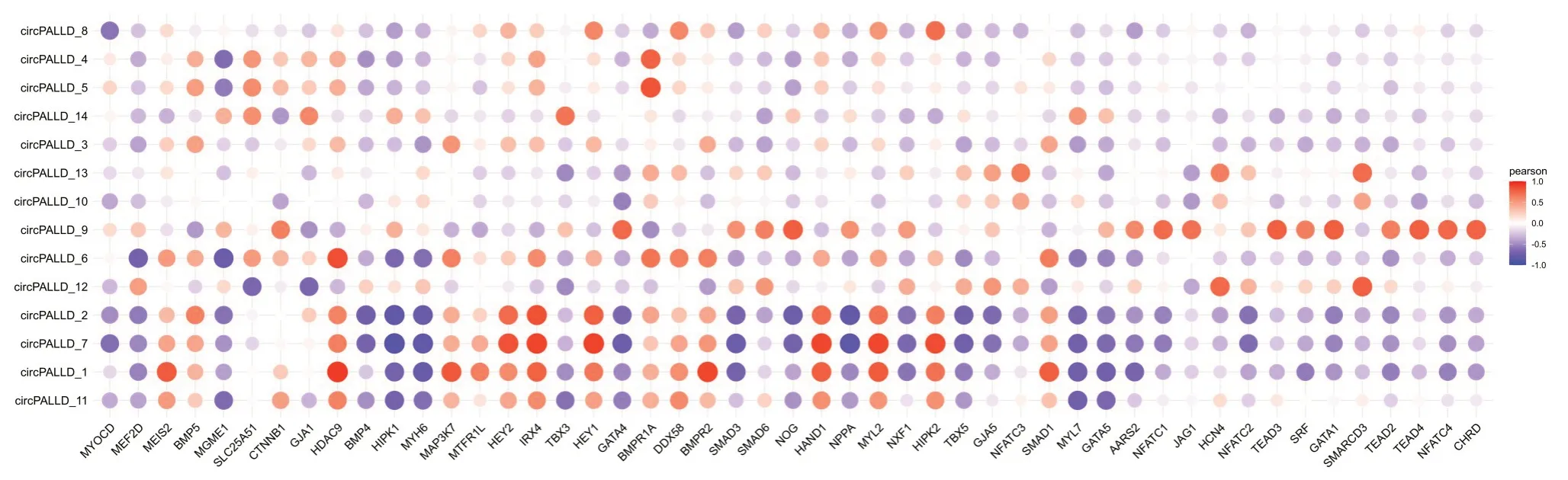
图6 Circ-PALLD与转录因子的生物信息学分析Fig. 6 Bioinformatic analysis of Circ-PALLD and its transcription factors.

图7 蛋白相互作用网络Fig. 7 Protein interaction network.
2.4 敲降转录因子GATA4后Circ-PALLD和PALLD的表达降低
qRT-PCR检测衰竭心肌组织中GATA4的表达后发现,GATA4在衰竭心肌组织中表达升高(P<0.001,图8A)。为探讨PALLD转录调控是否受GATA4的影响,将GATA4的siRNA转染入原代乳鼠心肌细胞,发现敲低GATA4 后(P<0.01,图8B),Circ-PALLD 和PALLD的表达均降低(P<0.05,图8C、D)。
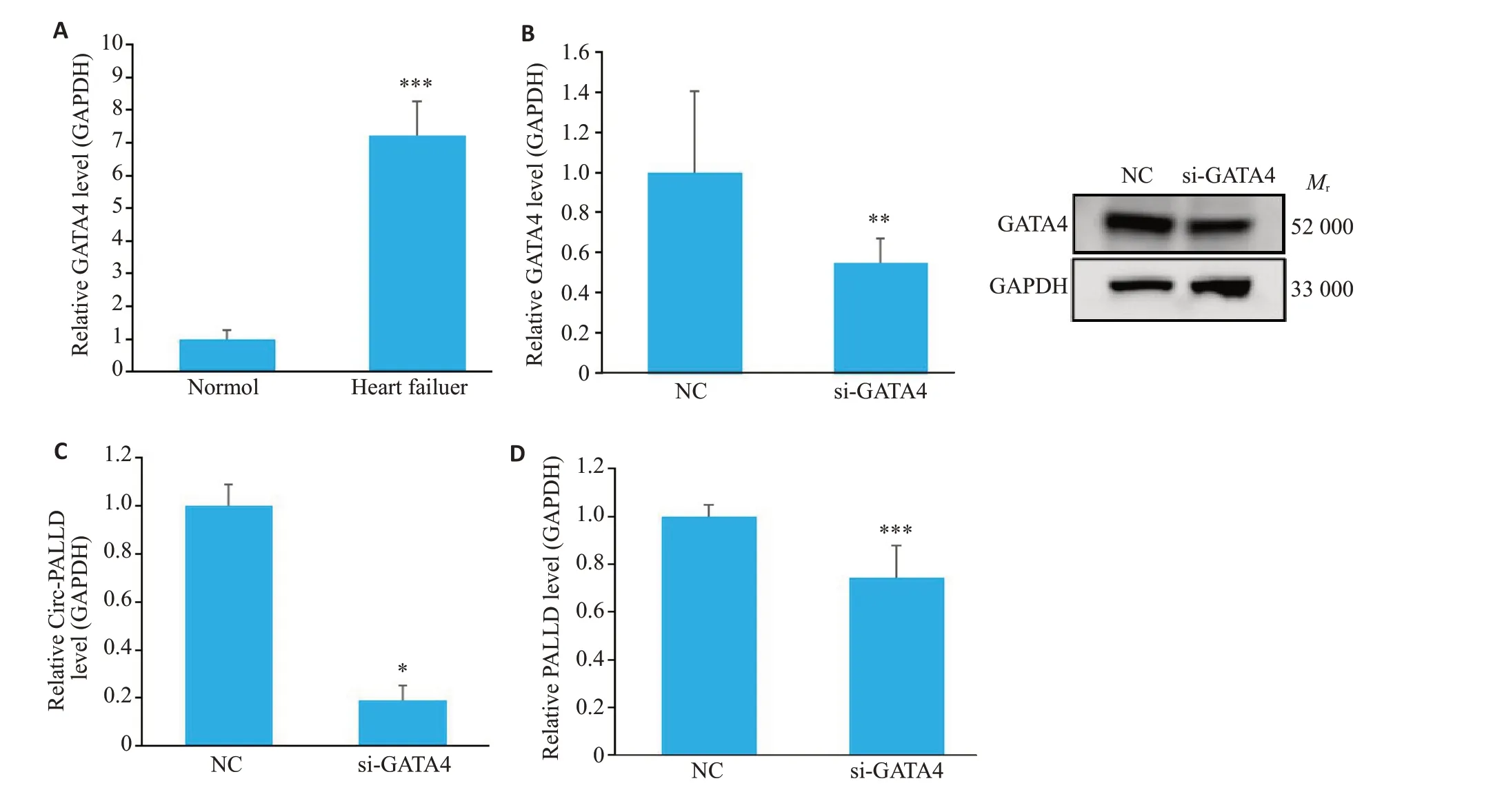
图8 敲降转录因子GATA4后线性PALLD和Circ-PALLD的表达降低Fig. 8 The transcription factor GATA4 regulates the transcription of Circ-PALLD. A: Expression of GATA4 in failing myocardium. B: GATA4 expression level after GATA4 knockdown. C: Expression level of PALLD after GATA4 knockdown.D:Expression levels of Circ-PALLD after GATA4 knockdown.*P<0.05,**P<0.01,***P<0.001vs NC/Normol(n=3).
3 讨论
越来越多的证据表明CircRNAs与多种心血管疾病的发病机制有关,在心血管疾病中发挥重要作用[13]。同时CircRNAs有多种成环方式,CircRNAs可以由外显子,内含子,外显子和内含子共同组成[12,14]。因此研究CircRNAs 的成环方式具有重要意义。本研究通过Sanger一代测序验证了Circ-VWA8、Circ-VMP1、Circ-PRDM5、Circ-PLCL2、Circ-PALLD、Circ-NFATC3、Circ-MLIP、Circ-FAM208A、Circ-ANKIB1、Circ-AGTPBP1 均是由外显子反向剪接成环的,为CircRNAs的研究提供了科学依据。
心力衰竭的主要病理生理改变是心脏重塑,主要由心肌细胞衰老、死亡,肌小节功能减退,内皮、血管功能受损,间质纤维化增加等导致[15]。目前临床上常用脑钠肽和N端脑钠肽前体作为评估心力衰竭危险分层及预后的生物标记物[16],但它们的血浆浓度个体差异较大,因此对心力衰竭的治疗指导作用有限[17]。近几年来,CircRNAs被证明与心血管疾病、糖尿病、神经系统疾病和癌症等疾病有关[18]。已有研究表明CircRNAs在心肌细胞损伤后修复、心肌细胞自噬与衰老、血管再生等方面发挥重要调节作用,从而进一步调节心脏重塑[19]。也有研究人员检测到心力衰竭患者血浆中存在大量显著差异表达的CircRNAs。这表明CircRNAs在诊断和治疗心力衰竭方面具有巨大潜力[20]。本研究通过琼脂糖凝胶电泳检测人衰竭心肌中CircRNAs与linear RNA的表达水平发现Circ-PALLD表达水平明显上调。因此Circ-PALLD 在心衰中或有重要作用,并且也可能是潜在的心衰生物标志物。
PALLD(Palladin)是一种广泛表达的肌动蛋白和捆绑蛋白,作为细胞骨架支架来捆绑肌动蛋白纤维和肌动蛋白交联剂,参与控制细胞形状,粘附和收缩[21]。有研究表明PALLD参与了血小板和动脉血栓的形成且与心肌梗死有关,是缺血性心肌病引起的心力衰竭潜在的生物标志物[22]。本研究通过RT-qPCR进一步检测发现Circ-PALLD仍在衰竭心肌表达升高,但PALLD在衰竭心肌中的表达水平却截然相反,这说明Circ-PALLD与PALLD在心血管疾病中的功能可能存在差异,因此我们分析,在衰竭心肌中表达升高的Circ-PALLD在心血管疾病中可能扮演重要角色。针对Circ-PALLD在心血管疾病中的功能目前并没有相关报道,因此我们的研究有望为心血管疾病的诊断和治疗提供新的思路。通过实验结果我们分析,在衰竭心肌中,Circ-PALLD的表达上调可能是PALLD的转录水平或者转录后水平受到影响。
研究报道心脏转录因子(TF)网络的调节是治疗干预心血管疾病的一种可行选择[23]。本研究通过生物信息学预测分析,转录因子GATA4具有调控基因PALLD转录的可能性。已有的研究表明,GATA4是心脏发育和肥大基因调节中必不可少的转录因子[24]。GATA4(GATA结合蛋白4)是一种含锌指的DNA结合转录因子[25],对小鼠和人类的正常心脏发育和稳态至关重要,并且在人类心脏缺陷中已经报道了该基因的突变[26]。本研究通过RT-qPCR发现转录因子GATA4在心衰组织中高表达,敲降GATA4后,Circ-PALLD与PALLD的表达水平明显降低。因此,在人心脏衰竭过程中基因PALLD 的转录确实可能受到转录因子GATA4 的影响。那么这种变化是否是由GATA4调控PALLD的转录引起,后续研究还需要进一步的实验来验证。但本研究发现在衰竭心肌中Circ-PALLD表达水平明显上升的同时PALLD表达水平却明显降低。因此,转录因子GATA4可以影响Circ-PALLD与PALLD的转录过程,但根据Circ-PALLD与PALLD在心衰组织中的表达水平分析,GATA4的转录调控作用并不是导致心衰的唯一的影响因素,其他因素在心衰中的作用可能高于转录在心衰中的影响。从CircRNAs的生物学发生方式上进一步分析,在人心脏衰竭过程中,是否也同样影响了基因PALLD的剪接修饰从而使Circ-PALLD表达水平升高,PALLD的表达水平降低[27]。
目前CircRNAs在心力衰竭中的研究大多是通过与miRNA的相互作用来探讨CircRNAs的下游功能[28,29],但CircRNAs的上游机制研究却很少[30]。我们的研究旨在筛选可能作为心力衰竭中生物诊断物和治疗靶点的候选CircRNAs分子,并着重研究CircRNAs的生物学发生过程,为心力衰竭的诊断治疗以及预后提供潜在的新的靶点,同时也加深对CircRNAs的了解。

