丹参新醌乙减轻ox-LDL 诱导的内皮细胞损伤:基于抑制NFκB/NLRP3信号通路介导的细胞焦亡
李洪涛,邓宇,王添乐,黄克勇,于传沛,陈朝俊
1广州中医药大学,广东 广州 510006;2连山县小三江镇中心卫生院,广东 清远 513224;3广州中医药大学附属广州中西医结合医院脑病科,广东 广州510800
动脉粥样硬化(AS)是大多数心肌梗死、卒中以及致残性外周动脉疾病的诱因,在世界范围内具有较高的发病率和死亡率[1]。内皮细胞炎症是AS始动因素和推动因素,表现为氧化低密度脂蛋白(ox-LDL)沉积、内皮细胞损伤以及血管壁上斑块的形成和堆积[2]。细胞焦亡是新近发现的由消皮素D(GSDMD)介导的一种炎症性程序性细胞死亡方式[3],与AS病理过程关系密切[4],而核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体激活下游的caspase家族是导致细胞焦亡的经典途径[5],其分子机制之一为caspase-1 激活,切割GSDMD使细胞膜完整性破坏,细胞破裂并释放IL-1β等炎症因子[6],引发AS并促进其发展。NF-κB是一个可诱导转录因子家族,也是已知的NLRP3主要激活因素,可提高NLRP3的mRNA表达水平,促进NLRP3炎症小体的合成,并推动其介导的细胞焦亡[7],NF-κB1(p50)是NF-κB家族的主要成员之一。相关研究表明,ox-LDL可通过NF-κB信号通路,激活NLRP3炎症小体,导致caspase-1前体被活化并促进IL-1β分泌[8],引发细胞焦亡,加剧炎症反应,导致AS的发生和进展。
AS可归属于中医“脉痹”、“胸痹”、“中风”等范畴[9],以元气亏虚为本,病邪内生为标。元气亏虚,运转无力而气机壅滞,气虚无法助血运,则血停而为瘀,形成“气虚-气滞-血瘀”的病理过程,而血脉不通、停而为瘀是AS核心病机,“瘀久化热,酝酿成毒”形成的“瘀毒互结”是AS产生及斑块破裂的关键[10]。广东省名中医陈朝俊教授针对AS“因虚而滞,因滞而瘀”特点所研制的中成药“参七脉心通胶囊”具有良好的抗AS作用[11],前期研究表明其作用机制可能与干预NF-κB有关[12]。丹参是其主要药物组成之一[13],味苦能泄,性寒能除热,具有“活血,祛瘀,凉血”等作用[14],《重庆堂随笔》谓之“降而行血,血热而滞者宜之”[15],《本草汇言》亦称其“善治血分,去滞生新”[16],切中AS“瘀久化热,瘀毒互结”的关键病机。丹参及其制剂现已在抗AS、抗肿瘤及治疗脑卒中、冠心病、心绞痛等方面广泛应用[17]。丹参新醌乙是丹参二萜醌类有效成分[18],已有研究表明该类成分具有免疫调节、抗炎、抗肿瘤等作用[19],而相关体外实验已证实丹参新醌乙对NF-κB通路具有抑制作用[20],但其下游反应涉及的相关因子及机制尚不明确。此外,国内外尚缺乏关于丹参新醌乙抗AS及其作用机制的相关研究。基于此,本研究拟从NF-κB/NLRP3信号通路入手,探讨丹参新醌乙对ox-LDL诱导内皮细胞损伤的影响并从体外水平分析其抗AS的可能机制,以期为药物的开发和应用提供实验基础。
1 材料和方法
1.1 细胞和试剂
人脐静脉内皮细胞(HUVECs),由广州合创生物提供。
丹参新醌乙(Biopurify);ox-LDL(翊圣生物);胎牛血清、Ham's F-12K(Kaighn's)培养基、PBS磷酸钾缓冲液、青链霉素(Hyclone);肝素(北京索莱宝);牛内皮细胞促分裂剂(ECGS Bovine)(Adooq);总RNA抽提试剂(Trizol)(Invitrogen);引物由上海生工定制合成;PrimeScript II 1st Strand cDNA Synthesis Kit、TB Green®Premix Ex Taq™(Tli RNaseH Plus)(Takara);极超敏ECL化学发光试剂盒、CCK-8溶液(碧云天);LDH测试盒(南京建成);Rabbit Anti-Mouse IgG(H+L)(1∶4000)、Goat Anti-Rabbit IgG (H+L)(1∶5000)(southern biotec);peroxidase-Rabbit Anti-Goat IgG (1∶3000)、peroxidase-Rabbit Anti-Rat IgG(1∶2000)(武汉博士德);Anti-beta-Actin antibody (1∶10000)、Anti-NLRP3 antibody(1∶1000)、Anti-IL-1β antibody(1∶1000)、Anti-NFκB p105/p50 antibody(1∶1000)(Bioss);蛋白marker(Thermo);Anti-cleaved N-terminal GSDMD antibody(1∶1000) (Abcam);Anti-Cleaved caspase-1 antibody(1∶1000)(Cell Signaling);GSDMD 抗 体-N-terminal(Affinity)。
1.2 仪器
洁净工作台(苏州安泰);低速离心机(中科中佳);倒置光学显微镜(OLYMPUS);细胞恒温培养箱(Thermo scientific);酶标仪(Thermo Fisher Scientific);分析天平(德国赛多利斯);控温磁力搅拌器(金坛市医疗仪器厂);凝胶成像系统、电泳仪(Bio-Rad);高速冷冻离心机(SIGMA);旋涡混合器(海门其林贝尔);电热恒温水槽(上海一恒);Real Time PCR仪(ABI);垂直电泳槽、转移电泳槽、电泳仪、半干转移电泳槽、显影仪(上海天能);台式高速冷冻离心机(上海天美);核酸蛋白检测仪(上海嘉鹏)。
1.3 HUVECs的培养
取出复苏细胞培养瓶,吸掉旧培养液,离心收集细胞,用PBS洗涤细胞2次,加入trypsin-EDTA溶液(1 mL/25 cm2,2 mL/75 cm2),吹打散细胞,加入适量含血清之新鲜培养基终止trypsin作用,然后离心收集细胞。以吸管上下吸放数次以打散细胞团块,混和均匀后,补足3n(n为传代瓶数)mL培养基,依稀释比例转移至新的培养瓶中,放入培养条件为5%CO2、饱和湿度、37 ℃的CO2培养箱。
1.4 CCK-8法筛选最佳药物浓度及作用时间
用DMSO 溶解药物,配成5 mg/mL母液,微孔过滤,-20 ℃长期保存,加药时现用现配。取对数生长期HUVECs,消化细胞后吹打散细胞,计数,调整细胞浓度为1×105/mL,分到96孔板,1×104/孔,待细胞贴壁后,分为处理组(分别加入50、100、500、1000、2000ng/mL丹参新醌乙)和对照组(一组不进行处理,另一组加入DMSO),恒温37℃,5%CO2培养24、48、72 h,收集各个时间点的细胞按1∶10比例加入CCK-8溶液,孵育2 h后,酶标仪读板,CCK-8检测读取A450nm数据。
结果显示不同浓度丹参新醌乙对HUVECs 处理48 h有微弱的增殖抑制作用,处理72 h后增殖抑制有较明显的增强并有一定剂量效应;而处理24 h的分组中,不同浓度丹参新醌乙对细胞无明显的增殖抑制作用,故选择100 ng/mL,处理24 h作为后续实验的条件。同时设置以DMSO处理的HUVECs作对照。
1.5 造模与分组
取HUVECs分为4组;正常组,ox-LDL组、二甲基亚砜(DMSO)组和丹参新醌乙组。干预方式如下:正常组为HUVECs加入10%胎牛血清,ox-LDL组在正常组基础上加入100 μg/mL(浓度选择参考既往相关研究[21]的结果)的ox-LDL构建内皮细胞损伤模型,DMSO组在ox-LDL组基础上加入0.1%浓度药物溶剂DMSO,丹参新醌乙组在ox-LDL组基础上分别加入用DMSO溶解的100 ng/mL浓度丹参新醌乙,置于条件为37 ℃、5%CO2的培养箱中培养24 h进行后续实验。
1.6 检测指标
1.6.1 微板法检测乳酸脱氢酶(LDH)水平 取HUVECs在6孔板接种2×105/孔,在条件为37 ℃、5%CO2培养箱中孵育24 h后,分别按上述各组干预方式进行处理,每组设置3个复孔,培养箱中培养24 h后,收集细胞上清液,根据乳酸脱氢酶(LDH)试剂盒说明书进行操作。实验重复3次,取平均值。
1.6.2 qRT-PCR 法检测NF-κB1、NLRP3、GSDMD、IL-1β的mRNA表达 按每个培养皿5×107个将HUVECs接种于直径为6 cm的培养皿中,分别按上述各组干预方式进行处理,培养24 h后,按照总RNA 抽提试剂Trizol 说明书操作,提取各组细胞总RNA,按照PrimeScript II 1st Strand cDNA Synthesis Kit试剂盒说明逆转录成cDNA,采用Primer 3.0设计RT-PCR引物,引物序列见表1,引物序列经NCBI nBlast比对无非特异性扩增,进行反应体系的配制,反应参数参考TB Green®Premix Ex Taq™(Tli RNaseH Plus)试剂盒说明进行,RT-PCR的扩增曲线和融解曲线应用ABI VII a7 Real-Time PCR System 的操作方法进行,对NF-κB1、NLRP3、GSDMD、IL-1β的基因进行扩增,以GAPDH为内参,以2-ΔΔCt计算NF-κB1、NLRP3、GSDMD、IL-1β的mRNA相对表达量。
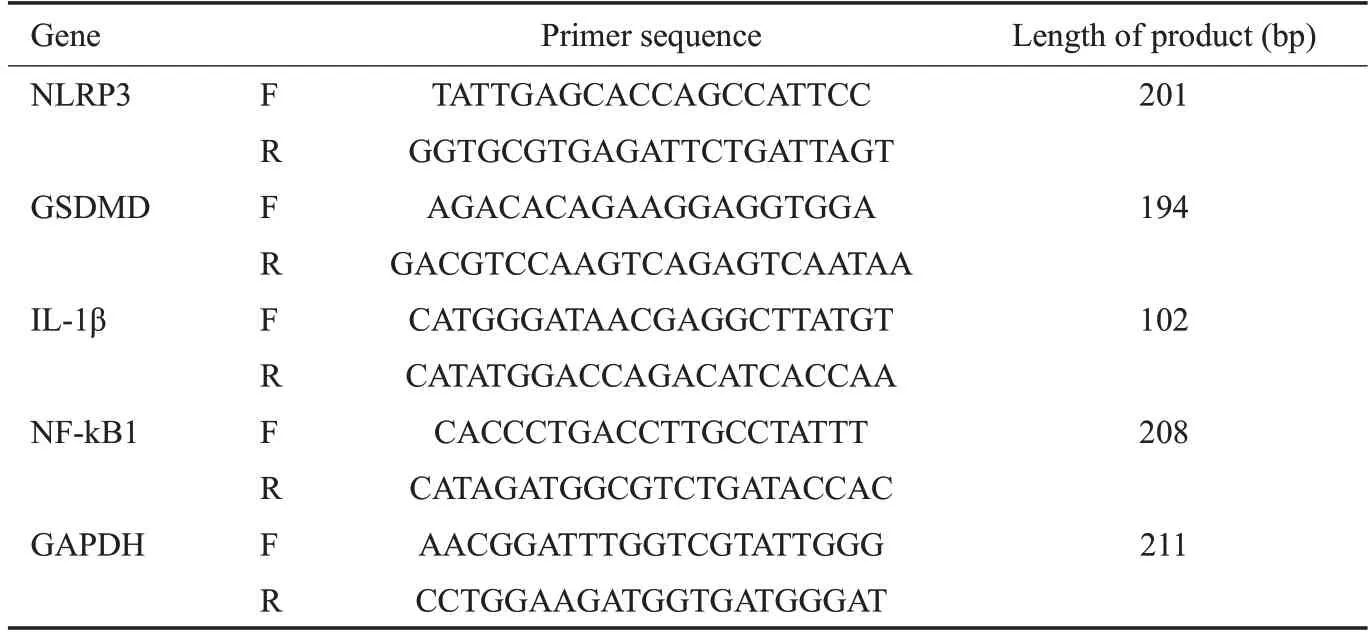
表1 RT-PCR各基因所用引物序列及产物片段Tab.1 Primer sequences for RT-PCR and the product length
1.6.3 Western blot 检测NF-κB1、NLRP3、caspase-1、GSDMD-N的蛋白表达 在6孔板上接种HUVECs,待覆盖率达到80%~90%时对各组进行相应干预并培养24 h,后取样品1000 r/min离心10 min,弃培养液,PBS洗涤,再1000 r/min 离心5 min 后弃上清,PBS 洗涤,1000 r/min离心5 min后吸去PBS溶液,加入提取缓冲液以4 ℃轻摇15 min,收集裂解液以14 000 r/min离心15 min后取上清,以BCA法测量蛋白浓度。按2∶1加入上样缓冲液充分混合,煮沸变性5 min,冻存备用,参照说明书进行SDS-PAGE电泳(80 V恒压50 min,120 V恒压电泳至溴酚蓝刚出胶底部),将凝胶上蛋白转至PVDF膜,以5%脱脂奶粉溶液37 ℃封闭1 h,封闭结束后以TBST洗膜3次,每次5 min,1∶1000稀释比例一抗4 ℃孵育过夜,洗膜,二抗稀释液37 ℃孵育1 h,洗膜,蒸馏水漂洗膜2 min,弃去液体,共洗3次,后将杂交膜置于一透明塑料板上,用干移液器将化学荧光发光底物均匀地加到膜的表面,使反应持续5 min,滤纸吸去膜表面多余底物溶液,放至暗盒,最后进行显影。
1.6.4 免疫荧光法观察GSDMD表达 在24孔板上按2×104/孔接种HUVECs,同上方法处理后,吸除废液,PBS 洗涤2次,通透,封闭。加入一抗4 ℃孵育过夜,PBS洗3次,每次5 min。标记二抗(GSDMD抗体-Nterminal,以1∶200 比例稀释),37 ℃孵育1 h,PBS 洗3次,每次5 min。滴入DAPI,孵育15 min,PBS漂洗后加入防荧光淬灭剂,封片,最后用荧光显微镜获取图像。
1.7 统计学处理
运用SPSS25.0软件对实验数据进行处理及分析。计量数据以均数±标准差表示,两组间Western blot灰度值统计比较采用配对样本t检验,其余两组间比较使用独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组LDH水平比较
与正常组比较,ox-LDL组、DMSO组LDH浓度水平明显增加(P<0.01);与ox-LDL组、DMSO组比较,丹参新醌乙组LDH浓度水平显著下降(P<0.05,图1)。
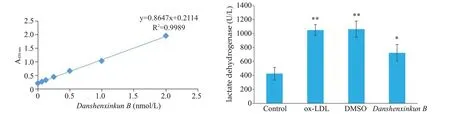
图1 LDH浓度比较Fig. 1 Comparison of lactate dehydrogenase concentration in the supernatant of human umbilical vein endothelial cells(HUVECs)among the groups.A:Standard curve of sodium pyruvate.B:Comparison of lactate dehydrogenase concentration.**P<0.01,*P<0.05 vs control group.
2.2 NF-κB1、NLRP3、GSDMD、IL-1β的mRNA 表达比较(图2)
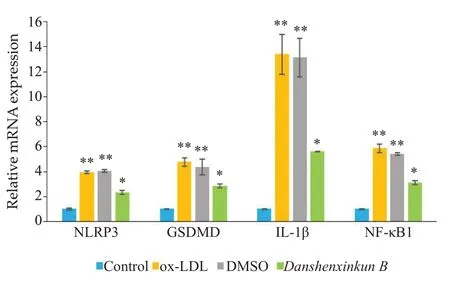
图2 各组NF-κB1、NLRP3、GSDMD、IL-1β的mRNA表达水平比较Fig. 2 Comparison of NF-κB1,NLRP3,GSDMD and IL-1β mRNA expression levels among the groups.**P<0.01,*P<0.05 vs control group.
与正常组比较,ox-LDL 组、DMSO 组NF-κB1、NLRP3、GSDMD、IL-1β的mRNA 水平均有显著上调(P<0.01);与ox-LDL组、DMSO组比较,丹参新醌乙组NF-κB1、NLRP3、GSDMD、IL-1β的mRNA水平均有显著下调(P<0.01)。
2.3 NF-κB1、NLRP3、caspase-1、GSDMD-N、IL-1β的蛋白表达水平比较
Western Blot 法检测各组细胞NF-κB1、NLRP3、caspase-1、GSDMD-N、IL-1β的蛋白表达差异,对各蛋白平均灰度值进行半定量分析,结果(图3)显示:与正常组比较,ox-LDL 组、DMSO 组NF-κB1、NLRP3、caspase-1、GSDMD-N、IL-1β的蛋白表达水平明显升高(P<0.01);与ox-LDL组、DMSO组比较,丹参新醌乙组NF-κB1、NLRP3、caspase-1、GSDMD-N、IL-1β的蛋白水平显著下调(P<0.01)。
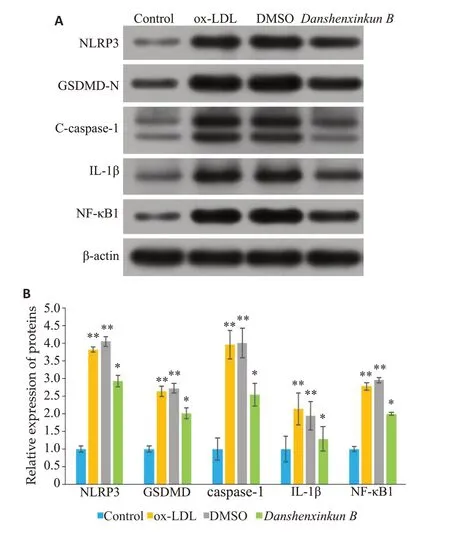
图3 NLRP3、GSDMD-N、caspase-1、IL-1β、NF-κB1蛋白表达水平比较Fig. 3 Protein expression levels in each group. A:Western blot of NLRP3,GSDMD-N,caspase-1,IL-1β and NF-κB1 proteins. B: Relative expressions of these proteins.**P<0.01,*P<0.05 vs control group.
2.4 细胞免疫荧光及GSDMD表达
经ox-LDL处理后,GSDMD表达水平明显上升,免疫荧光图片表明ox-LDL处理的GSDMD有侵犯细胞质的表现,且有明显入核蛋白出现。而经丹参新醌乙处理后,GSDMD整体表达水平明显下降,在细胞质中的表达下降,提示丹参新醌乙可有效限制GSDMD的表达,减轻细胞形态破坏(图4)。

图4 GSDMD表达和定位的免疫荧光染色Fig. 4 Immunofluorescence staining for observing gaselermin D (GSDMD) expression and localization (Original magnification:×400).
3 讨论
血管内皮细胞损伤被认为是AS发生的始动因素,而炎症反应在其中发挥重要作用,促炎因子的产生加剧AS的进程,导致斑块增厚、破裂、积聚、血栓形成,从而引起急性心脑血管疾病[22]。在这一过程中,ox-LDL通过刺激内皮细胞释放单核细胞趋化蛋白-1促进单核细胞对内皮黏附,同时促进内皮细胞活性氧的生成使促炎相关基因表达增加并加剧炎症反应,导致内皮细胞损伤[23]。GSDMD是介导细胞焦亡关键蛋白,其受到活化后可分解成N端(GSDMD-N)和C端(GSDMD-C),GSDMD-N可与细胞膜上的磷脂蛋白结合,发生多聚化并在细胞质膜上形成孔洞,细胞质膜遭受破坏,从而诱导细胞焦亡的发生[24]。我们使用ox-LDL对HUVECs进行处理,以LDH作为HUVECs损害的标志产物[25],并以免疫荧光标记及观察,结果表明ox-LDL处理可导致HUVECs损伤,且GSDMD在细胞质高表达并具有入核表现,与上述结论一致。而经过丹参新醌乙处理后HUVECs损伤明显减少,且能抑制GSDMD表达,其作用机制值得进一步探究。
转录因子NF-κB在细胞免疫、炎症、焦亡等过程起着至关重要的作用[26],其家族成员NF-κB1在通常情况下被前体蛋白p105隔离而稳定在细胞质中。稳定结构破坏后,NF-κB1可转移至细胞核中启动相关基因的表达,使NF-κB信号通路活化[27]。无活性的NLPR3受到引爆或启动信号的激活而发生寡聚化,继而组装成NLPR3炎症小体[28],同时触发procaspase-1向caspase-1的转化以及成熟IL-1β的分泌[29,30],裂解GSDMD并将其切割成GSDMD-N和GSDMD-C,成熟的IL-1β等可通过GSDMD-N形成的跨膜孔隙释放到胞外并造成炎症恶化[31],导致细胞焦亡的发生。本研究中,经ox-LDL处理后NF-κB1的mRNA及蛋白表达均明显升高,证实了ox-LDL能破坏其与前体蛋白组成的稳定结构,NLPR3表达提高,且表明NF-κB 信号具有活化NLPR3 促进NLPR3炎症小体生成的作用。NF-κB/NLPR3通路激活后,损伤的HUVECs中caspase-1、IL-1β、GSDMD-N表达均明显升高,表明ox-LDL可诱发NF-κB/NLPR3活化后引起的级联反应引起细胞焦亡。经丹参新醌乙处理后,NF-κB1表达作用被抑制,GSDMD表达下降,质膜成孔及入核表现抑制,细胞完整性得到保护,提示丹参新醌乙具有保护NF-κB稳定结构及抑制GSDMD表达的作用,且通过阻止NF-κB/NLPR3信号通路的激活,抑制NLPR3活化,干预NLPR3炎症小体的形成,抑制GSDMD裂解,阻止后续级联事件的发生,从而抑制细胞焦亡反应。
相关研究表明,NF-κB信号通路激活导致血管壁损伤是斑块形成的重要原因[32],NLRP3的活化及NLRP3炎症小体的合成促使炎症发生和加剧是影响AS发生和发展的重要因素[33],而通过降低caspase-1的水平,减少IL-1β的生成,可以抑制细胞炎症反应从而减缓AS的发展[34,35]。本研究中,丹参新醌乙组处理后,NF-κB1、NLPR3 及后续反应产物caspase-1、IL-1β、GSDMD-N的表达均受到抑制,提示丹参新醌乙可通过干预NFκB/NLRP3通路发挥抗AS作用。此外,本研究设置药物溶剂DMSO组作为对照,结果表明实验结论不受药物溶剂DMSO影响。
中医药虽无AS之病名,但由于其可辨证不辨病的独特诊治方式,在数千年临床实践中留下了宝贵的抗AS经验。AS的形成是以气虚为始动因素,无力推动津血运行从而形成痰瘀,痰瘀胶结于脉壁,在时间推移下酝酿成毒从而使脉壁损害[36]。近年来研究发现中药或制剂在调节内皮功能、炎症反应、脂质代谢及肠道微生物等方面发挥积极的抗AS作用[37],表明中药成分在该领域具有深入研究的价值和广阔的前景,而丹参是其中的代表之一。张净生采用丹参生脉饮治疗冠心病取得显著疗效,其有效成分丹参酮、丹参素被证实能调节血脂并抑制炎症[38]。目前丹参酮ⅡA、丹酚酸B等有效成分均被证实具有调节信号通路、抗炎、免疫调节的作用[39,40],提示了丹参“活血化瘀”的作用可能干预以“瘀”为主要病机的AS,我们选取了既往鲜有报道的二萜醌类成分丹参新醌乙作为研究药物,证实了其具有可靠的改善内皮细胞损伤作用,可能为活血化瘀类药物成分抗AS研究提供依据。
综上,丹参新醌乙对ox-LDL诱导的HUVECs损伤具有保护作用,其机制可能与抑制NF-κB/NLRP3信号通路,下调caspase-1、IL-1β、GSDMD-N的表达,减轻其介导的炎症反应,抑制细胞焦亡有关。提示丹参新醌乙具有较好的药用价值,有望作为内皮细胞损伤保护剂进行开发和利用,其抗HUVECs损伤作用可能为抗AS药物的研发及其相关临床应用提供实验支撑。然而,NLRP3炎症小体的产生及其介导的细胞焦亡反应极其复杂,本研究未能明确其中是否涉及其他反应,尚需在后续研究中深入探讨。

