锰基纳米材料用于胃肠道恶性肿瘤的化学动力治疗
林晓丰,黄马养,陈君千,周逊,钟卓丹,陆文聪,黄显莹,刘添文
1广州中医药大学第二附属医院脾胃病科,广东 广州 510515;2广东省妇幼保健院儿科,广东 广州 510515;3南方医科大学南方医院血管介入科,广东广州510515
恶性肿瘤已成为大多数患者死亡的主要原因,其中结直肠癌和胃癌的死亡率居全世界第2和第3位[1-3],目前根治性手术切除仍是胃肠道恶性肿瘤患者治愈的唯一机会,据报道约50%的患者术后5年内复发,且中晚期胃肠道恶性肿瘤患者的复发率更高[4,5]。多项研究证实,对于晚期肿瘤或肿瘤术后复发转移患者,一线、二线化疗为最佳支持治疗,可延长中位生存时间,提高生活质量[6-9]。针对此类患者而言,2020年美国国立综合癌症网络、欧洲肿瘤协会以及中国卫生部均推荐铂类联合氟尿嘧啶类药物作为一线治疗药物。尽管其研究工作取得了重大的进展,但此类治疗药物选择仍然有限,且毒副作用严重[10,11]。因此,寻找一种既能提高疗效又能避免传统辅助化疗毒副作用的新治疗方案是突破目前突破胃肠道恶性肿瘤治疗瓶颈的关键。
化学动力治疗(CDT)是利用金属催化剂在肿瘤缺氧微环境下,将细胞内过表达H2O2转化为高毒性羟基自由基(·OH),在不需要外界刺激的情况下引起肿瘤细胞严重的氧化损伤[12]。与其他治疗方式相比,CDT由肿瘤微环境特异性触发,能够有效减少对体内正常组织的损伤[13]。另外,CDT与化疗联合具有显著的协同作用,一方面可以通过化疗药物增加H2O2浓度,使CDT治疗效果增强,另一方面可以减少化疗药物的副作用,因此,CDT与化疗相结合有望成为一种新型、有效的胃肠道恶性肿瘤治疗方案[14,15]。而作为化学动力试剂的锰基金属纳米材料,如MnO、MnO2、MnSiO3、MnS等,适合在肿瘤组织的微酸性(pH 4.5~6.5)环境中催化类芬顿反应,从而重塑肿瘤微环境,诱导肿瘤细胞死亡,因而在肿瘤治疗中极具潜力。一般情况下,被动的锰基纳米药物疗效差、副作用大。因此,需要赋予纳米药物具备主动递送能力及催化属性来促进肿瘤细胞内摄取并提高类芬顿催化效率,进而强化CDT作用。基于此,本研究制备了一种新型的纳米材料,即携载葡萄糖氧化酶的富含锰介孔二氧化硅(MSN@Mn-GOx),探索了其物化表征以及在胃肠癌细胞系中的抗肿瘤效应,以证实该材料是否能够用于胃肠道恶性肿瘤的CDT。
1 材料和方法
1.1 MSN@Mn-GOx的合成
首先,将2 g 十六烷基三甲基氯化铵(CTAC)与0.02 g三乙胺(TEA)混合,加入20 mL ddH2O,在80 ℃下搅拌20 min 进行预热。加入1.5 mL 正硅酸乙酯(TEOS)并在80 ℃下搅拌4 h。离心后,分别用乙醇和ddH2O洗3次。然后将产物溶于20%盐酸,75 ℃洗涤12 h,洗涤3次,除掉CTAC。其次,10 mL得到的纯净MSN 溶液加入10 mL MnSO4·H2O(8 mg/mL),搅拌20 min,然后将混合物转移至高温反应器中(180 ℃12 h),将所得产物ddH2O洗涤3次,得到MSN@Mn纳米。将GOx(1 mg/mL)添加到MSN@Mn纳米溶液中,室温避光搅拌4 h,得到MSN@Mn-GOx纳米颗粒。
1.2 MSN@Mn-GOx的形态大小
将MSN@Mn-GOx 纳米颗粒稀释并滴加到镍网上,使用JEM-2100F透射电子显微镜(日本JEOL)拍摄MSN@Mn-GOx的表面形态。利用动态光散射原理测定MSN@Mn和MSN@Mn-GOx纳米颗粒的粒径和电势。用能源分析EDS分析纳米元素种类。用电感耦合等离子体质谱分析仪ICP 分析纳米复合物中锰的含量。用光电子能谱仪XPS分析纳米复合物中锰的价态。
1.3 MSN@Mn-GOx的化学动力效能
采亚甲基蓝(MB)评估MSN@Mn-GOx的化学动力效能,即类芬顿催化能力。MSN@Mn-GOx与不同pH的PBS(pH=6.0和pH=7.5)孵育后,采用分光光度计检测各组溶液在λ=664 nm的吸光度。
1.4 MSN@Mn-GOx的氧气消耗水平
MSN@Mn-GOx与含/不含葡萄糖的含氧溶液中进行孵育,使用溶解氧仪(Thermo)检测不同时间点溶液中的氧含量。
1.5 MSN@Mn-GOx的核磁成像(MRI)能力
雌性裸鼠(4~5周龄)购自南方医科大学实验动物中心。将肠癌细胞(HT-29)以5×106/200 μL的密度注射到雌性裸鼠的右背部,构建荷瘤小鼠肠癌模型。当荷瘤小鼠肿瘤体积超过20 mm×20 mm×20 mm时,在麻醉下将MSN@Mn-GOx纳米颗粒(6 mg/kg)经尾静脉注射到荷瘤小鼠体内。使用7.0 T MAGNETOM Skyra 磁共振成像系统(Philips)对不同浓度的MSN@Mn-GOx纳米颗粒溶液(50、100、150、200、250 μg/mL)和注射MSN@Mn-GOx纳米颗粒前后的小鼠进行T1加权序列扫描,获得MRI成像图片。
1.6 细胞培养
胃肠癌细胞(AGS和HT-29)购自中科院上海细胞库,使用含10%胎牛血清的DMEM培养基、置于37 ℃5%CO2培养箱中进行培养。每24 h更换1次培养基,细胞密度超过70%时,以0.25%胰酶消化进行传代培养。
取对数生长期的胃肠癌细胞进行体外实验,实验分为Control组(PBS)、MSN@Mn组(20 μg/mL MSN@Mn纳米颗粒)和MSN@Mn-GOx组(20 μg/mL MSN@Mn-GOx纳米颗粒)。
1.7 激光共聚焦实验
胃肠癌细胞(AGS和HT-29)按10 000/孔接种于共聚焦培养皿,细胞贴壁后分别加入MSN@Mn 和MSN@Mn-GOx纳米颗粒(均为20 μg/mL),常规培养24 h后按照检测试剂盒说明书加入DCFH-DA绿色荧光探针,37 ℃避光孵育30 min,加入含DAPI的抗荧光淬灭封片液,激光共聚焦显微镜(Olympus)下观察细胞内的荧光强度。
1.8 CCK-8细胞毒性实验
胃肠癌细胞(AGS和HT-29)按1000/孔接种于96孔板,细胞贴壁后分别加入不同浓度的MSN@Mn和MSN@Mn-GOx纳米颗粒(均为0、2、4、16、25、50 μg/mL)并继续培养24 h,加入10 μL CCK-8试剂,37 ℃孵育2 h,酶标仪设置450 nm波长测定吸光度A450nm。
1.9 Edu细胞增殖实验
胃肠癌细胞(AGS和HT-29)按10 000/孔接种于共聚焦培养皿,细胞贴壁后分别加入MSN@Mn 和MSN@Mn-GOx纳米颗粒(均为20 μg/mL),常规培养24 h 后加入含10 μmol/L EdU 染液,继续孵育2 h;EdU 标记细胞完成后加入1 mL 4%多聚甲醛室温固定30 min;继续加入0.5%Triton X-100孵育10 min,最后加入DAPI染液,室温避光孵育10 min,激光共聚焦显微镜下观察细胞内的荧光强度。
1.10 统计学分析
所有数据均采用IBM SPSS 20.0处理。计量资料以均数±标准差表示,两组间数据比较采用t检验,多组间数据比较采用单因素方差分析,组间数据比较采用LSD-t检验。以α=0.05为检验水准,对以上结果均进行双侧检验,P<0.05为差异具有统计学意义。
2 结果
2.1 MSN@Mn-GOx的理化特征
透射电镜图显示(图1A、B),MSN@Mn 及MSN@Mn-GOx纳米颗粒均为直径约100 nm的实心圆球。透射电镜下的EDS 能谱分析结果显示:MSN@Mn-GOx 纳米复以硅(Si)及锰(Mn)元素为主(图1C)。电感耦合等离子体质谱分析仪ICP分析结果显示:MSN@Mn-GOx中锰的含量约为25%。光电子能谱仪XPS分析结果显示:MSN@Mn-GOx在641.37 eV和653.26 eV处有归属于Mn 2p3/2和Mn 2p1/2的特殊吸收峰,MSN@Mn-GOx纳米复合物大部分为二价态的Mn (II)(图1D)。马尔文粒径仪测定显示,MSN@Mn及MSN@Mn-GOx纳米颗粒的水合平均粒径均约为100 nm(图1E),平均Zeta电位分别为-32 mV及-35 mV(图1F)。
2.2 MSN@Mn-GOx的类芬顿催化能力
同样H2O2浓度的条件下,不同pH 溶液的MSN@Mn-GOx展示出不同的吸光度。相比于pH=7.4的Control组,pH=7.4的溶液中加入MSN@Mn-GOx纳米颗粒后其吸光度明显下降,而加入MSN@Mn-GOx纳米颗粒的pH=6.0 溶液,其吸光度进一步下降(P<0.05,图2A)。氧消耗实验显示:MSN@Mn-GOx与葡萄糖混合后,培养液中溶解的氧气水平随着时间的延长而降低(图2B)。
2.3 MSN@Mn-GOx的核磁成像能力
MRI成像结果显示:相比于Control组,MSN@Mn-GOx组可显示出更强的T1加权核磁成像信号值,且随着浓度的升高,其T1信号值越强(图3A)。活体成像数据可看出:相比于注射MSN@Mn-GOx纳米颗粒前的图片,注射MSN@Mn-GOx纳米颗粒4 h后的裸鼠肿瘤部位有明显的T1增强信号(P<0.01,图3B)。
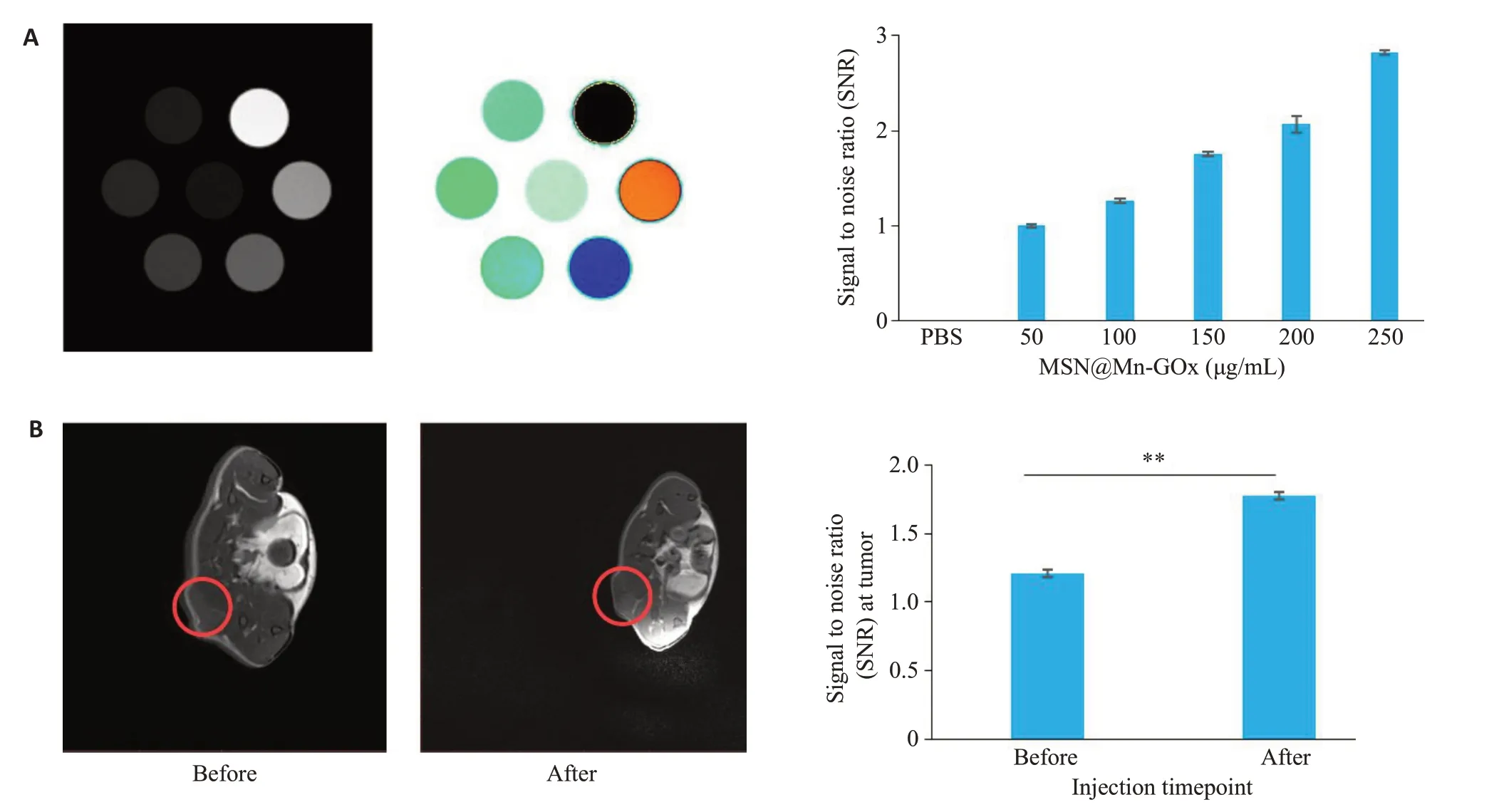
图3 MSN@Mn-GOx的核磁成像能力Fig. 3 MRI capability of MSN@Mn-GOx.A:MRI and SNR quantitative analysis of different concentration of MSN@Mn-GOx.B:MRI and SNR quantitative analysis of tumor-bearing mice treated with MSN@Mn-GOx.**P<0.01.
2.4 MSN@Mn-GOx产生ROS的能力
激光共聚焦图片分析显示:相比于Control组,MSN@Mn及MSN@Mn-GOx组能增加胃肠癌细胞内的活性氧(ROS)水平;相比于MSN@Mn组,MSN@Mn-GOx组处理产生的ROS水平明显增加(图4)。
2.5 MSN@Mn-GOx的肿瘤杀伤能力
CCK-8 细胞毒性实验结果显示,不同浓度MSN@Mn及MSN@Mn-GOx纳米颗粒(0、2、4、16、25、50 μg/mL)处理的胃肠癌细胞存活率呈浓度依赖性降低,具有显著的抗增殖作用;与相同浓度的MSN@Mn相比,MSN@Mn-GOx处理的细胞存活率更低下(P<0.05,图5)。

图5 MSN@Mn-GOx对胃肠癌细胞生长活力的影响Fig. 5 Effects of MSN@Mn-GOx on viability ofAGS and HT-29 cells.*P<0.05.
EdU实验结果显示,相比于Control组,MSN@Mn及MSN@Mn-GOx组能显著减少胃肠癌细胞内的EdU荧光阳性率;MSN@Mn-GOx组细胞EdU荧光阳性率较MSN@Mn组降低(图6)。
3 讨论
胃肠道恶性肿瘤是较常见的消化道恶性肿瘤之一[3]。目前,进展期胃肠道恶性肿瘤患者的治疗主要以根治性切除联合术后辅助化疗为主。但传统化疗药物容易引发脱发、恶心呕吐、骨髓抑制等全身多系统毒副作用,也易造成化疗耐药,一定程度上限制了该类药物的临床应用。近年来,光动力疗法(PDT)、光热疗法(PTT)、和化学动力疗法(CDT)等新的肿瘤治疗策略正在积极开发和探索。其中,CDT是一种基于芬顿化学原理的有效抗肿瘤策略,因其独特的活性氧(ROS)生成方式而受到广泛关注[13,16]。各种化学动力试剂金属离子的纳米材料已经被开发,例如Fe2+、Cu+、Co2+、Mn2+、Ti3+等[17-19]。本研究以介孔二氧化硅(MSN)为载体,成功制备了含有Mn2+的纳米载药复合物MSN@Mn-GOx,该材料充分发挥了MSN载药量高、毒性低的优点,借助Mn2+及GOx的偶联,实现了强大的芬顿催化效应;同时,体外细胞实验表明,MSN@Mn-GOx对胃肠癌细胞的增殖特性具有显著抑制作用,展现出高效的抗肿瘤作用。
铁基材料是以往研究最广泛的CDT 纳米催化剂[20]。然而,近年来的研究表明,Mn2+介导的类芬顿反应比Fe2+介导的芬顿反应具有更高的催化活性,特别是在接近中性的微酸性环境中[21-23]。因此,锰基纳米材料也被开发用于CDT,例如有研究报道了用于CDT 和PDT的H-MnCO3/Ce6-PEG多功能纳米颗粒,Mn2+可在肿瘤微环境弱酸性条件下由MnCO3快速释放并实现CDT[24]。有研究开发了一种用于声动力治疗和CDT的Au@MnO纳米颗粒[25]。在超声辐射和谷胱甘肽作用下,Au@MnO可分解为Mn2+和超小Au纳米粒子,超小Au纳米纳米粒子实现声动力治疗,Mn2+催化H2O2实现CDT。同时,用于CDT的锰基纳米材料还有MnO2[26]、MnSiO3[27]、MnS[28]等。除此之外,作为顺磁性物质,Mn2+是一种良好的MRI造影剂,具备较高的R1值,这提示本研究制备的MSN@Mn-GOx在体内MRI成像中也将具备良好的成像效果[29,30]。为验证这一假设,我们在药物处理后麻醉了小鼠并进行了MRI扫描。结果显示:经MSN@Mn-GOx处理后,肿瘤部位出现增强T1加权信号,表明该材料不仅能够能实现肿瘤治疗,而且能够精确定位肿瘤病灶,对制定临床诊治方案具有重要的指导意义。
Mn毒性大,且肿瘤细胞内H2O2浓度有限,难以达到满意的抗肿瘤效果。本研究在引入锰基材料的同时加入了天然酶GOx。GOx能够与细胞内的葡萄糖和氧气发生反应,生成大量的H2O2和葡萄糖酸,该过程中产生的H2O2可用于后续Mn纳米颗粒催化的类芬顿反应,而葡萄糖酸的生成不断增强了肿瘤低pH环境,进一步提高了类芬顿反应催化效率,而这些连续的催化反应产生大量强氧化损伤的·OH,从而引发肿瘤细胞的凋亡和坏死[27,31-33]。因此,GOx是肿瘤饥饿治疗的理想内源性氧化还原酶。有研究以聚乙二醇修饰的GOx为模板,采用仿生矿化的方法制备铜离子掺杂的磷酸钙纳米颗粒,再负载药物DOX得到PGC@DOX纳米复合材料。该材料在进一步提升GOx的稳定性和安全性的同时,还具备生成H2O2及清除GSH的功能,可有效进一步提升Cu2+介导的CDT的疗效[34]。Zhang等[27]还开发了负载GOx的纳米复合材料,该材料将Mn纳米材料与GOx杂化,实现肿瘤葡萄糖代谢的自放大调控。一方面,锰纳米材料催化H2O2生成O2;形成的O2能够促进纳米复合物中GOx 的葡萄糖消耗能力,有效调控葡萄糖代谢。另一方面,后一反应形成的H2O2也有利于Mn纳米材料的催化反应。本研究还证实,MSN@Mn-GOx组较MSN@Mn组细胞ROS生成水平更高,在细胞增殖实验中表现出更强的抗肿瘤作用。因此,MSN@Mn-GOx的成功制备有望做到肿瘤饥饿治疗和CDT的双模式协同治疗。
综上所述,本研究成功制备了纳米复合物MSN@Mn-GOx,并初步验证该材料具有良好的类芬顿催化反应,并能够协同GOx实现肿瘤的饥饿疗法,表现出显著的抗肿瘤作用,可用于磁共振成像和级联反应增强的协同肿瘤治疗,在临床上具有治疗肿瘤的潜力。

