一锅法合成5-氨基咪唑类衍生物
章潮军,陈彩萍,王小平,徐作武,吴春雷
(1.浙江昌海制药有限公司,浙江 绍兴 312000;2.浙江可明生物医药有限公司,浙江 绍兴 312000;3.浙江绍兴文理学院 化学化工学院,浙江 绍兴 312000;4.脂溶性维生素浙江省工程研究中心,浙江 绍兴 312000)
杂环是药物分子中最常见的片段,而5-氨基咪唑类物质作为常见的杂环结构,也经常出现在药物或活性分子中。已经有很多此类物质为活性分子的相关报道。Ruzi课题组[1]合成了一系列5-氨基-1-N-取代-咪唑-4-羧酸乙酯类化合物,经过活性测试,这些物质表现出一系列抑制肿瘤细胞生长的活性,如对HeLa(子宫颈)、HT-29、HCT-15(大肠)、A549(肺)和 MDA-MB-231(乳腺)等细胞都有抑制活性。Martin等[2]报道了5-氨基-1-β-D-呋喃核糖基-咪唑-4-甲酰胺类物质能够激活腺苷酸活化酶,从而降低外周炎症反应。Ali等[3]报道了5-(芳基茚氨基)-1H-苯并[d]咪唑-2-硫醇具有一致α-葡萄糖苷酶的活性,可用来对抗糖尿病。Apostolatos等[4]报道了5-氨基-1H-咪唑-4-酰胺衍生物,作为一种蛋白酶-ι(C-PKC-ι)的抑制剂,能有效地对抗前列腺癌。而Persons等[5]报道的5-氨基咪唑-4-甲酰胺-1-β-4-呋喃核糖则有效抑制胰腺癌细胞的生长。
5-氨基咪唑类化合物的合成方法主要有硝基还原或者叠氮基还原法[6]、1,2,4-三氮唑法[7]、微波合成法[8]、原甲酸三乙酸酯法[9]、异腈法[10]等。这些方法大多条件要求较为苛刻,或者反应条件及后处理较为繁琐。
“一锅法”串联反应,可以避免中间体的分离纯化,提升反应效率,简化反应工艺,在有机合成中有较广泛的应用,是绿色化学的热门研究领域[11-17]。
Wu等[18-20]连续报道了靛红参与的多分子反应,以良好的收率获得了一系列螺环吲哚酮类杂环化合物。本文主要研究用“一锅法”制备5-氨基咪唑类化合物,以芳香胺、二硫化碳和对甲苯磺酰基甲基异腈为原料,在碱催化下,三分子“一锅法”合成得到目标产物5-氨基咪唑类衍生物。5-氨基咪唑的合成路线见Scheme 1。
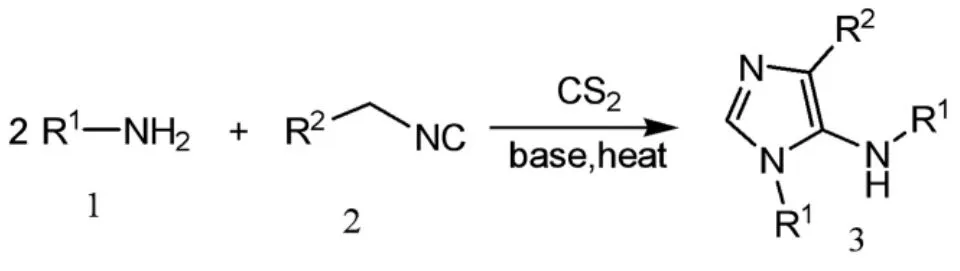
Scheme 1 5-氨基咪唑的合成路线
1 实验部分
1.1 试剂和仪器
所有试剂均为市售,无需进一步纯化即可使用。NMR在Bruker AVANCED MXIII 400M上测定,熔点在BUCHIM-560熔点仪测得。
1.2 5-氨基咪唑类衍生物的一般合成步骤
在50 mL的两颈圆底烧瓶中加入磁力搅拌子,按顺序加入有机胺(1 mmol)、乙醇(10 mL)、NaOH(120 mg,3.0 mmol),在通风柜中用移液枪加入CS2(90 μL,1.5 mmol),在80℃下反应1 h,然后静置冷却至室温,向其中加入甲基取代的异腈(1.2 mmol),接着在80℃下继续反应数小时,反应过程中一直用薄层色谱板进行跟踪(TLC)至反应结束。反应结束后向反应体系中加入1 mL 0.3%的稀盐酸溶液以淬灭反应。然后向反应体系中加入饱和食盐水溶液和乙酸乙酯进行萃取,取有机层(上层)萃取3次,合并有机层,用无水硫酸钠干燥,柱色谱分离纯化目标化合物。
2 结果与讨论
首先对实验反应条件进行选择和优化,以对甲苯磺酰基甲基异腈、对甲基苯胺与二硫化碳为模板反应,通过实验对比以及产物的收率分析,对反应条件进行筛选和优化。主要是通过尝试使用不同的催化剂、不同的有机反应溶剂和不同的反应温度,以及不同的投料比,研究相关因素对反应收率的影响。在确定最优条件后,对反应物进行拓展,制备一系列5-氨基咪唑类化合物。
2.1 催化剂的筛选
选择不同的催化剂,如 Cs2CO3、K2CO3、NaOH、CH3ONa、1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)和 N-乙基二异丙胺(DIPEA)进行反应。结果发现:使用DIPEA催化剂,没有产物生成;而使用其他催化剂,都有产物生成。其中,以K2CO3作催化剂,产物收率最低,仅有16%;以NaOH为催化剂,反应效果最好,最高收率为57%。不同催化剂对反应的影响见表1。
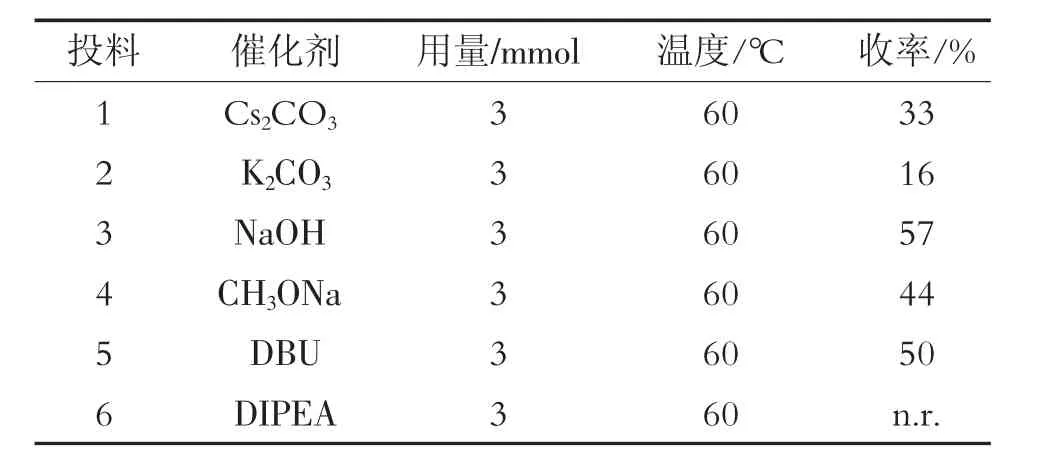
表1 不同催化剂对反应的影响
2.2 反应溶剂的筛选
选择不同的溶剂,如CH3CH2OH、四氢呋喃(THF)、二氯甲烷(DCM)、乙醚、N,N-二甲基甲酰胺(DMF)、甲苯和乙酸乙酯进行条件筛选。结果发现,使用Et2O和甲苯为反应溶剂,产物生成较少,收率分别为30%和46%;而使用其他反应溶剂,都有较多产物生成,产物收率均在50%以上,尤其是使用CH3CH2OH为反应溶剂,反应效果最好,收率最高,为67%。不同反应溶剂对反应的影响见表2。
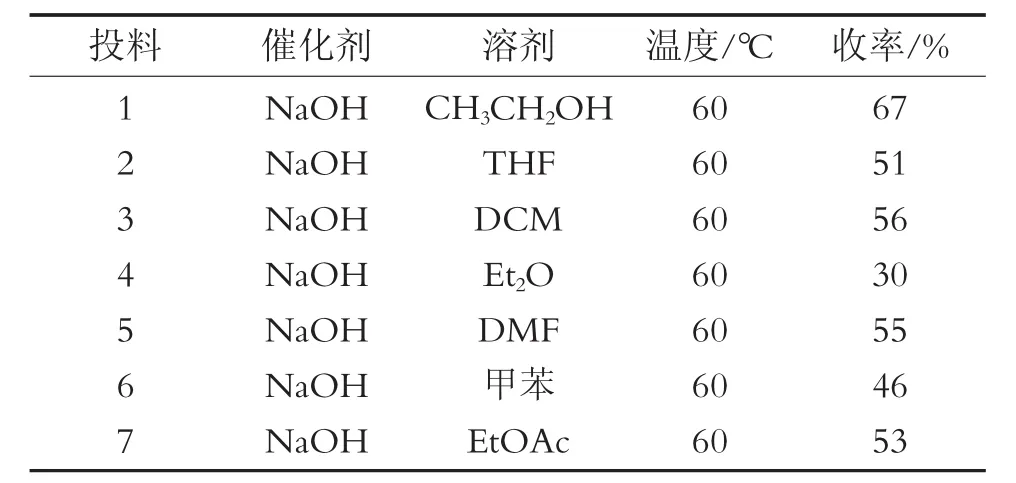
表2 不同反应溶剂对反应的影响
2.3 反应温度的筛选
选择3个反应温度(25℃、60℃和80℃)进行条件筛选,结果发现25℃没有目标产物生成,而60℃和80℃均有产物生成。其中,80℃进行反应效果最好,收率最高为73%。不同反应温度对反应的影响见表3。
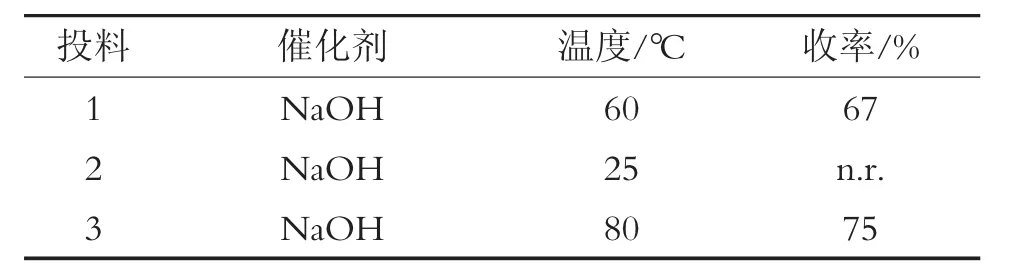
表3 不同反应温度对反应的影响
2.4 反应投料比的筛选
为了提高反应收率,对原料的投料比进行筛选,选择 3 个不同的投料比(R1NH2、R2CH2NC、CS2的摩尔比分别为1:1:1、1:1:1.5和1:1.2:1.5)进行反应条件的优化,结果发现合适的投料比为n(R1NH2):n(R2CH2NC):n(CS2)为 1:1.2:1.5,该反应效果最好,收率最高为73%。不同投料比(摩尔比)对反应的影响见表4。

表4 不同投料比(摩尔比)对反应的影响
2.5 底物的扩展
根据上述实验条件筛选和优化所得实验结果,最终确定最优反应条件是:反应温度为80℃,溶剂为乙醇,催化剂为NaOH,原料最佳投料比是n(R1NH2):n(R2CH2NC):n(CS2)=1:1.2:1.5。在确定了最优反应条件以后,还探索了该反应条件的普适性和耐受性,所以对反应底物进行了扩展。另外,从电子效应和位阻效应两方面出发,研究了这两个因素对该反应效率的影响。底物对反应的影响见表5。
从表5可看出,芳香环上带有各种官能基团(如 F-、Cl-、Br-、CH3-、CH3O-、t-Bu-)的许多芳香胺化合物和对甲苯磺酰基甲基异腈进行了成环反应。当R1为苯环时,产率为81%;当R1为4-甲基苯基、4-甲氧基苯基和4-叔丁基苯基时,产物的收率分别为75%、73%和79%;当R1为4-氟苯基、4-氯苯基、4-溴苯基时,产物的收率分别为75%、77%、82%。因此,发现同样是对位取代基,与苯环上连有给电子基团(如4-CH3-、4-CH3O-和4-t-Bu-)相比,苯环上连有吸电子基团(如4-F-、4-Cl-和4-Br-)时,该反应具有更高的收率,其原因可能是4-F-、4-Cl-和4-Br-这些取代基强烈的诱导效应所致;相比于对位取代基,苯环上连有邻位取代基(2-Br-)时,该反应收率相对较差,其原因可能是空间位阻较大。2-Br-直接在苯环的2-位,导致甲基取代异腈很难进攻由胺类化合物与CS2所形成的中间体,从而使反应活性降低。
3 目标化合物的结构表征
化合物3a:N,1-二苯基-4-(4-甲基苯磺酰基)-1H-咪-5-氨,浅棕色固体,熔点205℃~207℃。1H NMR(400 MHz,CDCl3):δ 7.80(2H,d,J=8.5 Hz),7.52(1H,s),7.27~7.28(3H,m),7.24~7.25(1H,m),7.15(2H,d,J=8.5 Hz),6.99(2H,t,J=7.5 Hz),6.91(1H,s),6.79(1H,t,J=7.5 Hz),6.55(2H,d,J=7.5 Hz),2.37 (s,3H)。13C NMR (100 MHz,CDCl3):δ 144.03,142.20,138.57,136.16,134.89,134.64,129.70,129.50,128.94,128.75,128.30,127.54,124.24,122.04,117.65,21.32。
化合物3b:N,1-双(4-甲基苯基)-4-(4-甲基苯磺酰基)-1H-咪-5-氨,棕色固体,熔点185℃~188℃。1H NMR(400 MHz,CDCl3):δ 8.00(2H,d,J=8.0 Hz),7.45(1H,s),7.21(2H,d,J=8.0 Hz),7.14(2H,d,J=8.5 Hz),7.07 (2H,d,J=8.5 Hz),6.79 (1H,s),6.81(2H,m),6.45(2H,d,J=8.5 Hz),2.38(s,3H),2.26(s,3H),2.16(s,3H)。13C NMR(100 MHz,CDCl3):δ 143.98,140.04,138.83,136.89,134.98,132.28,131.57,130.12,129.75,129.54,127.81,127.62,124.13,117.97,21.67,21.13,20.65。
化合物3c:N,1-双(4-甲氧基苯基)-4-(4-甲基苯磺酰基)-1H-咪-5-氨,黄色固体,熔点155℃~157℃。1H NMR(400 MHz,CDCl3):δ 7.86(2H,d,J=8.0 Hz),7.37(1H,s),7.26(2H,d,J=11.0 Hz),7.13(2H,d,J=9.0 Hz),6.87(1H,s),6.74(2H,d,J=8.5 Hz),6.55~6.56 (4H,m),3.72 (s,3H),3.67(s,3H),2.39 (s,3H)。13C NMR (100 MHz,CDCl3):δ 159.49,155.52,143.88,138.92,138.25,135.20,134.77,129.71,127.43,127.41,125.92,125.88,121.02,114.45,114.17,55.47,55.45,21.57。
化合物3d:N,1-双(叔丁基苯基)-4-(4-甲基苯磺酰基)-1H-咪-5-氨,黄色固体,熔点166℃~167℃。1H NMR (400 MHz,CDCl3):δ 7.81(2H,d,J=8.0 Hz),7.44(1H,s),7.22~7.26(4H,m),7.13(2H,d,J=8.5 Hz),6.99 (2H,d,J=8.5 Hz),6.89 (1H,s),6.50 (2H,d,J=8.5 Hz),2.38 (s,3H),1.21 (s,9H),1.18(s,9H)。13C NMR(100 MHz,CDCl3):δ 152.04,145.47,143.99,139.50,138.93,137.56,134.72,132.26,129.83,127.65,126.62,126.35,125.56,124.22,118.75,34.78,34.22,31.51,31.30,21.77。
化合物3e:N,1-双(4-氟苯基)-4-(4-甲基苯磺酰基)-1H-咪-5-氨,黄色固体,熔点247℃~250℃。1H NMR (400 MHz,CDCl3):δ 7.83(2H,d,J=8.5 Hz),7.44(1H,s),7.27(s,1H),7.26~7.25(m,1H),7.24~7.21(2H,m),6399-6.96(m,2H),6.91(1H,s),6.72(2H,t,J=8.5 Hz),6.55~6.53(2H,m),2.40(3H,s)。13C NMR (100 MHz,CDCl3):δ 163.47,161.48,159.81,157.88,144.38,138.64,138.16 (d,J=10.0 Hz),137.13,134.83,130.70 (d,J=8.0 Hz),130.00,127.70,120.50 (d,J=8.0 Hz),116.80 (d,J=22.75 Hz),115.95(d,J=22.63Hz),21.80。
化合物3f:N,1-双 (4-氯苯基)-4-(4-甲基苯磺酰基)-1H-咪-5-氨,黄色固体,熔点225℃~227℃。1H NMR(400 MHz,CDCl3):δ 7.74(2H,d,J=8.5 Hz),7.51(1H,s),7.30(2H,d,J=8.5Hz),7.23(4H,d,J=8.5 Hz),6.99(2H,d,J=11.5 Hz),6.83(1H,s),6.46(2H,d,J=8.5 Hz),2.39(s,3H)。13C NMR (100 MHz,CDCl3):δ 144.59,141.25,138.29,135.40,135.28,135.00,133.03,130.14,129.98,129.76,129.34,127.77,127.46,125.63,118.62,21.80。
化合物3g:N,1-双 (4-溴苯基)-4-(4-甲基苯磺酰基)-1H-咪-5-氨,黄色固体,熔点241℃~242℃。1H NMR(400 MHz,CDCl3):δ 7.75(2H,d,J=8.5 Hz),7.53(1H,s),7.46(2H,d,J=8.5 Hz),7.22(2H,d,J=8.0 Hz),7.18(2H,d,J=9.0 Hz),7.13(2H,d,J=8.5 Hz),6.81(1H,s),6.40(2H,d,J=9.0 Hz),2.38(s,3H)。13C NMR(100 MHz,CDCl3):δ 144.58,141.95,138.18,135.04,134.98,133.48,133.13,132.23,130.29,129.95,127.77,125.89,123.26,118.64,114.55,21.78。
化合物3h:N,1-双(2-溴苯基)-4-(4-甲基苯磺酰基)-1H-咪-5-氨,浅黄色固体,200℃~202℃。1H NMR (400 MHz,CDCl3):δ 7.85(2H,d,J=8.5 Hz),7.55(1H,d,J=8.0 Hz),7.53(1H,s),7.33(1H,d,J=8.0 Hz),7.22-7.25(4H,m),7.16(1H,t,J=8.0 Hz),6.91(1H,t,J=7.5 Hz),6.72(1H,s),6.67(1H,t,J=7.5 Hz),6.45 (1H,t,J=8.0 Hz),2.40 (s,3H)。13C NMR (100 MHz,CDCl3):δ 144.38,140.11,138.42,135.65,135.05,133.97,133.13,132.83,131.18,129.92,129.45,128.91,128.76,128.55,127.86,123.28,120.61,117.73,113.59,21.81。
4 结论
(1)以对甲苯磺酰基甲基异腈、取代芳香胺与二硫化碳3分子一锅法反应合成了一系列多取代的5-氨基咪唑类化合物。通过实验对比以及产物的收率分析,对反应条件进行筛选和优化,主要考察了催化剂、反应溶剂、反应温度,以及投料比对反应收率的影响。最终确定最优反应条件:反应温度为80℃,溶剂为乙醇,催化剂为NaOH,原料最佳 投料 比为 n(R1NH2):n(R2CH2NC):n(CS2)=1:1.2:1.5。并进行反应底物的扩展,共合成了8个化合物。
(2)建立了新的简单而有效的方法,通过“一锅法”合成具有潜在生物活性的多取代5-氨基咪唑类化合物。该合成方法具有以下优势:①原料廉价易得;②实验步骤少,反应操作方便,采用一锅煮的方法,减少了中间体的分离纯化步骤,节省时间和人力。

