基于CT影像组学的肺癌生存预后预测分析
张国前 张书旭 吴书裕 周 露 张 颖 廖煜良 郑荣辉
广州医科大学附属肿瘤医院 广东广州 510095
肺癌已成为全世界发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)占比约80%~85%,而晚期非小细胞的生存率低于5%[1]。目前,针对非小细胞肺癌的第8版TNM分期对预后预测有重要价值。然而相同阶段的患者个体预后却差异很大,生存时间不尽相同。进一步建立更优的预后模型对于非小细胞肺癌的治疗尤为重要。2012年有学者[2]首次提出了“radiomics”的概念,即以高通量的方式提取图像的内在特征。2014年影像组学的概念得到进一步发展,即以自动或半自动的方式提取影像中的大量可量化信息,将组学特征与内在异质性、遗传特征或其他表型尽进行关联,达到鉴别诊断或预测疾病预后的目的[3]。基于影像组学方法对肿瘤病灶进行特征提取和定量分析,然后基于筛选的特征开发预后模型,对于肿瘤患者的个体化诊疗与决策有望起到积极作用。本研究拟应用基于(LASSO)算法的影像组学方法预测非小细胞肺癌患者的总生存期(overall survival, OS),并构建预后模型。
1 资料与方法
1.1 研究对象
本研究的患者数据来自癌症影像档案(the cancer imaging archive,TCIA)中的NSCLC-Radiomics公共数据库,共计422例NSCLC患者的临床数据(含年龄、性别、OS及终点事件)、CT增强影像纳入本研究,同时将数据集中的每个肿瘤三维靶区轮廓作为感兴趣区(region of interest,ROI)。图1为某患者横断位、矢状位及冠状位增强CT和肿瘤ROI示意图。CT扫描参数:扫描层厚3 mm,FOV(Field of View)500 mm,管电压120 kV。重建矩阵512 像素×512 像素。所有患者在CT图像上的空间重采样间隔x、y和z方向均设置为1 mm进行图像归一化处理。

图1 其患者横断位、矢状位及冠状位增强CT图像和肿瘤ROI示意图,红色箭头示ROI
1.2 病灶特征提取
本研究为421例患者(1例提取失败)的肿瘤ROI进行了特征提取,每个ROI共提取1 409个组学特征(使用Python中的pyradiomics V3.0.1软件包,https://pyradiomics.readthedocs.io/),提取的组学特征可分为两部分:(1)基于特征类:①一阶统计量特征(first order);②形状特征(shape-based),包括二维和三维特征;③纹理特征(texture),包括灰度级形状矩阵(gray level size zone matrix,GLSZM)、灰度级长度矩阵(gray level run length matrix,GLRLM)、灰度级共生矩阵(gray level cooccurrence matrix,GLCM)、灰度级依赖矩阵(gray level dependence Matrix,GLDM)和相邻灰度差分矩阵(neighborhood gray-tone difference matrix,NGTDM)。(2)基于过滤器类:是指经过平方根(squareroot)、梯度(gradient)、对数(logarithm)、指数(exponential)、小波变换(wavelets)、梯度(gradient)和局部二进制模式(local binary patterns,LBP)等方法处理得到的完全可重复的特征。对所有特征数据进行标准化预处理。
1.3 特征筛选与模型建立
在训练组中通过最小绝对收缩和选择算子(least absolute shrinkage and selectionoperator,LASSO)算法进行数据降维,减少冗余特征,对拟合模型进行优化。①通过单因素Cox分析得到显著与生存相关的影像组学特征,P<0.05时为显著相关。② 对上述初步筛选的特征进行回归运算,随着调节参数lambda(λ)的增加,变量的系数绝对值逐渐降低直至为零,进一步减少选取的变量。③基于训练集LASSO 回归结果构建影像组学标签(radiomics signature score,Rad-score)。④利用多因素Cox回归筛选生存期的独立影响因素,进一步构建预后模型。
1.4 统计分析
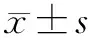
2 结果
2.1 一般资料
421例患者中,373例(占88.6%)死亡。其中,训练集296例患者中,89.2%(264/296)死亡。验证集125例患者中,87.2%(109/125)死亡,中位OS分别为548 d和529 d。训练组与验证组中患者年龄、性别、随访时间、终点事件均无统计学差异(P>0.05)(见表1)。

表1 训练集和验证集一般资料比较结果 (例)
2.2 影像组学模型
应用LASSO-Cox 回归选择特征(见图2),通过10折交叉验证选择最佳lambda(λ),随着log(λ)从-10 减小至0,进入模型的变量数减少。最终共筛选得到11个组学特征。根据特征名称及相应权重系数(见表2)计算组学标签(radiomics score,Rad-score),组学评分=2.684 759×特征1+1.93E-09×特征2+0.000 183×特征3+1.40E-06×特征4+0.026 590×特征5-0.094 427×特征6-0.223 895×特征7-0.11 952 919×特征8-0.188 150×特征9-4.280 977×特征10+3.275 031×特征11。
注:图2A为交叉验证曲线;图2B为11个组学特征与解释偏差的系数分布。图2 通过LASSO-Cox回归选择预后相关的组学特征
2.3 影像组学标签及模型预测能力
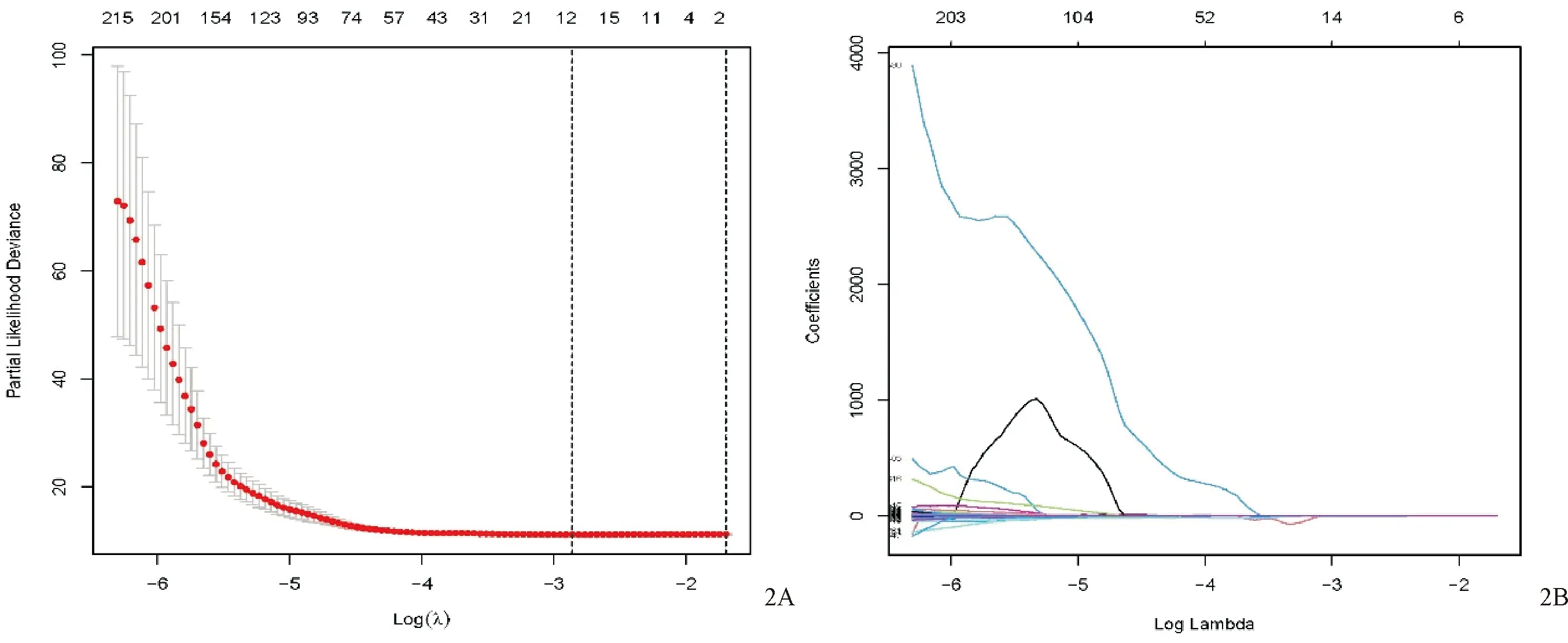
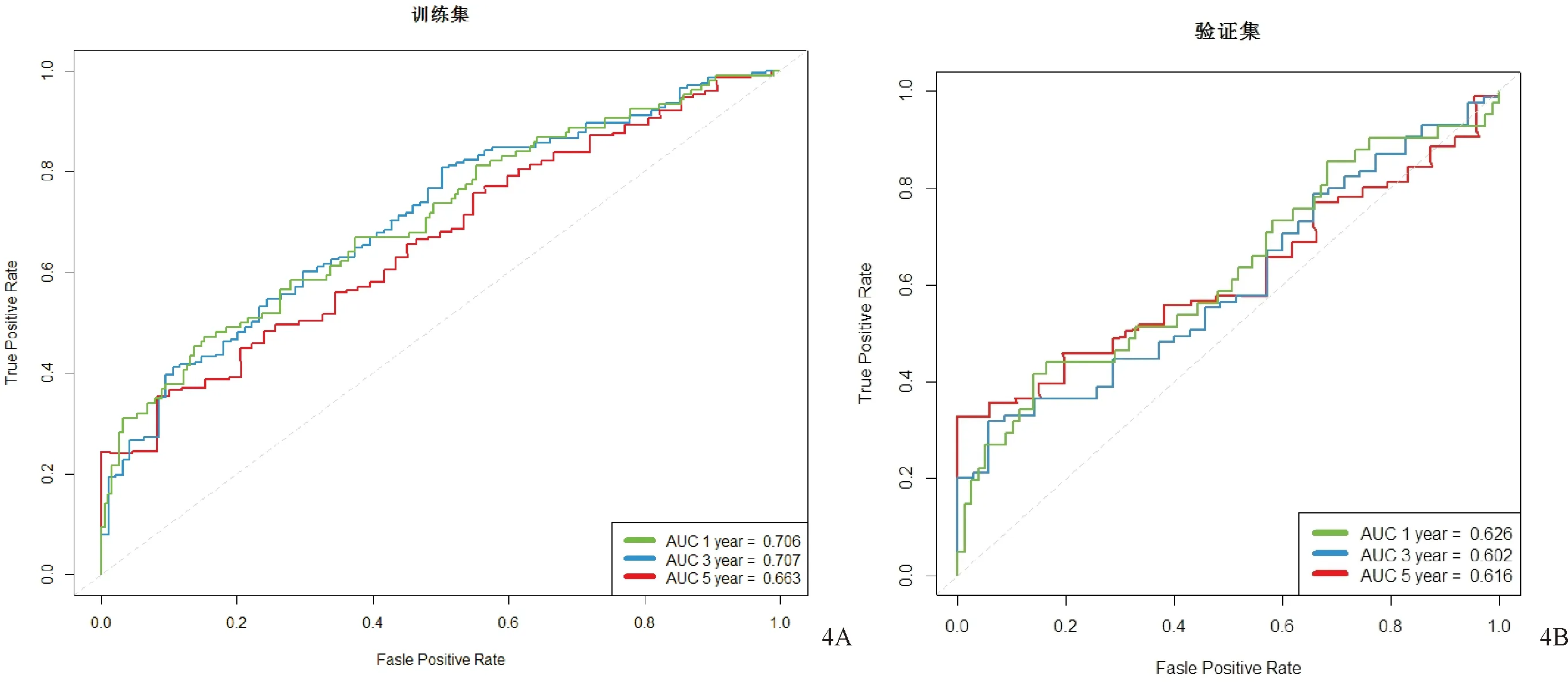
应用R软件确定影像组学标签最佳Cut-off值为1.276,将训练组患者分为高危组(risk_group=High, Rad-score ≥1.276)和低危组(risk_group=Low, Rad-score<1.276)。Kaplan-Meier 生存曲线(见图3)显示影像组学评分在训练集(见图3A)(Log-rank检验)中和验证集(见图3B)(Log-rank检验)中均和OS显著相关,差异均有统计学意义(均P<0.0001)。Cox单因素分析示年龄(≥60岁)、性别、影像组学标签是影响OS(HR值:1.018、0.773、1.529,95%CI: 1.007~1.030、0.619~0.967,1.389~1.684,均P<0.05)的独立预后因素。Cox多因素分析示影像组学标签和年龄(≥60岁)是影响OS(HR:1.369、1.017,95%CI1.207~1.552、1.005~1.029,均P<0.005)的独立预后因素。图4示影像组学模型在训练集及验证集中患者1、3、5年OS的受试者工作特征(ROC)曲线,其中在训练集曲线下面积(AUC)分别为0.706、0.707、0.663 (图4A),在验证集曲线下面积(AUC)分别为0.626、0.602、0.616 (图4B)。将年龄纳入预后模型后,该联合模型对训练集中患者1、3、5年OS预测的受试者工作特征(receiver operating characteristic,ROC)曲线的AUC 分别为0.696、0.718、0.749(见图5A)。模型在验证集中预测患者1、3、5年OS ROC曲线的AUC分别为0.689、0.667、0.661 (见图5B)。基于患者年龄、性别、影像组学评分构建NSCLC患者OS的可视化列线图见图6。影像组学模型和联合模型预测1、3和5年生存率的临床决策曲线(DCA)见图7。

注:红色代表高危组(risk_group=High),蓝色代表低危组(risk_group=Low)。图3 预后模型在训练集(3A)及验证集(3B)中影像组学标记的高、低风险组的总生存(OS)
注:图4A在训练集曲线下面积(AUC)分别为0.706、0.707、0.663,图4B在验证集曲线下面积(AUC)分别为0.626、0.602、0.616。图4 影像组学模型在训练集及验证集中患者1、3、5年OS的受试者工作特征(ROC)曲线
注:5A在训练集曲线下面积(AUC)分别为0.696、0.718、0.749;图5B在验证集曲线下面积(AUC)分别为0.689、0.667、0.661。图5 联合模型在训练集及验证集中患者1、3、5年OS的受试者工作特征(ROC)曲线
3 讨论
目前NSCLC的分级分期是临床上进行预后预测的主要方法,但是这种方法仅考虑到了肿瘤的解剖因素,通常需要有创的组织取样,且往往不能反映整个肺癌肿瘤内部的异质性[4]。目前,国内外关于影像组学预测NSCLC预后的研究已逐渐成为研究热点。有研究报道影像组学特征是NSCLC的独立预后因素,且与多种临床终点相关[5~7]。
随着医学影像技术的不断发展,CT、磁共振成像(magnetic resonance imaging, MRI)和正电子发射断层显像(positron emission computed tomography, PET)都可以用于影像组学分析,基于不同影像模态的影像组学工作流程基本相同[8],然而对于呼吸系统特别是肺癌领域,CT是最常见的影像学检查手段[9]。CT 图像具有较好的空间分辨率,对于不同的组织结构能够以灰度来代表,同时CT影像的纹理可能与肿瘤的异质性相关,也可能预测肿瘤的生物学行为[10]。最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)、递归特征消除(recursive feature elimination,RFE)算法、互信息(mutual information,MI)算法是目前影像组学研究中常用的特征筛选方法,但由于研究数据的差异和研究目的的不同,暂没有统一的特征选择算法和模型构建方法。相关研究结果认为LASSO能够有效地消除特征间的共线性,其选取的灰度级变化类特征能够有效地预测患者生存[11]。
基于上述背景,本研究针对 NSCLC患者术前的 CT增强图像进行影像组学分析。共获取 421例患者的1 409个影像组学特征参数,通过 LASSO 回归筛选出 11个具有非零系数的组学特征,然后Cox 回归分析建立了影像组学模型,用于构建模型筛选到的11个特征,分别分布在GLSZM(5个)、一阶特征(3个)、GLCM(1个)、GLDM(1个)和NGTDM(1个),其中GLSZM、GLCM特征反映了NSCLC肿瘤区域的水平变化、复杂性等信息,GLDM特征反映了CT影像纹理的灰度和厚度,NGTDM特征用来衡量NSCLC肿瘤组织的异质性。本研究筛选的特征中75%为肿瘤区纹理特征,与上述研究结果[10]存在一定的一致性。同时,由上述11个影像组学特征组成的影像组学评分是NSCLC患者 OS的独立预测因素。
影像组学在预测非小细胞肺癌预后方面呈现出了越来越大的潜力。相关研究证实了基于 CT的影像组学在治疗前预测NSCLC总生存期的可能性。基于影像组学为NSCLC患者进行更准确的生存预测,可能为临床医生选择个体化的治疗策略起到积极作用。MUKHERJEE 等[12]开发了一个浅层卷积神经网络(LungNet)模型对多中心的CT 图像进行了分析,来预测NSCLC 患者的总生存率,各独立生存数据集的总生存率的一致性指数分别为0.62、0.62、0.62 和0.58。SINGH等[13]开发了一种放射基因组模型来识别高危患者,并对生存期进行了预测,研究中使用Mann-Whitney U检验识别224个稳健特征的子集,然后对各属性的差异进行鉴别。从放射性特征和基因组特征中提取10个主成分,最后使用一个多变量Cox 比例风险模型进行一致性指数计算(C-index=0.62)。Patrick在其研究中报道[14],当基于影像组学模型预测NSCLC的预后时,C-index通常为0.60~0.67,如果结合临床等特征能够提高至0.72以上。LI 等[15]在研究中纳入了92 例Ⅰ期或ⅡA 期NSCLC 患者,研究治疗前CT的影像学特征是否与立体定向体放疗后的总生存期、无复发生存期和局部无复发生存期相关。研究中除临床特征外,还采用人工方式对24个语义图像特征进行评分,基于分割的肿瘤区域提取了219 个计算机衍生的“放射学”特征。最后通过Harrell’s C 指数和Cox 比例风险模型进行分析,评估最终预后模型的稳健性,结果发现2 年总生存期、无复发生存期和局部无复发生存期的AUC 分别为72.8%、74.7%和69.0%。HOSNY 等[16]使用3D卷积神经网络筛选了接受放疗的肺癌患者(771 例)的预后特征。然后采用迁移学习方法对391例手术患者进行相同的操作。结果发现,3D卷积神经网络预测2 年总生存率与放疗治疗开始后的(AUC=0.70 [95%CI:0.63 ~0.78],P<0.001)和手术后的(AUC=0.71 [95%CI:0.60 ~0.82],P<0.001)患者显著相关。
此外,PET-CT 影像组学在NSCLC 中同样显示出了较好的预后评估效能。Kirienko 等[17]研究发现长区域高灰度强调度(large zone high gray-level emphasis,LZHGE)是PFS 的显著预测因子(P<0.05),在此基础上建立的PET-CT 影像组学预测PFS模型的性能(AUC=0.68)优于常见的临床预测指标(AUC=0.58)。Mu等[18]在研究中对接受ICIs 治疗的晚期NSCLC患者的无进展生存期进行了预测,PET-CT 影像组学的诊断效能(AUC=0.77)高于PET 影像组学和CT 影像组学(AUC均为0.74),该研究表明基于PET-CT 的影像组学有助于提高晚期NSCLC 患者免疫治疗的精确性,能够为个体化的治疗决策提供支持。然而也有学者的研究呈现出了不同的结果。共计141例非小细胞肺癌患者的3个特征数据集被纳入了一项纵向研究,分析影像组学特征对患者预后的预测性能,其结果认为提取的影像组学特征并非有助于患者预后的预测[19]。
然而,影像组学在肺癌中的应用仍然存在一些挑战:①目前回顾性研究较多,仍缺乏大量多中心前瞻性的影像组学研究。②图像采集的标准化问题突出,目前影像组学研究尚无统一的成像标准。对于不同的影像设备,图像采集参数的差异、传输协议、图像重建算法、观察者间变异等均可影响组学特征的稳定性和重复性。③目前尚未完全阐明影像组学特征的生物学解释,其潜在的生物学含义有待进一步深入探讨。
对于本研究,局限性主要在以下几个方面。首先,研究数据来自TCIA数据库,样本量相对较小,样本基线资料相对欠缺,对模型的预测效能存在影响,本研究的结论尚待多中心前瞻性的研究进一步证实;其次,研究中所采用的肺癌CT 图像和靶区ROI为多个中心提供,扫描参数差异不可避免,靶区勾画的一致性问题无法克服;第三,影像组学预测肺癌患者OS能力背后的生物学解释尚不清楚,相关组学特征代表的生物学意义还需要进一步深入分析;第四,本研究中在对预测模型进行验证时使用的是内部数据,可能出现模型过拟合问题;最后,在建模之前有必要对提取的特征之间的共线性和冗余度等进行分析,应用多种特征选择方法并进行比较,筛选最合适的特征构建联合预测模型。
综上所述,通过本研究证明了采用影像组学方法预测NSCLC患者OS的可行性。基于术前增强 CT的影像组学标签对NSCLC患者OS的预测具有一定价值,有望对此类患者的治疗决策进行一定程度上的指导。但是,在将这样的评价指标最终广泛运用于临床实践中之前,仍需要在多中心前瞻性研究中进一步验证。

