益生菌对自身免疫性疾病干预策略的研究进展
杨 扬,洪 青,刘振民*
(乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,光明乳业股份有限公司乳业研究院,上海 200436)
近数十年来,在全球范围内,多发性硬化症(multiple sclerosis,MS)和类风湿性关节炎(rheumatoid arthritis,RA)等自身免疫性疾病(autoimmune disease,AID)发病率正在飙升,给患者带来极大痛苦。常规的药物治疗虽能缓解痛症但也会给患者带来诸多不良反应。AID的发生往往与遗传、环境、肠道菌群等因素密切相关。因此,本文论述AID与肠道菌群的密切关系,整理了通过益生菌改变肠道菌群组成和多样性,以及调节免疫系统功能的方式缓解AID的相关研究,为临床选择治疗方案提供支持。
1 几种典型AID
AID是由于自身抗原免疫耐受紊乱,机体产生大量自身抗体和免疫复合物,进而导致多种组织和器官损伤及功能障碍为特征的一大类疾病,主要包括系统性红斑狼疮(systemic lupus erythematosus,SLE)、MS、RA、干燥综合征等[1]。1999年AID被列威胁人类健康的第三大杀手,仅次于心血管疾病和癌症,我国也将其列为国家中长期科技发展纲要的十类重大疾病之一[2]。AID全球发病率和患病率分别为0.09%左右[3]和7.6%~9.4%[4],其中2 种典型的AID:SLE和RA的全球患病率分别约为0.02%[5]和0.5%[6]。总体来看,AID发病率呈现逐年上升的趋势[7]。目前,AID的病因和发病机制尚未完全明确,一般认为是由遗传因素和环境因素等共同作用的结果。目前临床尚不能根治AID,因此,治疗多着重于最大程度减少疾病对各器官系统的损害,延缓病情迅速发展,有效改善预期后果,防止疾病反复发作。
1.1 SLE
SLE是一种累及全身各系统及组织器官的慢性AID,多发于15~45 岁育龄期女性[8]。SLE临床表现复杂多变,个体差异大,累及皮肤黏膜、关节肌肉、肾脏、血液、神经等多种脏器和系统。SLE患者通常有以下几个特征[9]:1)针对多种组织器官的自身免疫抗体和反应性T细胞的产生;2)自身抗原刺激下产生的免疫反应介导脏器和系统损伤;3)SLE患者病情发展情况与自身免疫应答的持续时间和强弱存在密切关系;4)SLE的发生与性别和年龄有关系,特别是育龄期女性;5)SLE临床症状多发于皮肤、关节和肾脏,病情反复。
SLE确切病因和发病机制不明确,多数研究学者认为SLE受遗传、环境、激素、免疫等多因素影响[10]。目前已知SLE的发生与T、B淋巴细胞的异常活化,以及自身反应性抗体与自身抗原大量结合而形成的免疫复合物有关。自身反应性免疫球蛋白E通过激活嗜碱性粒细胞促进Th2细胞分化[11],并且协同参与浆细胞样树突细胞活化,增加干扰素α产生,增加SLE疾病的活动性[12]。
1.2 MS
MS是一种以中枢神经系统炎性脱髓鞘病变为主要特点的免疫介导的炎症性疾病,主要累及脊髓和大脑白质,常伴有神经脱髓鞘、轴突丧失,是影响年轻人的最常见的非创伤性致残性疾病[13]。常见症状包括手脚麻木、视力下降、头晕头痛、走路不稳、肢体运动障碍、共济失调、膀胱或直肠功能障碍等,严重者可致残甚至死亡,具有高复发性和致残性,女性发病率是男性的1.5~2.0 倍[13-14]。MS根据病程分为复发缓解型、继发进展型、原发进展型、进展复发型共4 种,其中复发缓解型居多。
不同免疫细胞的一系列免疫反应与本病的发病机制有关。树突状细胞活化后并将自身抗原呈递给CD4+T细胞,而后分化为Th1细胞和Th17细胞,活化炎性巨噬细胞、小胶质细胞和CD8+T细胞。此外,B细胞和抗体的产生在MS发病机制中也起着重要作用[15]。过度免疫细胞的浸润导致中枢神经系统中的脑源性T细胞发生免疫应答,导致脱髓鞘和神经退行性变,这也是MS的发病机制[16]。MS病因目前尚不明确,大多数都是由病毒或炎症性感染引起的脊髓侧角营养神经功能受损导致的运动功能障碍。遗传因素和环境因素占疾病风险约70%,但人们对环境在疾病发展中的作用知之甚少[17]。环境因素可能包括吸烟、对人类疱疹病毒的暴露和体内维生素含量过低[17-18]。肠道菌群可能在MS、RA、SLE、克罗恩病等AID的易感性和安全性中发挥主导作用[19]。
1.3 RA
RA是一种以滑膜炎为主要病理表现的慢性炎症性AID,具有对称性、多关节和侵袭性,发病率0.5%~1.0%[20-21]。RA易造成宿主关节炎症、组织损伤、促炎淋巴细胞的激活和分化[22]。
RA病因繁杂,遗传、环境、免疫等因素在RA发病机制中发挥作用。研究发现,RA患者体内存在Th1细胞和Th17细胞的异常增生,炎性细胞因子发生级联反应,机体自身抗原免疫耐受紊乱,自身抗体过度表达[23]。在RA患者体内,软骨和滑膜血管翳表面上的成纤维样滑膜细胞大量分泌基质金属蛋白酶,使软骨组织中富含的胶原结构受到破坏,促进成纤维样滑膜细胞浸润[24]。另外,由于自噬和蛋白酶体活性增强,使成纤维样滑膜细胞对内质网应激诱导的细胞凋亡产生抗性[25]。成纤维样滑膜细胞的增殖能力与RA病程、滑膜中入侵的巨噬细胞数量以及软骨侵蚀严重程度相关[26]。
在RA患者外周血中发现,Th22细胞、Th17细胞和白细胞介素22(interleukin 22,IL-22)的含量均升高[27],并且Th22细胞与IL-22含量、疾病活动性评分和C反应蛋白含量呈正相关[28]。另外,在病情活动期的RA患者滑膜组织中检测到Th22细胞的存在,Th22细胞中的IL-22能促进CD14+单核细胞中活化的T细胞核因子C1的表达,促进破骨细胞分化[29]。IL-22可通过非受体型酪氨酸蛋白激酶2/信号传导及转录激活蛋白3和p38丝裂原活化蛋白激酶/核因子κB(p38 mitogen-activated protein kinase,p38 MAPK/nuclear factor κB,NF-κB)信号传导通路下调人滑膜成纤维细胞中NF-κB受体活化因子配体(RANKL)的表达,抑制破骨细胞的生成[30]。
1.4 其他免疫炎症性疾病
除以上3 种典型的AID以外,还包括原发性干燥综合征(primary Sjögren’s syndrome,pSS)、系统性硬化病(systemic sclerosis,SSc)、强直性脊柱炎(ankylosing spondylitis,AS)等。pSS主要临床表现为外分泌腺遭受淋巴细胞的浸润导致的患者分泌功能缺失,主要累及泪腺和唾液腺。它的发生和病情进展受环境、遗传等多种因素影响,但其发病机制目前尚未统一[31]。pSS尚无根治方法,主要措施为改善症状、控制和延缓因免疫反应而引起的组织器官损害的进展以及继发性感染。SSc早期以血管病变为主,随着病情的发展可累及全身多器官,其中肺部纤维化和肺动脉高压是患者主要的致死因素。SSc病因复杂,发病机制不明晰,其发病受遗传、环境等多因素的影响[32]。SSc尚无特效药物,早期治疗目的在于阻止新的皮肤和脏器受累,而晚期的目的在于改善已有的症状。AS主要病理特征为慢性炎症和异位骨化,有骨赘形成和脊柱关节强直。AS属风湿病范畴,病因尚不明确,很可能在遗传因素的基础上受环境因素(包括感染)等多方面的影响而致病[33]。AS治疗在于控制炎症,减轻或缓解症状,维持正常姿势和最佳功能位置,防止畸形。
2 AID与肠道菌群
研究发现,在多种AID患者中发现肠道菌群异常的现象,其潜在致病机制可能为肠道菌群移位和分子模拟、肠道代谢产物短链脂肪酸失调、旁观者激活及表位扩展等。
2.1 肠道菌群失调
AID患者常常伴有肠道菌群失调的现象。与健康人群相比,在门水平上,SLE患者粪便菌群中厚壁菌门/拟杆菌门比值下降,而经过糖皮质激素治疗的SLE患者的厚壁菌门/拟杆菌门比值上升;在属水平上,SLE患者乳球菌、链球菌和双歧杆菌丰富度降低,而经过糖皮质激素治疗后显著升高[34]。研究发现,活泼瘤胃球菌在SLE疾病活动指数较高的患者肠道中相对丰度是正常人群的6 倍[35]。同样地,在MS患者肠道内也发现了厚壁菌门/拟杆菌门比值有相似地变化[36]。另外,MS患者肠道内产丁酸盐的粪便杆菌丰度明显降低[37]。对新发RA患者的研究表明,多数患者的粪便中普雷沃氏菌相对丰度升高[38]。研究显示,与健康组对比,pSS患者在科水平有5 个丰度降低,1 个升高;属水平有10 个丰度升高,5 个下降;其中,拟杆菌科升高,而普雷沃菌科下降[39]。在对SSc患者肠道菌群的研究中发现,益生菌、梭状杆菌等有益共生菌属丰度降低,而潜在的致病菌属丰度上升,其中包括镰刀菌、反刍球菌和罕见的γ蛋白细菌等[40]。以上研究结果提示,AID可能存在相似的免疫异常激活机制。
2.2 肠道菌群参与AID的发生
2.2.1 肠道菌群移位和分子模拟
肠道菌群移位和分子模拟可能是潜在的致病机制。SLE患者常伴随着肠黏膜屏障结构受损的现象,从而使得肠道微生物发生移位现象,免疫系统被激活。鹑鸡肠球菌通常仅存在于正常人群肠道内,而SLE患者的“肠漏”导致肠道菌群发生移位,导致在患者肝脏中发现该种菌;在SLE患者血液中检测到鹑鸡肠球菌相应的抗体,该种抗体对人体抗双链DNA抗体同样具有较高敏感度,使得免疫系统不仅攻击鹑鸡肠球菌而且攻击自身组织[41]。长期以来,分子模拟常被认为是肠道菌群影响AID的另一种潜在机制。特定菌群蛋白与人体自身蛋白拥有类似表位,引发人体免疫系统对宿主自身抗原的识别和攻击。如携带有非直系同源模拟表位的肠道罗氏菌和多形拟杆菌能诱导人体免疫系统产生抗β2-糖蛋白Ⅰ和Ro60抗体等自身抗体[42-43]。在胶原诱导的关节炎模型中脆弱类杆菌、白假丝酵母菌和血链球菌的抗菌肽免疫交叉反应,诱导机体产生大量自身免疫抗体[44]。
2.2.2 肠道代谢产物短链脂肪酸失调
短链脂肪酸是肠道菌群发挥免疫调节作用的重要代谢产物,膳食纤维通过肠道菌群酵解产生多种短链脂肪酸,如乙酸、甲酸、丁酸等。不同肠道菌属代谢产生的短链脂肪酸种类和数量存在差异,其中梭状杆菌和拟杆菌门产生的短链脂肪酸受到广泛关注[45]。短链脂肪酸是组蛋白脱乙酰酶抑制剂,它能通过抑制组蛋白脱乙酰酶影响外周血T淋巴细胞,尤其是Th细胞。研究表明,短链脂肪酸通过组蛋白脱乙酰酶依赖性方式促进转录因子FOXP3表达、Th细胞产生和免疫抑制作用[46]。另外,将外周血单核细胞和中性粒细胞暴露于短链脂肪酸,可使NF-κB失活,促炎细胞因子和肿瘤坏死因子分泌量下降。因此短链脂肪酸因其对组蛋白脱乙酰酶的抑制作用被认为是NF-κB和促炎性固有免疫应答的关键调节剂[47]。除上述免疫调控途径外,短链脂肪酸还能通过免疫细胞和肠上皮细胞上表达的G蛋白偶联受体来实现。GPR43是其中一种G蛋白偶联受体,短链脂肪酸通过GPR43抑制中性粒细胞趋化因子分泌和Th细胞增殖。该调控途径能提高痛风患者体内免疫细胞清除尿酸单钠结晶的功能,缓解痛风患者临床症状[48]。当短链脂肪酸代谢失调时,其对免疫的调控作用也被大大削弱。研究发现,在RA患者体内观察到短链脂肪酸含量下降的现象[49],而通过补充丁酸能缓解RA小鼠的症状[50]。同样地,通过补充丁酸还能减轻SLE小鼠的皮损和肾炎严重程度[51]。
2.2.3 旁观者激活及表位扩展
在病毒感染过程中,各种免疫细胞依次被激活以消灭入侵的病毒。虽然这些免疫反应通常是有益的,但它们也可能对宿主造成附带损害,被称为“免疫病理”。免疫病理反应的性质可能受到非受感染病原体免疫反应的影响,即异源免疫。异源免疫反应主要包括2 种,即抗原依赖性T细胞和非抗原依赖性T细胞,其中抗原依赖性T细胞是由交叉反应的记忆T细胞激活,而非抗原依赖性T细胞是由细胞因子激活。上述现象称为旁观者激活[52]。随着炎症不断发展,新的抗原表位逐渐暴露,使得机体相继对更多抗原表位产生免疫应答,此现象称为表位扩展[53]。表位扩展的发生使得机体产生大量自身免疫抗体,导致AID的发生和发展。牙龈卟啉单胞菌是一种牙周炎致病菌,它能导致免疫炎症从对非瓜氨酸肽免疫应答扩展至对瓜氨酸肽的免疫应答[54],而瓜氨酸肽正是参与RA发病过程的因素之一[55]。另外,还在SLE患者体内发现鹑鸡肠球菌的表位扩展现象,鹑鸡肠球菌从肠道扩展至内脏器官后,诱导抗RNA抗体和抗dsDNA抗体产生,进一步促进抗β2-糖蛋白Ⅰ抗体的自身免疫应答[56]。
3 益生菌对AID干预策略
3.1 通过调节肠道菌群进行干预
抗菌药物是治疗肠道菌群失调最直接的方法,但抗菌药物治疗不具有选择性,它会将有害菌群和有益菌群同时杀死,随着治疗的进行,抗菌药物反而会加重肠道菌群失调[57]。相比之下,益生菌干预是一种改善AID患者肠道菌群失调更安全的策略。益生菌是对宿主生物的健康有益的活细菌,能通过维持肠道菌群动态平衡来实现对宿主免疫系统的调节作用,已有研究将微生物应用于人类和动物疾病的治疗[58]。推荐每次平均摄入剂量为109~1011CFU[59]。还有研究人员认为益生菌产品可能是抗生素的补充剂或替代品,因为益生菌能提高家禽的生长性能、肉质、骨骼健康和蛋壳质量[60]。
3.1.1 在动物模型中的应用
植物乳杆菌A7和动物双歧杆菌联合使用能通过增加IL-4、转化生长因子β(transforming growth factor β,TGF-β)、IL-10和Treg细胞,来改善实验性自身免疫性脑脊髓炎小鼠的症状;此外,IL-17、干扰素γ(interferon γ,INF-γ)、IL-6和Th1细胞水平均显著降低[61]。另一项研究将干酪乳杆菌、嗜酸乳杆菌、罗伊氏乳杆菌、两歧双歧杆菌和嗜热链球菌制成混合菌灌胃小鼠能改善其实验性自身免疫性脑脊髓炎的症状;同时,提高外周CD4+T细胞中的IL-4和IL-10的水平[62]。益生菌可通过调节转录因子FOXP3和GATA3的表达,抑制Th1细胞和Th17细胞分化,而对MS产生积极作用[63]。不同剂量的复合益生菌,包括短双歧杆菌、干酪乳杆菌、保加利亚乳杆菌、鼠李糖乳杆菌和嗜酸乳酸杆菌,干预胶原诱导的关节炎小鼠,能显著缓解小鼠关节肿胀程度及疼痛敏感性,降低炎细胞浸润;血清中IL-1β水平下降,脊髓中活化的p38 MAPK受到抑制[64]。
3.1.2 在AID患者中的应用
益生菌可有效调节肠道菌群,从而对MS患者免疫反应的平衡和调节具有有益影响[65]。因此研究人员正试图通过改变肠道菌群来寻找治疗MS的新方法。一项研究对31 例复发缓解型MS患者的菌群组成进行检测,在肠道菌群失调个体和感染个体中发现假单胞菌支原体、嗜血杆菌、布劳亚属和多列亚属丰度增加[66]。益生菌可以调节MS患者的免疫系统,并恢复肠道菌群平衡[67]。益生菌也被用作AID的辅助疗法,用于降低免疫炎症标志物水平,从而减缓疾病进展,延缓发病。通过对MS患者服用混合益生菌(嗜酸乳杆菌、干酪乳杆菌、双歧杆菌和发酵乳杆菌)胶囊进行为期12 周的辅助治疗,能有效控制MS患者的神经和中枢系统炎症及免疫。另一项研究也是通过口服混合益生菌(婴儿双歧杆菌、乳双歧杆菌、罗伊氏乳杆菌、干酪乳杆菌、植物乳杆菌和发酵乳杆菌)胶囊,促进血清中IL-10的水平,并且显著降低IL-6和超敏C反应蛋白水平[68]。也有研究将益生菌作为AID治疗的辅助手段。有研究将双歧杆菌和乳酸菌用于系统性硬化病的治疗,实验通过为期2 个月对10 例系统性硬化病患者进行益生菌干预发现,患者反流、腹胀等症状以及GIT 2.0疾病评分均得到改善[69]。目前AID均无法根治,多以缓解症状、减缓疾病进程为目标。而AID患者又恰恰多存在肠道菌群失调的现象,可以通过益生菌来调节肠道菌群,从而达到恢复肠道菌群稳态、调控免疫系统、缓解患者病症的目的。
3.2 通过调节免疫反应和免疫细胞进行干预
3.2.1 益生菌对免疫反应的影响
益生菌可通过调节宿主免疫反应,预防一些疾病的发生[70]。Hashemi等[63]在综述中提到,干酪乳杆菌具有免疫调节功能,包括:a)在小鼠实验中,干酪乳杆菌能预防由甲基胆碱诱导的癌变,并促进淋巴细胞免疫反应的下调;b)预防AID的发生,如糖尿病、慢性RA;c)预防由卵清蛋白诱导的免疫小鼠过敏反应。另外,该文中还提到短芽孢杆菌能产生抗原特异性免疫球蛋白,并且对实验性病毒感染小鼠具有抗感染的作用。在临床实验中发现[71],鼠李糖乳杆菌能通过增强体液免疫反应缓解由急性轮状病毒引起的儿童腹泻。
3.2.2 益生菌对免疫细胞的影响
益生菌能通过调节肠道菌群来发挥对免疫细胞的作用,涉及的免疫细胞包括树突细胞、单核细胞、巨噬细胞、自然杀伤细胞、Treg细胞、CD4+Th细胞等。
树突细胞、单核细胞和巨噬细胞是单核吞噬细胞系统中的3 种成员,在免疫系统中表现出多种功能。肠道菌群可与宿主先天免疫系统相互作用,调节肠道内细胞分化,在维持免疫耐受中发挥重要作用[72]。同时,微生物群也可以激活肠道中的耐受性树突细胞[73]。肠道菌群可与巨噬细胞相互作用,使宿主产生有益的免疫反应[74]。
自然杀伤细胞属于1型先天淋巴细胞,在先天免疫中起着最重要的作用[75]。静脉注射干酪乳杆菌亚种L.casey,对脾自然杀伤细胞具有激活作用[76]。而口服干酪乳杆菌亚种S,对小鼠脾自然杀伤细胞具有刺激作用[77]。因此,口服如干酪乳杆菌等类型的益生菌可在生命早期增强先天免疫[74]。另一项研究发现,双歧杆菌可刺激外周血单核细胞产生大量的IL-10,这表明双歧杆菌作用对象可能是抗炎细胞和调节性T细胞[78],因此可推断双歧杆菌可能是预防AID和炎症性免疫紊乱的重要益生菌[79]。许多研究表明,一些益生菌诱导先天免疫反应,可以帮助提高免疫力和健康[80]。
Treg细胞在免疫耐受的过程对维持免疫稳态起着至关重要的作用[81]。Spiljar等[82]研究发现,植物乳杆菌WCFS1能穿过肠,通过与CD103+DC互作,使细胞因子Th2水平增加,从而刺激调节性T细胞的生成。细胞因子Th2主要参与体液免疫应答,在过敏反应、某些AID中发挥重要作用[82]。Jiao Yuhua等[83]研究中提到,干酪乳杆菌BL23可刺激CD4+Foxp3和Treg细胞,以及维甲酸相关孤儿受体γt、Th17细胞和3型Treg细胞的表达。
CD4+Th细胞分为不同亚群,如Th1、Th2、Th17、Treg细胞和自然杀伤T细胞等[84]。其中Th17细胞特征为产生细胞因子IL-17。给予SLE患者外周血单个核细胞以IL-17后,IgG和IL-6水平明显上升[85]。Ghadimi等[86]研究发现,短双歧杆菌DSMZ 20213和鼠李糖乳杆菌ATCC 53103降低了脂多糖诱导的IL-17、IL-23、CD40和组蛋白乙酰化的表达,而略微增强了DNA甲基化。
4 结 语
AID病因和发病机制复杂且目前尚不清晰,就目前已知的研究结果表明,AID发病病因与肠道菌群密切相关,尤其是在发病早期。肠道菌群干预包括饮食调整、益生菌等,益生菌可以通过恢复肠道菌群稳态、修复肠道屏障功能、抑制促炎信号通路产生促炎因子,减缓AID疾病进程,是治疗AID的有效工具(图1)。随着益生菌干预策略的出现,AID进入了一个崭新的治疗阶段。与药物治疗相比,益生菌干预策略的副作用更小,适用范围更广,因此可能被认为是治疗AID的一条可行且充满希望的治疗方案。但由于益生菌菌种繁多、特性复杂,因此可从益生菌的菌株特异性入手,进一步探索不同AID的最适益生菌或益生菌相关制剂,明确分子机制和作用靶点,以及更多的临床前和临床研究评估益生菌的治疗效果。
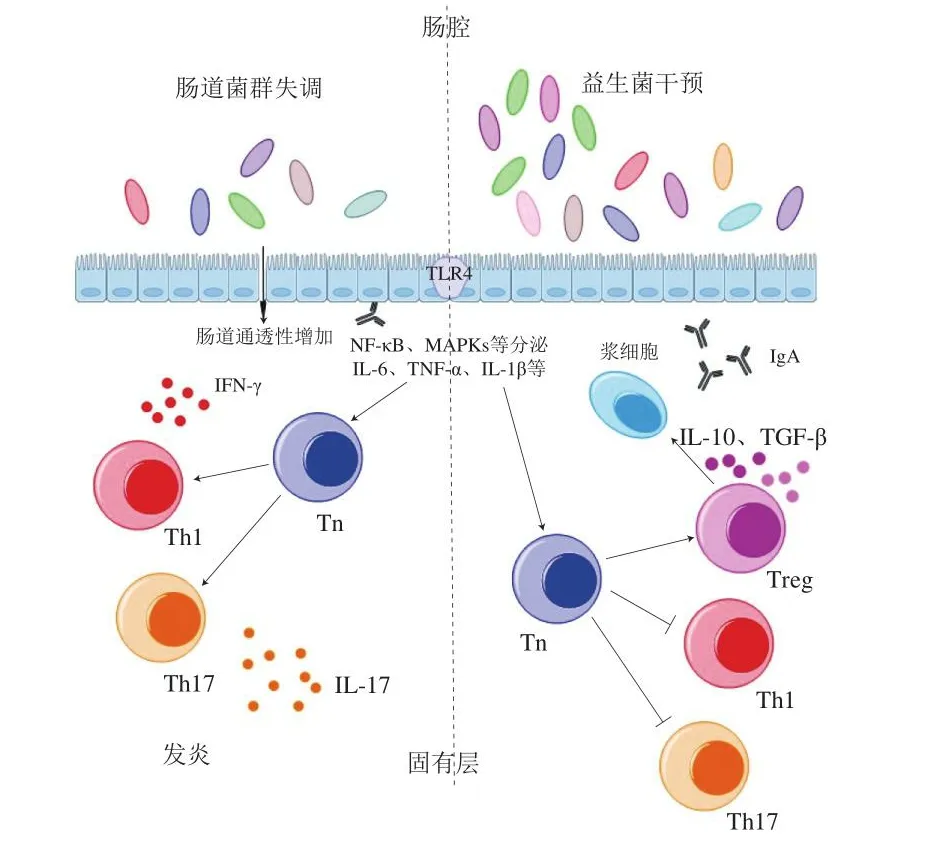
图1 益生菌缓解AID的机制Fig.1 Mechanism of action of probiotics in alleviating AID

